Протеасомы в апоптозе (гибели) клеток
Процесс транскрипционной активации белкового синтеза уравновешивается процессами катаболической утилизации белковых молекул посредством специальных органелл с мультипротеазной активностью — протеасом. Протеасомы локализуются в цитозоле и клеточном ядре.
Структурно протеасомы построены из субъединиц двух типов: некаталитических а и каталитических b, организованных в четыре уложенных стопкой тороидальных конструкций, каждая из которых является гомогептамером. Два центральных тора образованы b-субъединицами, а два периферических собраны из а-частиц.
В результате образуется надмолекулярный агрегат в форме полого цилиндра, имеющий в центральной части внутренней полости каталитические центры с трипсиноподобной, химотрипсиноподобной и каспазоподобной активностями — достаточно крупное образование с молекулярной массой около 700 000 и константой седиментации 20S (20S-протеасома).
Эта частица, однако, является функционально неактивной, поскольку для функционирования протеасомы необходимо присоединение к а-дистальным участкам цилиндра макромолекулярных активаторов. В настоящее время известно два таких активатора — РА28 и РА700 (Proteasome activator). Содержащая активаторы протеасома (26S-протеасома, мол. м. 2500 000) является функционально активной органеллой, выполняющей фрагментацию до олигопептидов, предназначенных для утилизации белков.
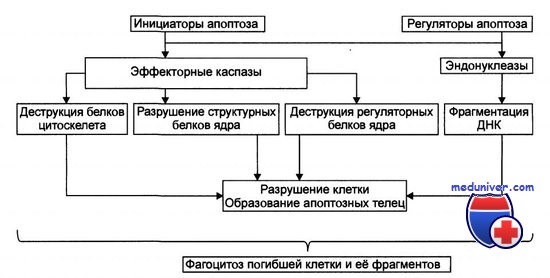
Для того чтобы стать субстратом протеасомной деградации, белковая молекула должна быть особым образом помечена. Меткой предназначенных для деградации в протеасомах молекул является малый белок убиквитин (76 аминокислотных остатков), который пришивается к обреченной белковой молекуле по остатку лизина специальными ферментами — убиквитинпротеинлигазами.
В процессе убиквитинирования белков участвуют три семейства ферментов: убиквитинактивирующий (Е1), убиквитинконъюгирующий (Е2) энзимы и убиквитинпротеинлигаза (ЕЗ). Первый из этих ферментов универсален и представлен единственным белком, выполняющим функцию активатора убиквитина. Белков семейства Е2 у млекопитающих насчитывается несколько десятков, они осуществляют перенос молекул активированного убиквитина от Е1 к ЕЗ и различаются между собой специфичностью обслуживаемых ферментов ЕЗ. Наконец, ферментов ЕЗ, выполняющих убиквитинирование (полиубиквитинирование) целевой молекулы белка, известно более сотни, и, видимо, именно они определяют высокую специфичность всей протеолитической системы.
Выполняя функцию деградации белковых молекул, протеасомы участвуют в процессах регуляции клеточного цикла, дифференцировки и апоптоза, а также формирования иммунного ответа: именно протеасомы расщепляют чужеродные белки до антигенных поли пептидов, которые впоследствии транслоцируются на поверхность антигенпрезентирующих клеток.
Среди субстратов протеасом идентифицированы транскрипционные факторы (NFkB, NFAT, р53), их предшественники (р100, р105) и ингибиторы (IkBs), циклины А, В, D, Е, многие регуляторные и эффекторные белки апоптозных каскадов (Вс1-2, Вах, каспазы-3, -6, -7, -8, -9, AIF). Примечательно, что белки семейства IAPs способны осуществлять двухуровневую защиту клетки от апоптоза: во-первых, взаимодействуя с прокаспазами-9, -3, -6, -7, они препятствуют протеолитической активации последних, а если она все-таки произошла, выполняют роль специфической убиквитинпротеинлигазы активных каспаз, а также проапоптогенных белков AIF и SMAC/DIABLO, подготавливая их к протеасомной деградации.
Хотя участие убиквитинзависимой протеасомной деградации белков в регулировании внутриклеточных сигналов смерти и выживания не вызывает сомнения, последствия применения ингибиторов протеасомной активности отнюдь не однозначны. Универсальный ингибитор протеасом лактоцистин вызывает индукцию апоптоза трансформированных клеток, торможение неоангиогенеза и метастазирования in vivo (новый лекарственный препарат Velcade, являющийся ингибитором протеасом, применяется в качестве противоопухолевого средства при злокачественных лимфомах). Одновременно с этим в клетках первичных культур применение протеасомных ингибиторов подавляет спонтанный апоптоз, что может быть связано с активацией транскрипционного фактора белков теплового шока — HSF-1 является одним из субстратов протеасом — и повышением уровня биосинтеза антиапоптогенных шаперонов.
Более отчетливо действие ингибиторов протеасом проявляется в модулировании цитокининдуцированного апоптоза: применение ингибиторов значительно повышает чувствительность лимфобластных клеток к TNFa, CD95L и TRAIL, а также к доксорубицину, что связывают с подавлением процесса активации транскрипционного фактора NF-kB — продукта альтернативного сигнального пути от рецепторов смерти: CD95 - RIP - TRAF - NF-кВ. Это служит дополнительным аргументом против существования универсальных магистральных апоптогенных путей и подчеркивает многоуровневый характер анализа сигналов смерти и выживания в процессе трансдукции сигнала программированной гибели клетки.
- Читать "Cигнальные системы гибели и выживания клетки при апоптозе"
Оглавление темы "Апоптоз клеток":- Роль каспаз в апоптозе клетки. Функции каспаз
- Рецепторы смерти клетки при апоптозе. Функции рецепторов смерти
- Роль митохондрий в апоптозе (гибели) клеток
- Роль факторов роста в апоптозе (гибели) клеток
- Роль гранзимов в апоптозе (гибели) клеток
- Белки теплового шока (HSPs — heat-shock proteins) в апоптозе (гибели) клеток
- Транскрипционные факторы NF-кВ и р53 в апоптозе (гибели) клеток
- Протеасомы в апоптозе (гибели) клеток
- Cигнальные системы гибели и выживания клетки при апоптозе
- Программированная гибель клеток (апоптоз) в цитостатической терапии
