Cигнальные системы гибели и выживания клетки при апоптозе
За последние годы опубликовано большое количество обзоров и монографий, освещающих различные стороны механизма программированной гибели клеток, накоплен огромный фактический материал, касающийся триггеров и элементов регулирования этого процесса.
Активно исследуются еще по крайней мере 3 типа проапаптогенных сигнальных каскадов: проапоптогенное действие экзо- и эндогенных церамидов; апоптогенный сигнал, обусловленный повреждением мембран эндоплазматического ретикулума и связанной с этим событием трансактивацией инициирующей каспазы-12; апоптогенные стимулы, связанные с гормональной рецепцией, или, напротив, ее отсутствием в гормонозависимых тканях.
Последний из упомянутых сигнальных каскадов на практике использует отдельное направление в онкологической химиотерапии — гормонотерапия злокачественных новообразований. Выраженного клинического эффекта применения антиэстрогенных лекарственных препаратов удается добиться при лечении гормонозависимых аденокарцином молочной железы и яичников.
Подавление продукции тестостерона позволяет приостановить развитие и даже вызвать регрессию рака предстательной железы. К слову, именно антимитогенное действие эстрогенных гормонов на ткани предстательной железы, впервые описанное будущим Нобелевским лауреатом Чарльзом Брентоном Хаггинсом в соавторстве с К. В. Ходжесом (Huggins С, Hodges C.V.) в 1941 г., положило начало развитию химиотерапии опухолей как самостоятельного метода лечения.
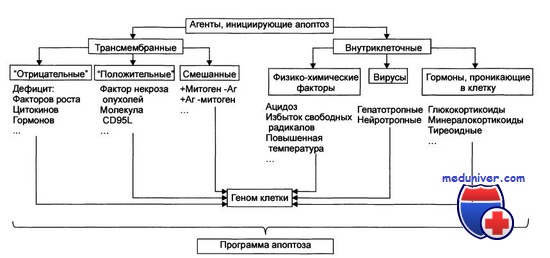
Сумма сигналов, часто противоречивых, постоянно получаемых клеткой от различных рецепторов и сенсоров, подлежит постоянному анализу, что, учитывая необратимость решения о самоликвидации, неудивительно. Сегодня еще мало известно, каким образом выполняется подобный анализ и как принимается решение. Поражает другое: в исполнении как проапоптогенной, так и антиапоптогенной программ клетки зачастую участвуют одни и те же исполнители.
В целом антиапоптогенным действием обладают разветвленные каскады митогенактивируемых протеинкиназ (МАРК), фосфоинозитол-3-киназа (PI-3-K) и многие серии-, тирозин- и треонинпротеинкиназы. Хотя протеинкиназы могут в определенных условиях участвовать в формировании проапоптогенных стимулов, общий баланс их активности смещен к поддержанию программы выживания и пролиферации, а применение ингибиторов протеинкиназ смещает акцент в сторону преобладания апоптогенных стимулов, с чем связывают возможность их использования для модуляции чувствительности клеток к лекарственно-индуцированному апоптозу.
Ярким и важным для онкогематологии примером антиапоптогенных последствий активации протеинкиназ может служить постоянная гиперактивность химерной тирозинпротеинкиназы BCR-ABL — результат хромосомной транслокации t(9;22), характерной для хронического миелоцитарного лейкоза. Специфический ингибитор этого химерного фермента — противоопухолевый препарат гливек (STI-571 —Signal Transducer Inhibitor) — даже в режиме монотерапии способен подавить опухолевый рост и вызвать состояние длительной ремиссии.
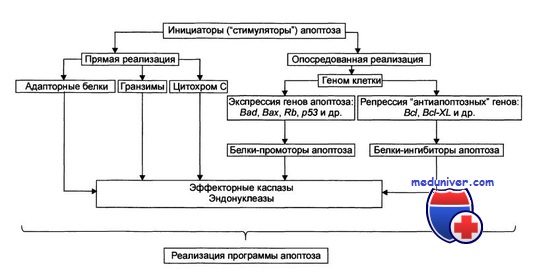
Этот же препарат оказывается эффективным в отношении гастроинтестинальных стромальных опухолей при условии экспрессии их клетками рецепторной тирозинкиназы с-Kit. Высокой противоопухолевой активностью обладают также неспецифические ингибиторы протеинкиназ стауроспорин и ребеккамицин.
Наличие упомянутого выше дуализма рецепторов смерти, белков теплового шока и протеасом в индукции и проведении про- и антиапоптогенного стимула осложняется обнаруженными в недавнее время функциями активных каспаз (в том числе и «казнящих») вне апоптогенного стимула, связанными с пролиферацией, дифференцировкой клеток и межклеточной сигнализацией.
При этих процессах активность отдельных каспаз может даже превышать таковую в апоптотически погибающих клетках, наблюдается разрушение некоторых каспазных субстратов (ламины ядра, PARP), но процесс самоликвидации клеток тем не менее не запускается. Так, активация каспаз сопровождает митогенную стимуляцию лимфоцитов фитогемагглютинином, ИЛом-2 и возбуждением TCR/CD3. Причем в последнем случае применение ингибиторов каспаз подавляет клеточную пролиферацию.
Очевидно, сигнальные пути клеточной дифференцировки, пролиферации и программированной гибели переплетены в значительно большей степени, чем это представляется сегодня. Вполне вероятно, что сигнальной информацией служит не один отдельно взятый стимул, а совокупность, последовательность и, возможно, продолжительность серии сигналов, подобно буквам алфавита, выстраивающимся в определенную последовательность, несущих смысловую нагрузку слов и фраз, создающих все богатство языка. В связи с этим уместно упомянуть о появившейся недавно концепции «генных сетей апоптоза» как совокупности координированно функционирующих групп генов и их белковых продуктов.
- Читать "Программированная гибель клеток (апоптоз) в цитостатической терапии"
Оглавление темы "Апоптоз клеток":- Роль каспаз в апоптозе клетки. Функции каспаз
- Рецепторы смерти клетки при апоптозе. Функции рецепторов смерти
- Роль митохондрий в апоптозе (гибели) клеток
- Роль факторов роста в апоптозе (гибели) клеток
- Роль гранзимов в апоптозе (гибели) клеток
- Белки теплового шока (HSPs — heat-shock proteins) в апоптозе (гибели) клеток
- Транскрипционные факторы NF-кВ и р53 в апоптозе (гибели) клеток
- Протеасомы в апоптозе (гибели) клеток
- Cигнальные системы гибели и выживания клетки при апоптозе
- Программированная гибель клеток (апоптоз) в цитостатической терапии
