Гипервариабельные участки иммуноглобулинов. Конфигурационная ассиметрия участков иммуноглобулинов
Кристаллографический анализ Fab-фрагмента мышиного моноклонального IgA, продуцируемого плазмацитомой МсРс603 и связывающего фосфорилхолин, показал, что активный центр имеет клиновидную форму с размерами 1,5x20 нм2 и глубиной 2,0 нм. Из шести гипервариабельных участков (имеющихся в двух вариабельных доменах) в образовании центра участвуют пять: первый и третий легкой цепи и все три тяжелой.
Второй гипервариабельный участок легкой цепи «вытеснен» из полости центра петлей легкой цепи, образованной первым гипервариабельным участком и петлей третьего гипервариабельного участка тяжелой цепи. Большая глубина полости центра, связывающего фосфорилхолин, в сравнении с центром для витамина Ki обусловлена большей длиной петель гипервариабельных сегментов: первого легкой цепи и третьего тяжелой цепи — на три остатка каждого.
Замечательно, что фосфорилхолин занимает только часть полости активного центра; это (как будет обсуждаться ниже) вообще типичное явление, служащее структурной основой полиспецифичности антител, т. е. способности антитела к определенному лиганду связывать еще и другие не родственные первому лиганду соединения.
Различия не только состава гипервариабельных участков, но и их длины обеспечивают структурное многообразие активных центров. Наиболее вариабельны по длине первый гипервариабельный участок легкой цепи (может варьировать на 6 остатков) и третий гипервариабельный участок тяжелой цепи. При этом, как правило, указанные гипервариабельные участки структурно связаны между собой.
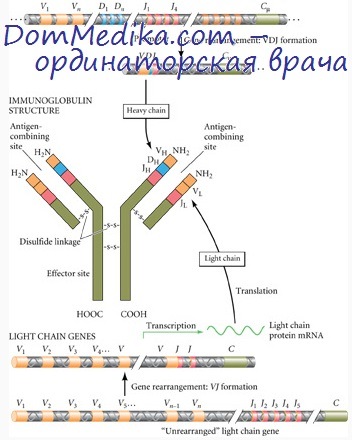
Не менее значимо, по-видимому, взаимодействие первого гипервариабельного участка тяжелой цепи с третьим гипервариабельным участком легкой цепи. Иллюстрацией этому служит иммуноглобулин плазмацитомы S107, связывающий фосфорилхолин. В активном центре этого белка взаимодействуют остаток глутаминовой кислоты, находящийся в позиции 35 тяжелой цепи (первый гипервариабельный участок), и остаток тирозина в позиции 94 третьего гипервариабельного района легкой цепи. Благодаря этому стабилизируется конфигурация полости, в которой располагается лиганд—фосфорилхолин.
То, что это действительно так, показывает изучение иммуноглобулина, продуцируемого мутантом U4 плазмацитомы S107. Он отличается от иммуноглобулина, о котором шла речь выше, только одной аминокислотной заменой: остаток глутаминовой кислоты в позиции 35 тяжелой цепи заменен аланином. И этого достаточно, чтобы мутантный белок не связывал фосфорилхолин (S. Rudikoff et al., 1981).
Возможно, что конфигурационная асимметрия вариабельных участков легкой и тяжелой цепей (обусловленная неодинаковой протяженностью и различиями строения) служит причиной полиспецифичности антител — неполного структурного соответствия центра единственному лиганду. В качестве примера можно привести уникальный белок, продуцируемый клетками миеломы Rei и состоящий из димера двух вариабельных доменов легкой (х) цепи.
Димер удается получить в кристаллическом виде вместе с лигандом — тринитрофенильной группой. Симметрично расположенные петли гипервариабельных участков образуют глубокий щелеподобный карман. Тринитрофенильная группа заполняет этот карман целиком, оказываясь в непосредственном контакте с остатками тирозина в позициях 49, 91 и 96 (на каждой из «стенок») и 36 (на «дне»). Не удивительно, если бы с помощью дифференциальной спектрофотометрии в полосе поглощения гаптена был бы обнаружен длинноволновый сдвиг, характерный для комплекса с переносом заряда между остатками тирозина в активном центре и тринитрофенильной группой как акцептором электронов.
- Читать далее "Вид активного центра иммуноглобулинов. Неспецифические или нормальные иммуноглобулины"
Оглавление темы "Гены иммуноглобулинов":1. Изучение антидетерминанты. Метод метки по сродству
2. Гипервариабельные участки иммуноглобулинов. Конфигурационная ассиметрия участков иммуноглобулинов
3. Вид активного центра иммуноглобулинов. Неспецифические или нормальные иммуноглобулины
4. Рентгеноструктурный анализ иммуноглобулинов. Полиспецифичность моноклональных иммуноглобулинов
5. Организация структуры антидетерминанты. Реакция гаптен-антитело
6. Кинетика реакции гаптен-антитело. Термодинамика реакции гаптен-антитело
7. Взаимодействия гаптен-антитело. Биосинтез иммуноглобулинов
8. Организация иммуноглобулиновых генов. Гены для тяжелых цепей иммуноглобулинов
9. Кодирование цепей иммуноглобулинов. Рекомбинации экзонов иммуноглобулинов
10. Причины вариации генов иммуноглобулинов. Реарранжировка генетического материала иммуноглобулинов
