Противовирусный иммунный ответ. Некроз и апоптоз
На примере герпетической инфекции рассмотрим особенности и этапы развития противовирусного иммунного ответа. Цикл репродукции вируса в клетке хорошо изучен и включает стадию проникновения вируса в клетку. Вирус герпеса простого проникает в клетку, используя различные рецепторы для проникновения. Оболочка вируса сливается с мембраной клетки, и вирусная ДНК, проникая через ядерную мембрану, встраивается в ДНК хозяина. Начинается стадия синтеза вирусных белков и репликации вирусной ДНК. Затем происходит сборка капсида в ядре и выход вируса из клетки.
Механизмы врожденного иммунитета представляют первую линию защиты от проникновения патогенов. Вначале вирус подвергается атаке таких белков врожденного иммунитета, как комплемент, противомикробные пептиды, природные IgM. На эпителиальных клетках слизистых и клетках врожденного иммунитета (макрофагах, дендритных клетках, нейтрофилах и др.) экспрессируются различные паттерн-распознающие рецепторы (TLR 1-9), Эти рецепторы распознают общие молекулярные последовательности — паттерны. Так, TLR2 распознает гликопротеины оболочки вируса герпеса простого, TLR9 распознает неметиллировааные CpG-мотивы вирусной ДНК.
В результате взамодействия с рецепторами происходит активация сигнальных путей через ядерный фактор транскрипции NF-kB и увеличивается экспрессия генов провоспалительных цитокинов и интерферонов 1-го типа, блокирующих репликацию вируса в клетке и обладающих протективным действием по отношению к неинфицированным клеткам. Плазмацитоидные дендритные клетки являются главными продуцентами интерферонов 1-го типа, активирующих NK- и NKT-лимфоциты Активация NK-клеток наблюдается в течение двух суток вирусной инфекции.
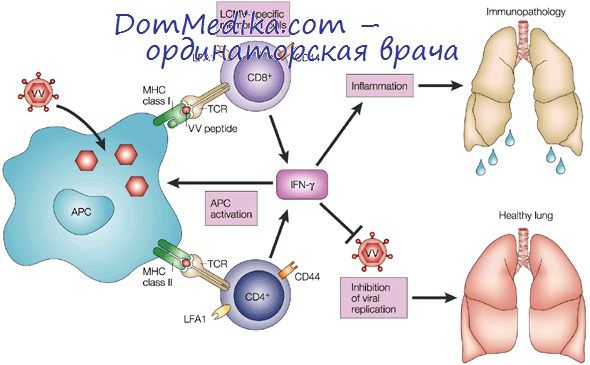
Развиается локальная воспалительная реакция. Миелоидные дендритные клетки, пришедшие в очаг инфиицрования, фагоцитируют разрушенные вирус-инфицированные клетки, и вирусные пептиды встраиваются в молекулы HLA классов I и II, затем эти клетки созревают и мигрируют в региональный лимфатический узел, где происходит презентация вирусных пептидов специфическим клонам ThO и CDS* T-лимфоцитов. С этого момента включаются механизмы адаптивного иммунного ответа. Происходит активация, пролиферация и дифференцировка специфических клонов наивных Тh1- и Тh2-лимфоцитов. Thl вырабатывают цитокины ИЛ-2 и ИФН-у, которые активируют NK, макрофаги и цитоксические Т-лимфоциты. Th2 секретируют ИЛ-4, -5, -6 и вызывают развитие гуморального иммунного ответа.
В элиминации вирус-инфицированных клеток участвуют цитотоксические Т-лимфоциты, естественные киллеры, активированные макрофаги. Антитела, вырабатываемые плазматическими клетками, связывают и нейтрализуют внеклеточные вирусные частицы, участвуют в развитии антитело-зависимой клеточной цитотоксичности, комплемент-опосредованного лизиса инфицированных клеток и Fc-опосредованного фагоцитоза. В результате иммунного ответа формируются специфичные клетки памяти. Однако в процессе эволюции вирусы выработали механизмы уклонения от иммунного надзора. Антигенная вариабельность и переход в латентное состояние — наиболее эффективные механизмы. Помимо этого, вирусы блокируют систему интерферонов, экспрессию вируснных пептидов в комлексе с HLA молекулами на поверхности клетки: синтезируют аналоги цитокинов и их рецепторов, блокируют апоптоз вирус-инфицированных клеток.
В последние годы внимание ученых-иммунологов обращено на разработку инновационных технологий, направленных на регуляцию системы врожденного иммунитета. Это применение агонистов и антагонистов Toll-подобных рецепторов, растворимых рецепторов врожденного иммунитета, микро-РНК, цитокинов и антицитокиновых антител и др.
Некроз и апоптоз
По классификации, предложенной в 2005 г. Комитетом по номенклатуре клеточной гибели NCCD (Nomenclature Committee on Cell Death) и основанной на морфологических проявлениях, выделяют различные формы клеточной гибели: апоптоз, аутофагию, некроз, митотическую катастрофу, ороговение и др.
Важно отличать две самые распространенные из них — некроз и апоптоз.
Некроз развивается под действием на клетку внешних повреждающих агентов или неадекватных условий среды, таких, как гипоосмия, крайние значения рН, гипертермия, механические воздействия, формирование пор в мембране с участием факторов комплемента, действие других агентов, повреждающих мембрану.
Термин «апоптоз» (в переводе с греч. — «опадание листьев») введен в 1972 г. Дж. Керр (/. Kerr) и соавт., которые исследовали личинок круглых червей нематод и наблюдали в определенной стадии развития одновременную гибель одного и того же числа клеток. Возникла мысль о запрограммированной клеточной гибели. В пролиферирующих тканях млекопитающих тоже происходит запрограммированная гибель клеток. Так, апоптозу подвергаются стадиеспецифичные ткани в эмбриогенезе, пролиферирующие клетки в отсутствие факторов роста, Т- и В-лимфоциты в процессе селекции, короткоживущие клетки крови. Апоптоз может быть индуцирован активацией лимфоцитов.
Таким образом, под апоптозом понимают форму гибели клетки в ответ на действие физиологических сигналов или в результате включения генетической программы. Морфологические изменения при апоптозе: округление клеток, сокращение псевдоподий, уменьшение клеточных объемов (пикнозис), конденсация хроматина, фрагментизация ядра (кариорексис), модификация клеточных органелл.
Ключевые отличия апоптоза от некроза заключается в том, что процесс апоптоза начинается с дезорганизации хроматина и, как следствие, фрагментации ядра, затем клетка распадается на апоптотические тельца, в дальнейшем фагоцитируемые. Таким образом, в случае апоптоза гибель клетки не приводит к воспалению и практически не влияет на окружающие клетки. Обычно апоптотировавшие клетки фагоцитируются макрофагами и другими клетками. При некрозе ключевой момент — увеличение проницаемости мембраны и ее разрыв. Это приводит к скоплению вокруг гибнущих клеток их активных внутриклеточных компонентов (включая энзимы), закислению среды и развитию воспаления.
В нормальной физиологии клетки роль апоптоза столь же велика, как и роль митоза. Апоптоз необходим при элиминации из организма клеток, пораженных различными патогенами; старых клеток, прекращающих выполнять свои функции; клеток гормонально-зависимых тканей при снижении концентрации гормонов.
Гибель лимфоцитов при апоптозе - важный механизм регуляции в иммунной системе и средство поддержания иммунного гомеостаза в организме.
- Читать далее "Развитие и этапы апоптоза. Индукция апоптоза"
Оглавление темы "Апоптоз и главной комплекс гистосовместимости":1. Противовирусный иммунный ответ. Некроз и апоптоз
2. Развитие и этапы апоптоза. Индукция апоптоза
3. Эффекторная стадия апоптоза. Стадия деградации апоптоза
4. Регуляция апоптоза. Гены отвечающие за апоптоз
5. Значение апоптоза. Участие апоптоза в иммунном ответе
6. Иммуногенетика. Система HLA
7. Свойства HLA. Полиморфизм генов главного комплекса гистосовместимости
8. Иммунопатология. Повреждение тканей
9. Активация тучных клеток. Гиперчувствительность второго типа
10. Гиперчувствительность третьего типа. Клеточно-опосредованная гиперчувствительность замедленного типа IV
