Фаза возбуждения кардиомиоцитов (КМЦ) сердца (фаза 0 потенциала действия)
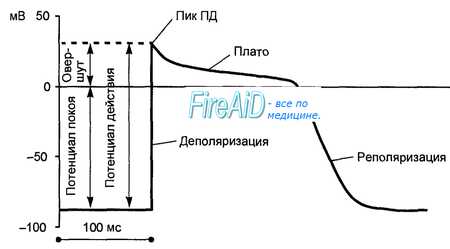
Стимул, поступающий в возбудимую ткань, индуцирует развитие потенциала действия (ПД), характеризующегося внезапным изменением напряжения, вызванным временной деполяризацией с последующей реполяризацией. Потенциал действия (ПД) проходит через все сердце, инициируя каждое сердечное сокращение. Электрические изменения потенциал действия (ПД) следуют в строго определенное время, различия в напряжении зависят от специфичности клеток.
В нервной ткани процесс завершается за несколько миллисекунд, тогда как в кардиальных волокнах человека ПД длится несколько сотен миллисекунд. В норме ПД не зависит от величины деполяризационного стимула, если последний достигает определенного порогового потенциала. Небольшой подпороговый деполяризационный стимул деполяризует мембрану пропорционально силе стимула.
Тем не менее, когда стимул становится настолько интенсивным, чтобы снизить МП до пороговых значений от -70 до -65 мВ для нормальных волокон Пуркинье, более интенсивный стимул не продуцирует больший ответный ПД и обеспечивает ответ типа «все или ничего». Напротив, за счет гиперполяризационого ритма МП становится более отрицательным, а вызванный ответ пропорционален силе стимула.
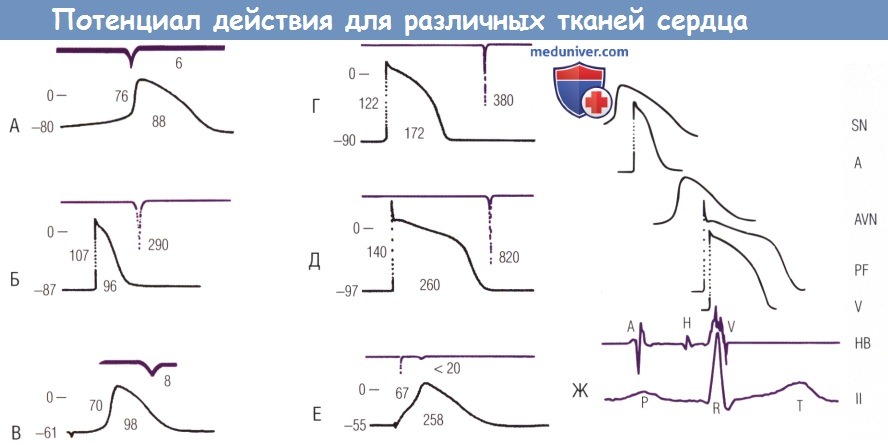
(А-Е) Первая (верхняя) запись является dV/dt от фазы 0, вторая (нижняя) запись — ПД.
Значения для каждой части означают (слева направо) максимальный диастолический потенциал (мВ), амплитуду ПД (мВ), длительность ПД 90% от реполяризации (мсек) и Vmax фазы 0 (V/сек).
Нулевой потенциал обозначен короткой горизонтальной линией рядом с нулем слева вверху от каждого ПД. (А) СУ кролика.
(Б) Предсердный миокард собаки.
(В) АВ-узел кролика.
(Г) Миокард желудочка собаки.
(Д) Волокна Пуркинье сердца собаки.
(Е) Пораженный желудочек сердца человека.
Нужно отметить, что ПД, зарегистрированные в (А), (В) и (Е), имеют сниженную амплитуду мембранного потенциала покоя и Vmax по сравнению с другими ПД.
Потенциалы: А — предсердие, AVN — АВ-узел, НВ — пучок Гиса, PF — волокна Пуркинье, SN — синусовый узел, V — желудочек.
Горизонтальная калибровка: слева — 50 мсек для (А) и (В), 100 мсек — для (Б), (Г-Е); справа — 200 мсек.
Вертикальная калибровка: слева — 50 мВ.
Горизонтальная калибровка: справа — 200 мсек. II — поверхностное отведение.
а) Механизм фазы 0 возбуждения - быстрой деполяризации. Распространение потенциала действия (ПД) по миокарду предсердий и желудочков, а также по волокнам системы Гиса-Пуркинье является результатом резкого повышения мембранной проводимости для Na+. Стимул, приложенный снаружи, или спонтанно возникший локальный мембранный замкнутый ток еще до распространения ПД деполяризует значительный по величине участок мембраны при существенно быстрой скорости открытия Na+-каналов с последующей деполяризацией мембраны.
Когда стимул активирует достаточное количество Na+-каналов, ионы Na+ попадают внутрь клетки, снижая свой электрохимический градиент. Возбужденная мембрана не ведет себя больше как электрод К+ (т.е. проницаема исключительно для К+), а, наоборот, становится ближе к электроду Na+, в свою очередь, МП приближается к равновесному потенциалу для Na+.
Скорость, при которой происходит деполяризация в период фазы 0 (т.е. максимальная скорость изменения напряжения во времени), определяется выражением dV/dtmax или Vmax, что является приблизительным значением скорости и величины тока Na+ внутрь клетки, которое и определяет скорость проведения распространяющегося ПД. Временное повышение проводимости для натрия длится 1-2 мсек.
Считается, что ПД, или ток Na+ (INa), что более правильно, является самовосстанавливающимся, т.е. внутриклеточное движение небольшого количества Na+ деполяризует мембрану в большей степени и в большей степени повышает проницаемость для Na+, что приводит к входу в клетку большего количества Na+ и т.д. По мере прохождения процесса [Na+]i и положи тельный внутриклеточный заряд повышаются, при этом снижается движущая сила для Na+.
Когда достигается равновесный потенциал для натрия (ENa), он больше в клетку не проникает. Это значит, что движущая сила, воздействующая на ион для проникновения его в клетку, уравновешивает движущую силу, воздействующую на ион для его выхода из клетки, при этом самостоятельные потоки отсутствуют. Проводимость для Na+ зависит от времени, поэтому, когда мембрана имеет некоторое время менее отрицательное напряжение, чем потенциал покоя, проводимость для Na+ снижается (т.е. происходит инактивация).
Следовательно, воздействие (например, острая миокардиальная ишемия), за счет которого на некоторое время снижается МП (но не пороговый), частично инактивирует Na+-каналы. Но если пороговый потенциал достигается, величина и скорость тока Na+ снижаются, обусловливая замедление скорости проведения импульса. Считается, что медиатором процесса инактивации канала является окклюзия внутреннего устья поры пептидной спиралью, связывающей домены III и IV.
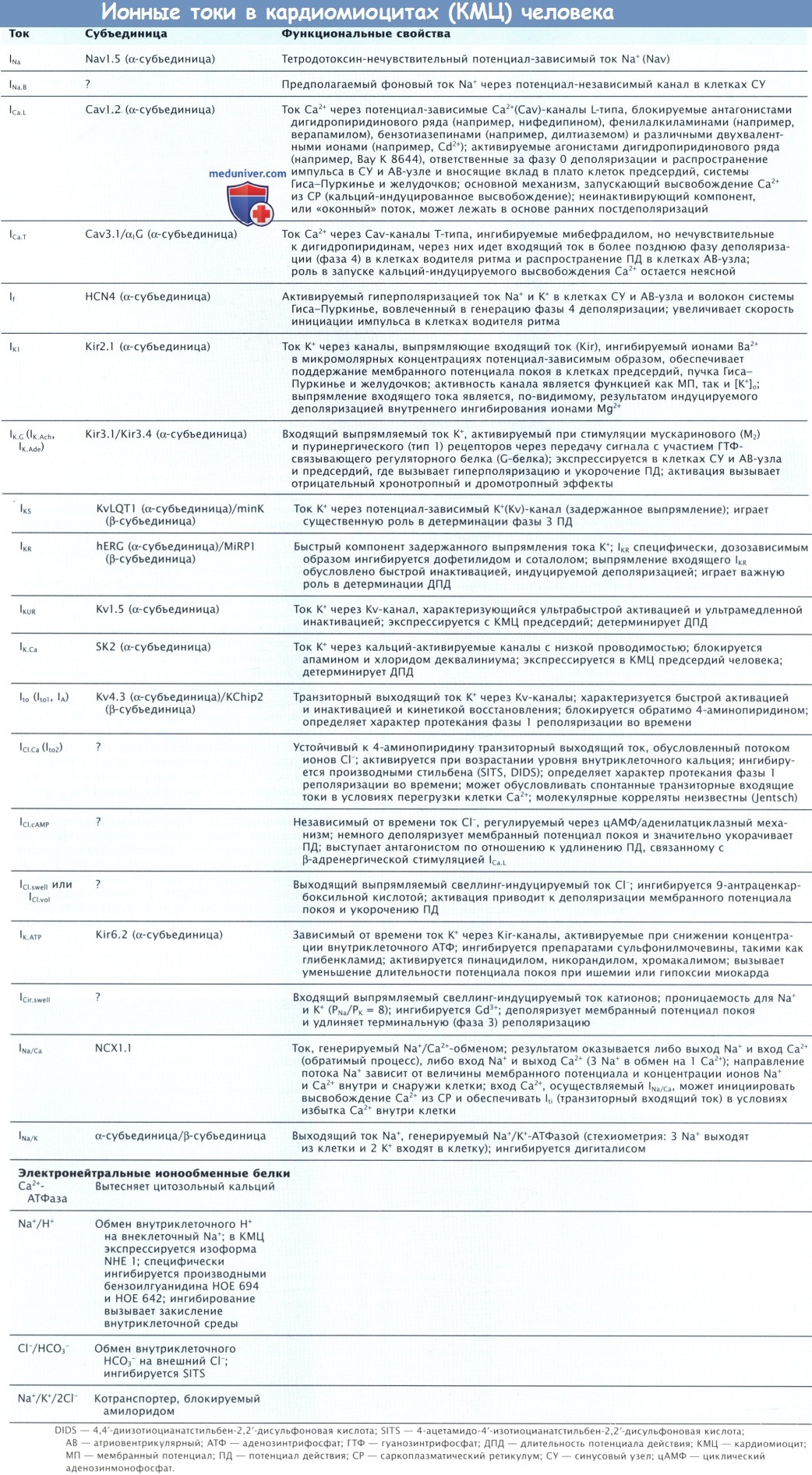
В волокнах Пуркинье сердца, в более мелких ответвлениях и в миокарде желудочка существуют две разновидности Na+-каналов (или два разных способа работы одинаковых Na+-каналов). Один отвечает за короткий ток Na+ в фазу 0, а другой, длящийся долго, принимает участие в формировании фазы плато ПД (потенциальный, или <оконный>, поток). Кардиальный потенциал-зависимый Na+ ток считается нечувствительным к тетродотоксину. Тем не менее сообщалось, что добавление тетродотоксина в наномолярпых концентрациях у собак укорачивало ПД волокон Пуркинье.
Это позволяет предположить, что чувствительные к тетродотоксину Nav-каналы играют определенную роль в генерации персистирующего компонента кардиальных Nav-токов, по меньшей мере в волокнах Пуркинье. Более того, этот ток может быть базовым током Na+ (INa-B) через потенциал-независимый канал в клетках синусового узла (СУ), который взаимосвязан с поведением водителя ритма.

б) Движение вверх потенциала действия. В нормально функционирующих предсердиях и желудочках, а также в волокнах системы Гиса-Пуркинье потенциал действия (ПД) распространяются очень быстро с большой Vmax, их называют быстрыми ответами. ПД в нормальных СУ и АВ-узлах, а также во многих типах поврежденной ткани обладают очень низкой проводимостью и сниженной Vmax. Эти ПД называют медленными ответами. Медиаторами медленных ответов является медленный входящий и в основном потенциал-зависимый ток Са2+ L-типа (ICa.L.) и, в меньшей степени, быстрый входящий ток INa.
Эти потенциалы названы потенциалами медленного ответа, поскольку для активации и инактивации медленного входящего тока (ICa.L.) требуется приблизительно на порядок меньше времени, чем для быстрого входящего тока Na+ (INa). Восстановление после инактивации также происходит дольше. Попадание в клетку и [Са2+]| способствуют процессу инактивации. Медленный канал открывается и закрывается медленнее и остается открытым более длительное время, а после прохождения импульса ему требуется большее время для реактивации.
Фактически восстановление способности к возбуждению превосходит по длительности полное восстановление максимального диастолического потенциала. Это означает, что, даже если МП возвращается к норме, возбудимость клеток полностью не восстанавливается из-за временной зависимости и зависимости от восстановления отдельного МП. Этот феномен называют постреполяризационной рефрактерностъю.
Порогом для активации ICa.L. является потенциал, которого клетка должна достичь, чтобы возбудить медленный входящий ток. Это приблизительно от -30 до -40 мВ. В волокнах быстрого типа ICa.L. обычно активируется в течение фазы 0 посредством восстановительной реполяризации, обусловленной быстрым током Na+. Тем не менее ICa.L. значительно меньше, чем пиковый ток Na+, и поэтому слабо связан с ПД до тех пор, пока быстрый ток Na+ инактивируется после завершения фазы 0. ICa.L. влияет в основном на период плато ПД, регистрируемый в миокарде предсердий, желудочков, а также в волокнах системы Гиса-Пуркинье.
Помимо этого ICa.L. может играть заметную роль в частичной деполяризации клетки, в которой быстрые Na+-капалы были инактивированы в условиях, подходящих для активации медленных каналов.
Пусковым механизмом для входа Са2+ в активированные Cav-каналы L-типа является высвобождение Са2+ из депо саркоплазматического ретикулума (СР) — это основной компонент сердечного возбуждения (сокращения сердца), происходящего в миокарде предсердия и желудочка. Cav-каналы L-типа также экспрессируются в СУ и клетках АВ-узла, где они контролируют автоматизм и распространение ПД соответственно. Кардиальные Cav-каналы L-типа подвергаются быстрой потенциальной Са2+-зависимой инактивации, длительность которой влияет на форму кривой ПД и длительность реполяризации. Тем не менее в миокарде человека были обнаружены Cav-каналы Т-типа. При проведении экспериментов на животных было показано, что эти каналы играют важную роль в определении автоматизма СУ и АВ-узлового проведения. Становится ли ток Са2+ через открытые каналы Т-типа пусковым механизмом для высвобождения Са2+ из СР, вопрос спорный.
Было обнаружено, что плотность Са2+ каналов Т-типа повышается в КМЦ при экспериментально индуцированной гипертрофии миокарда, но значение увеличения плотности каналов Т-типа в этих условиях остается неясной.
Есть другое существенное различие между быстрыми и медленными каналами. Лекарства, повышающие уровень цАМФ, такие как агонисты бета-адренорецепторов (АР), ингибиторы фосфодиэстеразы (теофиллин), а также жирорастворимое производное цАМФ — дибутирил цАМФ, повышают ICa.L.. Связывание агониста бета-АР со специфическими саркоплазматическими рецепторами способствует диссоциации двух субъединиц регуляторного белка (G-белок), один из которых (GS) активирует аденилатциклазу и таким образом повышает внутриклеточный уровень цАМФ. цАМФ связывается с регуляторной субъединицей цАМФ-зависимой протеинкиназы, что обеспечивает фосфорилирование специфических участков белка каналов. В результате повышается пропускная способность канала.
Однако Nav-каналы чувствительны к повышению цАМФ, суммарный эффект (снижение vs повышение) является видозависимым.
Ацетилхолин снижает ICa.L. путем уменьшения аденилатциклазной активности. Тем не менее ацетилхолин стимулирует аккумуляцию цГМФ. цГМФ оказывает незначительное воздействие на основной ICa.L., но снижает уровень ICa.L., повышенный вследствие воздействия агонистов бета-АР. Медиатором этого эффекта является гидролиз цАМФ вследствие влияния цГМФ-стимулированной циклической нуклеотидфосфодиэстеразы.
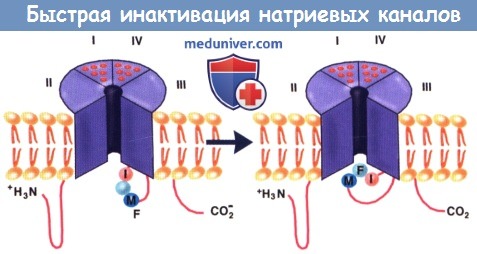
Внутриклеточная петля, связывающая участки III и IV натриевого канала, формирует как бы навесную крышку.
Критический радикал (Phe1489F) показан как закрывающий внутриклеточное отверстие поры.
в) Различия между каналами. Быстрые и медленные каналы могут различаться по своей фармакологической чувствительности. Лекарства с высоким уровнем специфичности, блокирующие медленный поток: верапамил, нифедипин, дилтиазем и D-600 (метоксилированный дериват верапамила). Антиаритмические препараты, такие как лидокаин, хинидин, прокаинамид и дизопирамид, влияют на быстрые, но не на медленные каналы.
Нормальный ПД, регистрируемый от СУ и N-области АВ-узла, имеет пониженные мембранный потенциал покоя, амплитуду ПД, отклонение и распространение, при этом скорость проведения сравнима с ПД в КМЦ и волокнах Пуркинье.
Блокаторы медленных каналов подавляют СУ и АВ-узловые ПД. Время реактивации ICa.L. удлиняется из-за того, что клетки СУ и АВ-узла остаются рефрактерными дольше, чем нужно времени для полной реполяризации. Ранняя стимуляция сразу после того, как МП достигает полной реполяризации, приводит к снижению амплитуд ПД и скорости проведения. Следовательно, для узловых клеток характерны медленное проведение и длительная рефрактерность. Эти клетки также обладают пониженным фактором безопасности проведения, т.е. эффективность стимуляции продвижения импульса низкая, и легко может развиться блокада проведения.
г) Входящие токи. INa и ICa.L. представляют собой два важных входящих тока. Другой важный входящий ток — If, называемый funny-ток или пейсмекерный ток. Этот ток активируется гиперполяризацией и обеспечивается ионами Na+ и K+. Он генерирует фазу 4 диастолической деполяризации в СУ. Модулирование If — один из основных механизмов, за счет которого бета-адренергические и холинергические нейротрансмиттеры регулируют сердечный ритм в зависимости от физиологических условий. Катехоламины повышают возможность каналов открываться за счет смещения кривой активации канала к большим положительным потенциалам, что приводит к увеличению способности потока генерировать диастолическую деполяризацию с последующим ростом частоты. Холинергические препараты оказывают противоположный эффект.
Электрофизиологические изменения, сопровождающие острую ишемию миокарда, могут выражаться в подавлении быстрого ответа в центре ишемизированной зоны и медленным ответом в пограничной области. Замедление активности миокарда было выявлено у пациентов, перенесших хирургическое вмешательство по поводу возвратной ЖТА. Играют ли медленные ответы какую-либо роль в генезе ЖА и какую именно, пока не установлено.
Видео физиология фаз потенциала действия кардиомиоцитов
- Читать "Фаза ранней быстрой реполяризации кардиомиоцитов (КМЦ) сердца (фаза 1 потенциала действия)"
Оглавление темы "Фазы потенциала действия кардиомиоцитов сердца":- Строение щелевого соединения вставочных дисков сердца и его функции
- Фазы потенциала действия кардиомиоцитов (КМЦ) сердца
- Мембранный потенциал покоя кардиомиоцитов (КМЦ) сердца (фаза 4 потенциала действия)
- Фаза возбуждения кардиомиоцитов (КМЦ) сердца (фаза 0 потенциала действия)
- Фаза ранней быстрой реполяризации кардиомиоцитов (КМЦ) сердца (фаза 1 потенциала действия)
- Плато потенциала действия кардиомиоцитов (КМЦ) сердца (фаза 2 ПД)
- Фаза конечной быстрой реполяризации кардиомиоцитов (КМЦ) сердца (фаза 3 ПД)
- Фаза диастолической деполяризации кардиомиоцитов (КМЦ) сердца (фаза 4 ПД)
- Механизмы автоматизма синусового узла сердца
- Потеря мембранного потенциала клеткой как причина аритмий
