Влияние таргетной противоопухолевой терапии на сердечно-сосудистую систему
Лечение многих злокачественных опухолей существенно изменилось за последние несколько лет благодаря появлению целевой терапии. В отличие от традиционной химиотерапии, мишенью которой является биологический процесс, присутствующий в большинстве клеток, целевая терапия направлена на специфический фактор, нарушенный в злокачественных клетках. Ожидалось, что такой подход уменьшит выраженность побочных явлений, свойственных стандартной химиотерапии (например, алопеции, токсического действия на ЖКТ, миелотоксичности), но в то же время будет более эффективным.
В определенной степени эти надежды оправдались, однако существуют опасения о кардиотоксичности некоторых препаратов.
Перед обсуждением токсических эффектов этих препаратов необходимо понять, что эти эффекты собой представляют, каковы их механизм и предпосылки появления. Большинство целевых противоопухолевых препаратов ингибируют активность тирозинкиназ, которые способствуют прикреплению фосфатной группы к тирозиновым остаткам белков, что меняет активность, внутриклеточную локализацию или скорость деградации белка. В здоровой клетке тирозинкиназы дикого типа (т.е. нормальные) выполняют множество функций в регуляции основных функций клетки.
Однако при лейкозах или злокачественной опухоли ген, кодирующий тирозинкиназу, амплифицируется, что ведет к его избыточной экспрессии, или мутирует, что приводит к постоянной активации и пролиферации опухолевых клональных клеток и/или блокированию их смерти в норме. Ингибирование этих киназ может, соответственно, замедлить процесс клеточной пролиферации и/или индуцировать гибель клеток. Кардиотоксичность появляется тогда, когда нормальные киназы, присутствующие в КМЦ, которые также угнетаются препаратами этой группы, начинают играть ключевую роль в поддержании гомеостаза КМЦ. В ряде случаев кардиотоксический эффект лекарственных средств можно предвидеть, но в большинстве случаев это невозможно.
Это обусловлено тем, что о целевой киназе, осуществляющей такую функцию, не было известно либо эффект оказался нецелевым (т.е. ингибирование коснулось других тирозинкиназ, а не той, на которую первоначально было направлено действие препарата). Большинство ингибиторов тирозинкиназы конкурируют с АТФ за место связывания с киназой. В человеческом геноме присутствуют около 500 протеинкиназ, из которых 90 — это тирозинкиназы. Большинство производителей лекарственных средств тестируют ингибиторы тирозинкиназ только по отношению к 40-50 киназам. Следовательно, возможно, что данный препарат ингибирует и другие тирозинкиназы, а также множество сериновых или треониновых киназ (другое большое семейство), о чем не будет известно ни онкологу, ни кардиологу, проводящим лечение конкретного больного.
Таким образом, если известно, что целевой фермент не играет существенной роли в поддержании гомеостаза КМЦ, а у пациента после начала терапии появились признаки СН, необходимо оценить как возможность нецелевого эффекта проводимой терапии, приведшего к проявлениям кардиотоксичности, так и вероятность других причин развития СН.
Препараты таргетной терапии и их мишени. Поскольку в настоящее время уже одобрены или находятся в стадии разработки множество лекарственных средств, имеющих одну и ту же молекулярную мишень, данный раздел главы построен на принципе перечисления молекулярных мишеней. При таком подходе любое новое лекарственное средство можно оценить по отношению к его мишени (мишеням), что позволит в некоторой степени предвидеть и возможные побочные явления. Чтобы лучше понять проявления кардиотоксичности, рассмотрим роль продукта мутантного гена в патогенезе рака, а также роль продукта нормального гена в КМЦ и клетках сосудов (если она известна). В тех случаях, когда данные о кардиотоксичности отсутствуют, обсудим теоретические предпосылки ее развития.
Первые препараты целевой терапии трастузумаб (герцептин) и иматиниб (гливек) являются представителями двух основных классов этих лекарственных средств. Трастузумаб — это гуманизированное моноклональное антитело, направленное против рецепторов фактора роста на поверхности опухолевой клетки, а иматиниб — низкомолекулярный ингибитор рецепторов или вну триклеточных механизмов, регулирующих рост злокачественной клетки. Все генетические названия моноклональных антител оканчиваются на «-маб», а низкомолекулярных ингибиторов — на «-ниб».
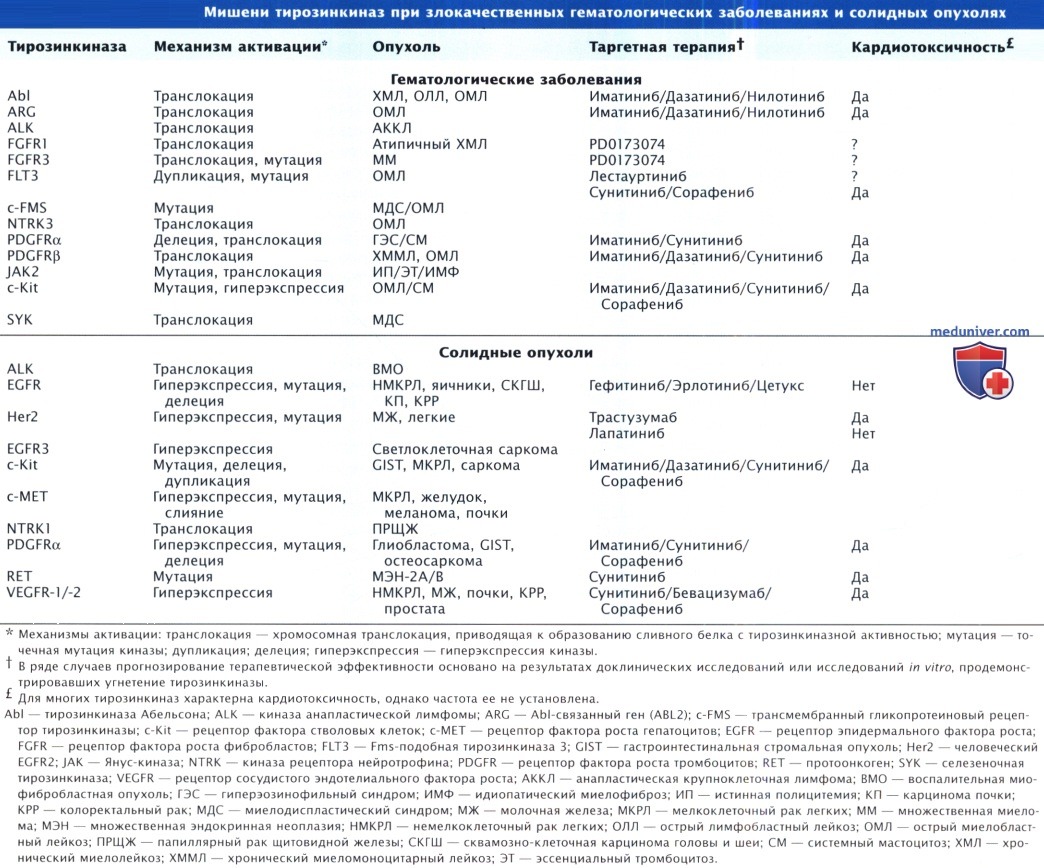
1. Her2 и Т растузумаб. Her2 амплифицируется в 15-30% случаев рака молочной железы. Наличие Her2-положительной опухоли ассоциируется с более плохим прогнозом. Амплификация и возникающие в результате нее чрезмерная экспрессия (почти 100-кратная) и активация Her2 ускоряют процессы клеточного цикла (и, соответственно, пролиферации) и угнетают апоптоз злокачественных клеток. Трастузумаб представляет собой гуманизированное моноклональное антитело, которое связывается с Her2 и подавляет их активность. Лечение трастузумабом повышает выживаемость пациентов в метастатической стадии заболевания, а в сочетании с хирургическим лечением уменьшает частоту рецидивов опухоли.
Трастузумаб пациенты переносят очень хорошо. Препарат имеет немного побочных эффектов, однако способен вызывать СН у ряда больных. В клинических исследованиях оригинального трастузумаба было обнаружено, что дисфункция ЛЖ развивается у 3-7% больных, а при сочетании его с терапией доксорубицином частота возрастает до 27% (при этом в 16% случаев регистрируют СН III—IV ФК). Для сравнения: комбинация антрациклинов с циклофосфамидом ассоциируется с развитием СН в 8% случаев, при этом III—IV ФК имеют 3% больных. При назначении трастузумаба в сочетании с паклитакселом кардио гоксический эффект был отмечен у 13% больных, при этом монотерапия паклитакселом обусловливала кардиотоксичность в 1% случаев.
Недавно кардиотоксичность трастузумаба была проанализирована в трех крупных исследованиях с участием больных раком молочной железы. В исследованиях оценивали эффективность препарата в качестве адъювантной терапии. В одном из исследований больные после хирургического лечения в сочетании с адъювантной либо неоадыовантной химиотерапией и/или лучевой терапией были рандомизированы в группы терпентина или простого наблюдения. Пациентов исключали из исследования, если: (1) ранее было проведено облучение средостения; (2) после химиотерапии или лучевой терапии они получали доксорубицин в дозе > 360 мг/м2 или эпирубицин в дозе 720 мг/м2; (3) после химиотерапии или лучевой терапии ФВ < 55%.
Кроме того, были исключены пациенты с СН, ИБС с ИМ и зубцом Q, пациенты, получающие лекарственную терапию по поводу стенокардии, неконтролируемой гипертензии, пороков клапанов сердца пли нестабильных нарушений ритма. Через 1 год наблюдения значимое снижение ФВ ЛЖ было выявлено у 7,1% больных, получавших трастузумаб, по сравнению с 2,2% пациентов из группы наблюдения. Кроме того, в 1,7% случаев в группе грастузумаба развилась симптомная СН по сравнению с 0% в группе наблюдения. Эти данные свидетельствуют об определенной степени риска терапии трастузумабом в ближайшем периоде у пациентов без ССЗ и с нормальной сократительной функцией ЛЖ, которые получали адъювантную химиотерапию в умеренных дозах и не подвергались облучению средостения.
В двух других исследованиях, из которых также были исключены пациенты с ССЗ в анамнезе или со сниженной ФВ на фоне терапии доксорубицином и циклофосфамидом, были обследованы больные, получавшие более «агрессивную » терапию — доксорубицин в сочетании с циклофосфамидом, а затем (1) плацебо по сравнению с паклитакселом или паклитакселом в сочетании с трастузумабом, а затем (2) плацебо по сравнению с трастузумабом. Средняя продолжительность наблюдения составила 27 мес.
Важно, что 6,7% больных не могли быть включены в фазу терапии трастузумабом, поскольку после терапии доксорубицином и циклофосфамидом у них было отмечено снижение ФВ ЛЖ. В данном исследовании симптомная СН возникла у 8,7% больных, получавших трастузумаб, по сравнению с 1,6% пациентов, не получавших этот препарат. Кроме того, тяжелая СН в группе трастузумаба развилась в 2,2-4,1% случаев, а в группе плацебо — в 0,2-0,8%. Значимое снижение ФВ отмечалось в 2 раза чаще: 18-34% на фоне терапии трастузумабом vs 8-17% на фоне плацебо. Более низкая частота осложнений в этих трех исследованиях по сравнению с результатами ранее проведенных исследований объясняется не только более строгими критериями включения, но и тем фактом, что доксорубицин и трастузумаб назначали последовательно, а неодновременно. Однако, даже несмотря на более низкую частоту событий, около 20% больных были исключены из исследований из-за нарушений сердечно-сосудистой системы. В более поздние исследования широко включали пациентов с поражением лимфатических узлов. По-видимому, следует лечить пациентов без поражения лимфатических узлов и с весьма незначительным прогностическим значением Her2-положительного заболевания. Важно изучить у таких больных отношение риск-польза, поскольку у них даже незначительное увеличение риска СН может «перевесить» положительный эффект терапии .
Механизмы токсичности. Кардиотоксическое действие трастузумаба не было неожиданным, поскольку у мышей с нокаутным геном Her2 (у мышей его обозначают как ErbB2) спонтанно развивалась дилатационная КМП. По-видимому, рецептор гена ErbB2 у мышей участвует в поддержании функций КМЦ. Кроме того, КМЦ, выделенные из сердец таких мышей, оказались более чувствительными к токсическому действию антрациклинов, что подтверждает теорию об усилении токсического эффекта доксорубицина за счет угнетения восстановления клеток при ингибировании Her2. Соответственно, нейрегулин (эндогенный лиганд Her2) может уменьшать кардиотоксическое действие антрациклинов. Клеточные механизмы токсического эффекта, опосредованного ингибированием ErbB2, могут включать активацию внутреннего (митохондриального) механизма апоптоза за счет подавления BclxL, обладающего антиапоптозным действием, и усиления экспрессии BclxS, что ведет к дисфункции митохондрий и гибели клеток.
Изучение токсического действия трастузумаба. Продолжаются споры относительно обратимости кардиотоксического действия герцептина. Действительно, изменения ультраструктуры, выявляемые при биопсии, минимальны, а заболевание хорошо поддается стандартной терапии СН. У ряда больных рецидивов СН на фоне терапии не наблюдается. В наблюдательном исследовании из 27 пациентов с СН, развившейся на фоне терапии герцептином (герцептин назначали после курса лечения антрациклинами в сочетании с циклофосфамидом и, в ряде случаев, с паклитакселом), лишь у 1 пациента проявления СН персистировали. Кроме того, функция ЛЖ через 6 мес наблюдения в целом по группе улучшилась по сравнению с группой больных, продолжавших получать терапию. Тем не менее у 17 из 24 больных функция ЛЖ оставалась ниже исходных значений. Для решения этой проблемы нужно более длительное наблюдение.
В настоящее время разрабатывается ряд других препаратов, действующих на Her2, в т.ч. несколько ингибиторов гирозинкиназ. Один них — лапатиниб, мишенью которого являются одновременно EFGR и Her2. Этот препарат продемонстрировал на удивление низкий уровень кардиотоксичности в первых исследованиях. Причина этого феномена остается непонятной, поэтому необходимо проведение дальнейших исследований. Возможно, этот феномен связан с различными механизмами действия моноклональных антител и ингибиторов тирозинкиназ, в т.ч. с комплемент-зависимым лизисом клеток и цитотоксичностью, опосредованной антителами, которые индуцируются моноклональными антителами, но не ингибиторами тирозинкиназ.
2. Белок Bcr-Abl и иматиниб. Первым низкомолекулярным ингибитором направленного действия, который был успешно применен для лечения злокачественных новообразований, стал иматиниб. Этот препарат ингибирует активность белка Bcr-Abl, который является продуктом хромосомной транслокации, приводящей к появлению филадельфийской хромосомы, и представляет собой этиологический фактор 90% случаев хронического миелолейкоза (ХМЛ), а также некоторых наблюдений В-клеточного острого лимфобластного лейкоза. Данная транслокация обусловливает появление активной протеинкиназы, которая стимулирует пролиферацию и ингибирует апоптоз стволовых клеток в костном мозге, что ведет к развитию лейкозов.
Разработка иматиниба привела к революционным изменениям в терапии ХМЛ: в настоящее время 5-летняя выживаемость после установления диагноза составляет 90%, тогда как до внедрения иматиниба в клиническую практику данный диагноз означал для пациентов смертный приговор.
Недавно появилась информация о том, что иматиниб способен вызывать СН. Сведения о кардиотоксичности иматиниба стали неожиданностью, поскольку еще не было известно, что киназа c-Abl, экспрессируемая всеми клетками, включая КМЦ, и ингибируемая иматинибом, необходима для поддержания жизнеспособности КМЦ. Ингибирование c-Abl КМЦ активирует стрессовые реакции, приводящие к выраженной дисфункции митохондрий и гибели клеток. Частота дисфункции АЖ на фоне терапии иматинибом неизвестна, поскольку оценку этого параметра не проводили ни в одном исследовании иматиниба, однако в этих исследованиях были выявлены выраженные периферические отеки и одышка. Лишь в одном небольшом исследовании было предложено определять уровень МНУП, чтобы отличить отеки и одышку, вызванные дисфункцией ЛЖ, от отеков и одышки по другим причинам.
По данным исследования нового, более мощного ингибитора Bcr-Abl (и c-Abl) дазатиниба (спрайсела), который также угнетает активность Bcr-Abl, резистентного к иматинибу вследствие дополнительной мутации в домене киназы, частота СН составила 4%, при этом у 50% пациентов была СН 3-й и 4-й степеней тяжести по классификации National Institutes of Cancer, в которой степень 3 соответствует симптомной СН с ФВ от 20 до 40%. В данном исследовании средняя продолжительность терапии составила всего 6 мес. Однако больным лечение необходимо в течение всей жизни, поскольку после отмены терапии ХМЛ рецидивирует. В это исследование включали больных только с нормальной ФВ, что вновь подтверждает тот факт, что популяция пациентов, участвующих в клинических исследованиях, не соответствует реальной популяции, которая будет получать этот препарат. Вскоре появятся и другие препараты этой группы, в т.ч. нилотиниб (который приводит к удлинению интервала QT на 15-30 мсек), и до тех пор, пока частота кардиотоксичности не будет установлена, необходимо наблюдать больных, получающих эти лекарственные средства.
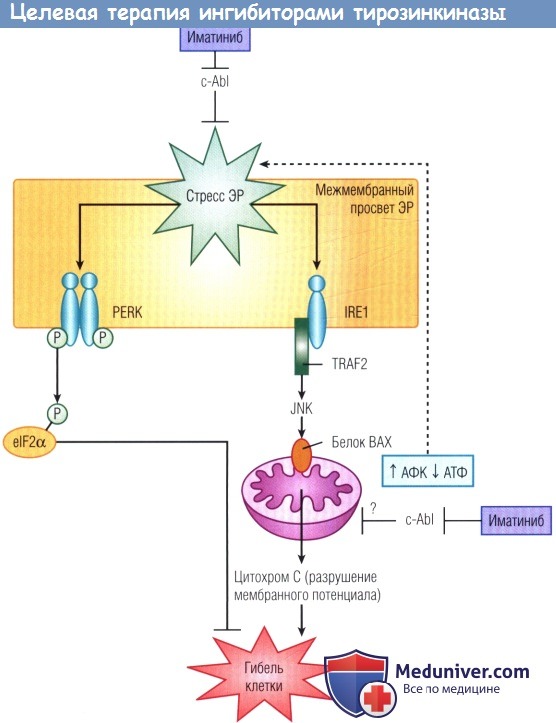
В условиях стресса в клетке активируется эндоплазматический ретикулум (ЭР) (система сигнальных каскадов ответа на белки с ненативными конформациями).
Активация сначала играет защитную роль — происходит фосфорилирование (Р) фактора elF2α PKR-подобной протеинкиназой эндоплазматического ретикулума (PERK), что блокирует процессы трансляции белков, уменьшая потребление АТФ.
Однако если стресс сохраняется, он приводит к реакции интегрального мембранного белка эндоплазматического ретикулума (IRE1) и фактора 2, ассоциированного с рецептором фактора некроза опухоли (TRAF2), опосредованной киназой N-концевого фрагмента фактора транскрипции c-Jun (JNK), которая способствует транслокации белка ВАХ на мембрану митохондрий. В результате высвобождается цитохром С и разрушается мембранный потенциал митохондрий.
Нерецепторная тирозинкиназа c-Abl может подавлять стресс эндоплазматического ретикулума опосредованно, путем предупреждения разрушения митохондрий, или непосредственно, за счет еще не установленных механизмов. Противоопухолевые препараты, действие которых направлено натирозинкиназы (например, иматиниба мезилат) могут усиливать апоптоз и поражать сердце путем ингибирования c-Ab, что ведет к постоянному стрессовому ответу эндоплазматического ретикулума.
АТФ — аденозинтрифосфат; АФК — активные формы кислорода.
3. Антагонисты рецептора эпидермального фактора роста (EGFR). Антагонисты EGFR достаточно широко используют при солидных опухолях, хотя эффективность этих средств, как правило, весьма умеренная. Препараты представляют собой либо моноклональные антитела, например цетуксимаб (эрбитукс) и панитумумаб, либо низкомолекулярные ингибиторы, например гефитиниб (иресса) и эрлотиниб (тарцева). В отличие от ингибиторов Her2 кардиотоксический эффект антагонистов EGFR наблюдается очень редко. В связи с этим при наличии признаков СН у пациентов, получающих эти препараты, необходимо тщательное обследование больного с целью выявления других причин поражения сердца.
4. Сосудистый эндотелиальный фактор роста и антагонисты рецепторов сосудистого эндотелиального фактора роста. В фармацевтической промышленности существует огромный интерес к препаратам, воздействующим на сосуды, кровоснабжающие опухоли. Поскольку VEGF и два его рецептора, VEGFR-1 и VEGFR-2, являются основными регуляторами ангиогенеза, а при многих солидных опухолях выявляется их чрезмерная экспрессия, они стали основными мишенями. Моноклональное антитело бевацизумаб (авастин) направлено против VEGF-А и в комбинации с химиотерапией повышает выживаемость при метастатическом колоректальном раке и метастатическом неплоскоклеточном немелкоклеточном раке легких. Таким образом, есть все основания полагать, что «противососудистая» терапия в скором времени будет составной частью многих схем лечения солидных опухолей. На фоне терапии бевацизумабом достаточно часто развивается гипертензия, которая является дозозависимой и может достигать 3-4-й степени тяжести у 8-18% больных. В некоторых исследованиях также было отмечено увеличение протеинурии.
На основании метаанализа 5 исследований было также высказано предположение о двукратном увеличении артериальных (но не венозных) тромбоэмболий. В данном анализе ФР были возраст и наличие тромбоэмболических событий в анамнезе. У пациентов старше 65 лет частота артериальных тромбоэмболий составила 8,5% по сравнению с 2,9% в группе больных, получавших только химиотерапию. Риск инсульта увеличивался приблизительно в 4 раза (1,9% vs 0,5%). Существуют также теоретические предпосылки для соблюдения осторожности при назначении этих препаратов больным ИБС из-за потенциальной возможности уменьшения формирования коллатеральных сосудов. СН на фоне монотерапии бевацизумабом развивается относительно редко (2%), однако частота СН может достигать 4%, если лечению бевацизумабом предшествовала терапия антрациклином или облучение, и 14% — при комбинации с антрациклинами.
Одобренными к применению препаратами, воздействующими на VEGFR, являются сунитиниб (сутент) и сорафениб (нексавар), в процессе разработки находится ваталиниб. Гипертензия часто развивается на фоне применения всех этих препаратов. Кроме того, сунитиниб и сорафениб были разработаны как препараты, имеющие своими мишенями несколько киназ, вовлеченных в процесс прогрессирования опухоли. Такое направление вполне оправданно при лечении рака, но применение мультитаргетных ингибиторов тирозинкиназ вызывает дополнительные опасения в отношении кардиотоксичности. В клиническом исследовании терапия сорафенибом ассоциировалась с развитием ОКС у 2,9% больных по сравнению с 0,4% пациентов в группе плацебо. В настоящее время установлено, что применение сунитиниба ассоциируется с дисфункцией ЛЖ и ХСН. В исследовании значимое снижение ФВ ЛЖ на фоне терапии было выявлено у 10% больных. Из исследования были исключены пациенты, имевшие СССоб в течение года до начала лечения. Пока не появилась иная информация, всем больным до начала терапии сунитинибом необходимо определять функцию ЛЖ. Всем пациентам, особенно с ССЗ, на фоне лечения необходимо тщательное наблюдение. Аналогичный подход показан в отношении больных, получающих сорафениб и, возможно, ваталиниб.
Ряд препаратов, включая иматиниб и сунитиниб, ингибируют c-Kit — рецептор фактора стволовых клеток, который мутирует или гиперэкспрессируется при некоторых лейкозах. c-Kit также экспрессируется на поверхности некоторых гемопоэтических стволовых клеток и клеток-предшественников, способных стать эндотелиальными клетками. У мышей с делецией c-Kit развивается дилатация ЛЖ, а также для них характерна большая степень угнетения функции ЛЖ после экспериментального ИМ, что дает возможность предположить важную роль клеток c-Kit+ в процессах постинфарктного восстановления. Учитывая эти данные, необходимо принимать во внимание возможные последствия постоянного подавления c-Kit.
5. Антагонисты сигнального пути JAK/STAT. Мутацию нерецепторной тирозинкиназы Янус-киназы 2 (JAK2) выявляют у большинства пациентов с истинной полицитемией и у некоторых больных идиопатическим миелофиброзом с миелоидной метаплазией. Предположительно мутантная JAK2 действует, по крайней мере частично, на проводник сигнала и активатор транскрипции (STAT) 3 в лейкемических клетках. Однако STAT3 также имеет важнейшее значение для поддержания плотности капилляров в сердце, что было продемонстрировано в исследованиях на мышах с делецией гена stat3. Роль STAT3, по-видимому, возрастает по мере старения животных. Механизмы заключаются в непосредственной регуляции экспрессии VEGF, индукции цитокинов, стимулирующих ангиогенез, и подавлении антиангиогенных генетических программ в сердце. Следует отметить, что мыши с нокаутом гена stat3 более чувствительны к кардиотоксическому действию доксорубицина. Эти данные свидетельствуют о необходимости тщательного изучения кардиотоксического действия ингибиторов JAK2, которые находятся в настоящее время в разработке.
6. Сосудорасширяющие препараты. Мишенью сосудоразрушающих лекарственных средств являются эндотелиальные клетки. В клиническом исследовании I фазы терапия одним из таких препаратов, ZD6126, направленным на тубулин эндотелиальных клеток, осложнилась ТЭЛА, бессимптомным повышением уровня КК-МВ и снижением ФВ ЛЖ. По-видимому, сосудоразрушающие препараты действуют не только на сосудистую систему опухоли, но и на здоровые сосуды. Таким образом, чтобы оценить потенциальное токсическое действие сосудоразрушающих препаратов, необходимы дополнительные исследования.
7. Другие моноклонкальные антитела. Помимо токсических эффектов, специфичных для рецепторов, на которые действует препарат, моноклональные антитела, в т.ч. цетуксимаб, представляющий собой химерное моноклональное антитело класса иммуноглобулинов C1 (IgG1), обладающее высокой специфичностью к EGFR (причем сродство к рецептору у препарата выше, чем у эпидермального фактора роста), а также два антитела, используемые в лечении лимфобластных лейкозов и лимфом, — алемтузумаб (кэмпас, направленный на лимфоидный антиген CD52) и ритуксимаб (ритуксан, направленный на CD20), часто вызывают гриппоподобные реакции, которые иногда могут быть тяжелыми и приводить к гипотензии, бронхоспазму, кожной сыпи, крапивнице или ангионевротическому отеку. Необходима симптоматическая терапия, которая обычно эффективна.
8. Модуляторы апоптоза. Модуляция факторов апоптоза представляет большой интерес для фармацевтической промышленности, но пока еще ни один препарат из этой группы не был одобрен для применения. Предположение о возможности модуляции факторов апоптоза in vivo, которая способна оказывать значимые эффекты, широко изучают на животных моделях экспериментального острого ишемического повреждения (инсульта и ИМ). В этих экспериментах при достижении ингибирования каспаз с помощью низкомолекулярных белков отмечено уменьшение повреждения. Один из низкомолекулярных непептидных ингибиторов — IDN6556 (Pfizer, Inc.) — проходил клинические испытания II фазы. Однако общая концепция лечения рака предполагает усиление, а не угнетение апоптоза. В настоящее время исследуют мелкие молекулы, которые активируют каспазу 3, индуцирующую процессы апоптоза, и молекулы, являющиеся ингибиторами процессов выживания. Еще одним направлением является изучение возможности подавления семейства ингибиторов апоптоза.
Ингибиторы апоптоза гиперэкспрессированы при некоторых формах рака, и клетки становятся относительно резистентными к процессам апоптоза. Удивительно, но опосредованный вирусом перенос гена ингибитора апоптоза в головной мозг уменьшал степень ишемического повреждения при экспериментальном инсульте. Таким образом, стратегии лечения рака, направленные на модуляцию процессов апоптоза, иногда диаметрально противоположны стратегиям лечения ССЗ, т.е. новые лекарственные препараты, влияющие на процессы апоптоза при онкологических заболеваниях, потенциально будут обладать кардиотоксическим действием.
Список литературы:
- Peng X, Chen B, Lim CC, Sawyer DB: The cardiotoxicity of anthracycline chemotherapeutics. Mol Intervent 5:163-171, 2005.
- Swain SM, Whaley FS, Gerber MC, et al: Cardioprotection with dexrazoxane for doxorubicin-containing therapy in advanced breast cancer. J Clin Oncol 15:1318-1332, 1997.
- Schuchter LM, Hensley ML, Meropol NJ, Winer EP: 2002 update of recommendations for the use of chemotherapy and radiotherapy protectants. J Clin Oncol 20:2895-2903, 2002.
- Ewer MS, Martin FJ, Henderson C, et al: Cardiac safety of liposomal anthracyclines. Semin Oncol 31:161-181, 2004.
- Cardinale D, Sandri MT, Colombo A, et al: Prognostic value of troponin I in cardiac risk stratification of cancer patients undergoing high-dose chemotherapy. Circulation 109:2749-2754, 2004.
- Cardinale D, Colombo A, Sandri MT, et al: Prevention of high-dose chemotherapy-induced cardiotoxicity in high-risk patients by angiotensin-converting enzyme inhibition. Circulation 114:2474-2481, 2006.
- Silber JH, Cnaan A, Clark BJ, et al: Enalapril to prevent cardiac function decline in long-term survivors of pediatric cancer exposed to anthracyclines. J Clin Oncol 22:820-828, 2004.
- Biganzoli L, Cufer T, Bruning P, et al: Doxorubicin-paclitaxel: A safe regimen in terms of cardiac toxicity in metastatic breast carcinoma patients. Results from a European Organization for Research and Treatment of Cancer multicenter trial. Cancer 97:40-45, 2003.
- Читать "Влияние лучевой терапии на сердечно-сосудистую систему"
Редактор: Искандер Милевски. Дата публикации: 19.3.2019
- Влияние опухоли на сердечно-сосудистую систему
- Влияние противоопухолевых препаратов на сердечно-сосудистую систему (кардиотоксичность химиотерапии)
- Влияние таргетной противоопухолевой терапии на сердечно-сосудистую систему
- Влияние лучевой терапии на сердечно-сосудистую систему
- Рекомендации по лечению сердечной недостаточности вызванной химиотерапией
