Влияние противоопухолевых препаратов на сердечно-сосудистую систему (кардиотоксичность химиотерапии)
Лекарственная терапия онкологических заболеваний за последнее десятилетие изменилась более существенно, чем за любой другой промежуток времени. В статьях на сайте рассматриваются токсические эффекты традиционных химиотерапевтических средств и новых препаратов для целевой терапии, направленной на сердечно-сосудистую систему.
а) Токсичность традиционной химиотерапии:
1. Токсичность антрациклинов. Антрациклины, одобренные в настоящее время к применению в США, — доксорубицин (адриамицин), даунорубицин (церубидин), эпирубицин (элленс) и идарубицин (идамицин PFS) — являются основными компонентами многих режимов химиотерапии, эффективными при лимфомах и многих солидных опухолях, в т.ч. при раке молочной железы и мелкоклеточном раке легких. Этот класс препаратов является в настоящее время самым токсичным в отношении сердечно-сосудистой системы, он провоцирует острое развитие аритмий, дисфункции ЛЖ и перикардита, а при длительном применении — ХСН. Степень токсичности зависит от дозы.
Данные одного из первых ретроспективных анализов свидетельствуют о том, что частота СН составляет 2,2% в общей группе и 7,5% — в подгруппе больных, получивших суммарную дозу 550 мг/м2. Однако согласно результатам более поздних исследований, частота СН еще выше. Частота значительно увеличивается при получении суммарной дозы доксорубицина > 400— 450 мг/м2, поэтому онкологи при лечении большинства опухолей обычно ограничивают дозу 450-500 мг/м2. Развитие антрациклиновой КМП, как правило, происходит в течение первого года после завершения терапии (медиана составляет от 5 до 9 мес). Однако с течением времени КМП может прогрессировать.
Другими ФР развития кардиотоксического эффекта, помимо дозы > 450 мг/м2, являются пожилой возраст, наличие заболеваний сердца в анамнезе и предшествующее облучение органов средостения. По данным оценки функции ЛЖ предикторами кардиотоксического эффекта являются исходный уровень ФВ ЛЖ < 50% или снижение ФВ на фоне терапии более чем на 10% (до уровня < 50%). Первым признаком может быть диастолическая дисфункция. Токсическое действие антрациклинов может быть особенно выраженным у детей. Так, в одном из исследований частота развития СН в течение 15 лет наблюдения составила 5%, но если суммарная доза препаратов составляла 550 мг/м2, частота СН увеличивалась до 10%.
Помимо дозы и облучения средостения предикторами нежелательных эффектов у детей являются возраст установления диагноза и женский пол. В отличие от взрослых прогрессирующая СН у детей может развиться спустя годы после окончания терапии.
Наиболее чувствительным методом выявления кардиотоксического действия антрациклинов является биопсия миокарда. С ее помощью можно обнаружить вакуолизацию цитоплазмы, лизис миофибрилл и отек клеток, что типично для некротической формы гибели клеток. Однако не удалось доказать взаимосвязь изменений, выявляемых при электронной микроскопии, с риском развития СН; такие изменения часто выявляют у пациентов, у которых суммарная доза препаратов была значительно меньше той, которая способна увеличить риск СН. Учитывая технику процедуры и связанные с ней риски, этот метод нельзя считать оптимальным для выявления или наблюдения пациентов с проявлениями кардиотоксичности антрациклиновых препаратов.
В настоящее время общепринятым методом является повторное определение функции ЛЖ, хотя этот метод характеризуется низкой чувствительностью.
Клеточные механизмы, обусловливающие кардиотоксическое действие антрациклинов, остаются неясными, однако предполагается, что среди этих механизмов присутствует, по крайней мере частично, окислительный стресс, приводящий к окислению железа и образованию свободных радикалов, которые повреждают мембраны клеток и органелл за счет перекисного окисления липидов. Другим механизмом может быть активация кальпаинов — протеаз, которые вызывают разрушение структурных белков КМЦ, в т.ч. титина. Предположение о роли окисления железа привело к использованию дексразоксана (зинекарда), хелатора внутриклеточного железа. Данный препарат снизил частоту кардиотоксического эффекта, но результаты одного из исследований свидетельствуют, что он, возможно, снижает эффективность антрациклинов. Эти данные не были подтверждены в более позднем метаанализе, поэтому дексразоксан в настоящее время одобрен к применению в США.
Согласно рекомендациям American Society of Clinical Oncology, дексразоксан следует применять лишь у пациентов, получивших > 300 мг/м2 доксорубицина или эквивалентную дозу другого препарата.
С целью уменьшения кардиотоксического эффекта антрациклинов применяют и другие стратегии, в т.ч. использование эпирубицина, представляющего собой стереоизомер доксорубицина. Эпирубицин обладает меньшей кардиотоксичностью, чем доксорубицин в сопоставимых дозах, а кардиотоксический эффект эпирубицина в дозе 900-1000 мг/м2 такой же, как у доксорубицина в дозе 450-500 мг/м2. Однако эффективность этих препаратов сравнима только при назначении эквивалентных доз. В настоящее время эпирубицин чаще используют в Европе, чем в США. Другие стратегии по уменьшению кардиотоксического эффекта заключаются в использовании липосомально-инкапсулированного доксорубицина (миоцет — препарат, одобренный к применению в Европе), в т.ч. в сочетании с покрытием полиэтиленгликолем (доксил). Предполагается, что липосомальное инкапсулирование уменьшает доставку препарата к сердцу, а полиэтиленгликоль увеличивает период полувыведения и доставку к опухоли.
Оба метода уменьшают кардиотоксичность, о чем свидетельствуют как клинические данные, так и оценка функции ЛЖ, хотя существует предположение о возможном уменьшении противоопухолевой эффективности миоцета, но это, скорее всего, не соответствует истине. Митоксантрон (новантрон), производное антрациклина, используемое в терапии больных с рассеянным склерозом, также может вызывать нарушение функции сердца.
Больным следует определять функцию ЛЖ до начала терапии антрациклинами, а также на фоне проводимого лечения, особенно если суммарная доза доксорубицина составляет > 300-350 мг/м2 (и сопоставимые значения для других препаратов). Необходимо учитывать, что данные анамнеза и физикальный осмотр не могут выявить всех пациентов с существенным нарушением функции ЛЖ. Критерии, касающиеся ФР, определения функции ЛЖ до начала лечения и ее ухудшения с учетом доз препаратов, могут быть использованы для стратификации риска развития СН. Определение уровня тропонина не имеет существенного значения, за исключением назначения химиотерапии в высоких дозах для лечения агрессивных опухолей. У таких пациентов повышение уровня тропонина I является высокочувствительным предиктором развития дисфункции ЛЖ, хотя точность низкая.
Отсутствие изменения уровня тропонина I достоверно свидетельствует о том, что функция ЛЖ не будет ухудшаться . Согласно результатам недавно опубликованного исследования, профилактическое назначение ИАПФ больным с повышенным уровнем тропонина I может предупреждать развитие СН.
Согласно результатам первых исследований кардиотоксичности антрациклинов, смертность на фоне терапии дигоксином или диуретиками превышала 40%, однако при использовании современной тактики лечения больных с СН прогноз стал намного лучше. Так, на фоне профилактического назначения эналанрила детям было отмечено существенное уменьшение прогрессирования дисфункции ЛЖ при наблюдении в течение 3 лет. К сожалению, некоторые исследования свидетельствуют о том, что положительный эффект ИАПФ у детей непродолжителен.
2. Токсичность таксанов. Механизм противоопухолевого действия таксанов паклитаксела (таксола) и доцетаксела (таксотера) обусловлен разрывом системы микротрубочек. Эти препараты эффективны при раке молочной железы. При использовании этих препаратов по отдельности они проявляют относительно низкую кардиотоксичность. По данным крупного исследования, кардиотоксичность наблюдалась у 14% больных, но в 76% случаев она проявлялась бессимптомной брадикардией. Возможно также развитие нарушений проводимости. Однако при назначении паклитаксела в комбинации с доксорубицином кардиотоксичность увеличивается: в одном исследовании СН была зарегистрирована у 18% больных. Этот эффект связывают с замедлением метаболизма доксорубицина. Когда паклитаксел назначали через 30 мин после доксорубицина (доза доксорубицина не превышала 360 мг/м2), снижение ФВ было более выраженным, чем при комбинации доксорубицина с циклофосфамидом, хотя частота развития СН была небольшой и не различалась между группами. Доцетаксел не замедляет метаболизм доксорубицина и не увеличивает частоту развития СН. Комбинация эпирубицина и таксана также не увеличивает риск СН.

б) Алкилирующие соединения и антиметаболиты - токсичность. Эти классы препаратов обычно характеризуются низким уровнем кардиотоксичности. Циклофосфамид (циток-сан) пациенты переносят относительно хорошо при назначении в обычных дозах, однако у больных на режиме кондиционирования перед трансплантацией аутологичных стволовых клеток, при котором используют высокие дозы циклофосфамида, может развиться острый кардиотоксический эффект. В отличие от общей суммарной дозы, которую используют при назначении антрациклинов, в отношении циклофосфамида большее предикторное значение имеет доза индивидуального курса лечения. ФР являются предшествующая терапия антрациклинами, облучение средостения и, возможно, предшествующая терапия иматинибом. Клиническими проявлениями могут быть СН, миокардит или перикардит. В одном из наблюдений у 17 пациентов без признаков СН, получавших индукционную терапию, с самого начала при МРТ выявляли дилатацию ЛЖ.
Предполагается, что механизм кардиотоксического эффекта заключается в повреждении эндотелиальных клеток и миоцитов, при этом может наблюдаться клиническая картина геморрагического некроза миокарда. После острой фазы, как правило, остаточная дисфункция ЛЖ не отмечается. Высокие дозы ифосфамида (ифекса) индуцировали СН у 17% больных.
Цисплатин (платинол) является основой химиотерапии при лечении рака яичек из зародышевых клеток — наиболее часто встречающегося злокачественного новообразования у мужчин в возрасте от 20 до 40 лет, 80% из которых с диссеминированной нонсеминомой имеют длительную выживаемость. В связи с этим помимо острых эффектов кардиотоксичности большое значение имеют отдаленные эффекты токсического действия пpeпаратов данной группы. Извест но, что цисплатин вызывает гипертензию, иногда выраженную. Сообщалось также о синдроме острой боли в груди, включая развитие ИМ, который, возможно, обусловлен спазмом КА. Поскольку цисплатин часто используют в комбинации с блеомицином (препаратом, способным вызвать развитие феномена Raynaud у 30% больных), особое значение имеет отдаленный эффект токсического влияния препарата на сосуды.
Действительно, через 10 лет наблюдения у больных, получавших химиотерапию с производными платины (цисплатин или карбоплатин [параплатин]), сердечно-сосудистые события (СССоб) развились в 6,7% случаев после химиотерапии и в 10% — после лучевой терапии, что соответствовало увеличению риска в 2,4-2,8 раза по сравнению с группой пациентов, получивших только оперативное лечение. Изменение толщины комплекса интима-медиа сонных артерий было выявлено уже через 10 нед после начала терапии цисплатином. При таком уровне заболеваемости нужен более сдержанный подход к лечению больных с невысоким риском рецидива опухоли.
5-Фторурацил (адруцил) назначают для лечения многих солидных опухолей. Этот препарат является основой терапии колоректального рака. 5-Фторурацил провоцирует острые формы ИБС (от стенокардии до ИМ), что может наблюдаться у больных без ИБС в анамнезе (в 1% случаев), но чаще встречается у пациентов с имеющейся коронарной болезнью (в 4-5% случаев). В целом частота варьирует от 0,55 до 8%, хотя с помощью более чувствительных методов, позволяющих выявить субклинические признаки ишемии миокарда (амбулаторное мониторирование ЭКГ), обнаруживают значительно большую частоту. Отмена препарата и назначение стандартной антиангинальной терапии уменьшает выраженность симптомов, однако ишемия часто возникает вновь, если терапию возобновляют. Альтернативный препарат — капецитабин (кселода), который часто используют в комбинации с оксалиплатином (элоксатином) при колоректальном раке и раке молочной железы. Этот препарат метаболизируется до 5-фторурацила главным образом в опухолевых клетках, что позволяет предполагать его меньшую кардиотоксичность.
Однако по данным ретроспективного анализа (в который не включали пациентов со значимыми ССЗ) частота серьезных событий составила 6,5%, в т.ч. были стенокардия (4,6%), ИМ, ЖТ и внезапная смерть. Основным механизмом, вызывающим ишемию, по-видимому, является вазоспазм, хотя отмечается также увеличение числа тромбоэмболий. В настоящее время неясно, может ли профилактическое назначение нитратов предупредить развитие ишемии. Монотерапия капецитабином, вероятно, ассоциируется с более низкой частотой кардиотоксичности по сравнению с монотерапией 5-фторурацилом.
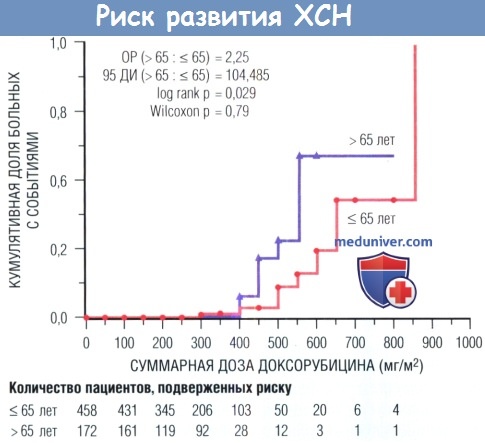
Графически представлена кумулятивная доза доксорубицина на момент манифестации ХСН, вызванной доксорубицином, у 630 пациентов в зависимости от возраста (моложе или старше 65 лет).
Log rank — логарифмическая шкала; ДИ — доверительный интервал; ОР — отношение рисков.
в) Другие препараты для химиотерапии:
1. Токсичность тамоксифена. Тамоксифен (нолвадекс) широко применяют для лечения рака молочной железы. Согласно главным образом экспериментальным данным предполагается, что препарат обладает кардиопротективным действием. Однако в крупномасштабном исследовании с участием 13 388 пациентов терапия тамоксифеном не повлияла на частоту фатальных и нефатальных ИМ, НС и тяжелой стенокардии у женщин как с ИБС, так и без этого заболевания в анамнезе. Однако есть опасения, что на фоне этой терапии несколько увеличивается риск инсультов.
2. Токсичность ингибиторов протеасом. Бортезомиб (велкейд) является ингибитором системы протеасом, обеспечивающей деградацию дефектных белков и белков, которые не нужны для поддержания жизнедеятельности клетки (например, некоторые белки, регулирующие процессы ранних фаз клеточной пролиферации, должны быть впоследствии разрушены, чтобы обеспечить нормальное течение поздних фаз клеточного цикла). Препарат одобрен для применения у больных с множественной миеломой, В-клеточной злокачественной опухолью с избыточной продукцией плазматических клеток в костном мозге. Предпосылкой для использования препарата является гипотеза, что в опухолевых клетках содержатся аномальные белки, регулирующие клеточный цикл, которые обусловливают более быстрое деление клетки и, соответственно, накопление дефектного белка. Следовательно, от деградации аномального белка в большей степени зависит функционирование опухолевой клетки, чем здоровой. Подтверждением этой гипотезы стал факт большей токсичности ингибиторов протеасом для культур пролиферирующих опухолевых клеток, чем здоровых.
Целью является стресс эндоплазматического ретикулума, что ведет к активации фактора, стимулирующего апоптоз (киназы N-концевого фрагмента фактора транскрипции c-Jun), и инактивации факторов, способствующих выживанию клетки, в т.ч. NFkB. В настоящее время недостаточно данных о кардиотоксичности бортезомиба, однако, поскольку в КМЦ содержится активная протеасомная система, можно предположить, что ингибирование протеасом может оказать токсическое действие на сердце.
Однако в клиническом исследовании III фазы СН диагностировали у 5% больных, но при этом ее выявили у 4% пациентов, получавших дексаметазон.
г) Список литературы:
- Ng R, Better N, Green MD: Anticancer agents and cardiotoxicity. Semin Oncol 33:2-14, 2006.
- Swain SM, Whaley FS, Ewer MS: Congestive heart failure in patients treated with doxorubicin: A retrospective analysis of three trials. Cancer 97:2869-2879, 2003.
- Jensen BV, Skoversusgaard T, Nielsen SL: Functional monitoring of anthracycline cardiotoxicity: A prospective, blinded, long-term observational study of outcome in 120 patients. Ann Oncol 13:699-709, 2002.
- Yeh ET, Tong AT, Lenihan DJ, et al: Cardiovascular complications of cancer therapy: Diagnosis, pathogenesis, and management. Circulation 109:3122-3131, 2004.
- Kremer LC, van Dalen EC, Offringa M, et al: Anthracycline-induced clinical heart failure in a cohort of 607 children: Long-term follow-up study. J Clin Oncol 19:191-196, 2001.
- Lipshultz SE, Lipsitz SR, Sallan SE, et al: Chronic progressive cardiac dysfunction years after doxorubicin therapy for childhood acute lymphoblastic leukemia. J Clin Oncol 23:2629-2636, 2005.
- Читать "Влияние таргетной противоопухолевой терапии на сердечно-сосудистую систему"
Редактор: Искандер Милевски. Дата публикации: 19.3.2019
- Влияние опухоли на сердечно-сосудистую систему
- Влияние противоопухолевых препаратов на сердечно-сосудистую систему (кардиотоксичность химиотерапии)
- Влияние таргетной противоопухолевой терапии на сердечно-сосудистую систему
- Влияние лучевой терапии на сердечно-сосудистую систему
- Рекомендации по лечению сердечной недостаточности вызванной химиотерапией
