Влияние опухоли на сердечно-сосудистую систему
У больных со злокачественными новообразованиями часто развиваются осложнения со стороны сердечно-сосудистой системы. Такие осложнения могут быть обусловлены как непосредственным влиянием опухоли, так и метастатическим поражением. Выпот в полость перикарда с развитием тампонады и синдром верхней полой вены представляют собой сравнительно частые проявления поздних стадий злокачественной опухоли.
Поражение сердечнососудистой системы возможно и в результате косвенного влияния онкологических заболеваний, например вследствие синдрома гипервязкости, возникающего при миелопролиферативных заболеваниях и лейкозах. Наконец, многие методы лечения злокачественной опухоли, включая традиционные химиотерапевтические препараты, лучевую терапию и целевую терапию, направленную на факторы, приводящие к развитию новообразований или способствующие росту опухоли, могут оказывать токсическое действие на сердце и сердечно-сосудистую систему.
Поскольку сердечно-сосудистая патология и злокачественная опухоль наблюдаются часто и имеют общие ФР, они нередко сочетаются у одних и тех же больных. В настоящее время стало очевидным, что для качественного лечения онкологических больных кардиологи и онкологи должны обладать знаниями обеих дисциплин.
а) Опухоли сердца. Первичные опухоли сердца встречаются редко и, как правило, бывают доброкачественными. Первичными опухолями сердца могут быть миксомы (25-50% всех первичных опухолей сердца), папиллярные фиброэластомы (10%), рабдомиомы, из которых 50% ассоциированы с туберозным склерозом, липомы и гемангиомы (5-10%). Злокачественные опухоли представлены в основном саркомами (из них наиболее часто встречаются ангиосаркомы) и лимфомами, хотя лимфома сердца как первичное новообразование наблюдается значительно реже, чем как вторичное.
Напротив, прорастание опухолей, гематогенное или ретроградное лимфогенное распространение с поражением сердца наблюдаются часто. По данным аутопсий, поражение сердца или перикарда отмечается у 10-12% больных со злокачественными новообразованиями. Наиболее часто (36% случаев) сердце поражается при опухолях легких. В 20% случаев — это больные с лимфомами, лейкозами и саркомой Kaposi, в 7% — с раком молочной железы и в 6% — с раком пищевода. В большинстве случаев сердце вовлекается в результате непосредственного поражения опухолью или вследствие регионарного распространения по лимфатической системе.
Метастазы в миокард встречаются значительно реже и, как правило, являются следствием гематогенного распространения меланом или лимфом. У 46-71% пациентов с меланомой выявляют метастазирование в миокард и/или перикард. Хотя мезотелиомы встречаются относительно редко, они часто поражают перикард (74%) или миокард (25%). У пациентов с метастазами в миокард часто внезапно развиваются аритмии или, реже, нарушения проводимости.
б) Поражение перикарда:
1. Выпот в полость перикарда. Необходимо отличать выпот в полость перикарда у больного со злокачественным новообразованием от выпота в результате непосредственного поражения опухолью, перикардита на фоне лучевой или химиотерапии, идиопатического перикардита, инфекционного перикардита (включая туберкулез, грибковую или бактериальную инфекцию), а также ятрогенного перикардита в результате проведения вмешательств. В одном из исследований причиной выпота в полость перикарда у онкологических больных в 40% случаев были лучевая терапия (10%) или идиопатический перикардит (32%), при этом авторы другого наблюдения сообщали о еще более высокой частоте выпота.
Перикардиты, обусловленные лекарственной терапией, чаще всего наблюдаются после применения высоких доз антрациклинов или циклофосфамида.
2. Тампонада сердца. У 30% больных с поражением перикарда наблюдается нарушение функции сердца, причем компрессия сердца может прогрессировать до тампонады, при которой понадобится экстренное дренирование. Клиническими проявлениями могут быть боль в груди, лихорадка, одышка, кашель и периферические отеки. Развитие тампонады в отсутствие 2 или более признаков воспаления (типичный болевой синдром, шум трения перикарда, лихорадка, подъем сегмента ST во многих отведениях) свидетельствует о большей вероятности злокачественного новообразования (риск возрастает в 2,9 раза). При физикальном обследовании могут выявляться приглушенные тоны сердца, набухание яремных вен и парадоксальный пульс, обычно в сочетании с низким пульсовым давлением.
Возможно также наличие признака Kussmaul (парадоксальное увеличение югулярного венозного пульса на вдохе), однако он не является специфичным для тампонады и встречается также при констриктивном перикардите, рестриктивной КМП и инфаркте ПЖ. На ЭКГ иногда выявляются низкий вольтаж и, редко, электрическая альтернация комплексов. При рентгенографии грудной клетки часто определяется увеличение размеров сердца. ЭхоКГ выявляет наличие выпота, обычно массивного, хотя при быстром накоплении жидкости ее количество может быть небольшим. Диагностика тампонады основана на обнаружении при ЭхоКГ диастолического коллабирования свободной стенки ПЖ. Можно также увидеть компрессию ПП. Однако тампонада может развиться при локализованном выпоте, в этом случае типичные признаки на ЭхоКГ могут отсутствовать.
Экстренная терапия тампонады заключается в осторожном возмещении жидкости в качестве временной меры, если у больного есть признаки гиповолемии и нарушения гемодинамики. Необходимо проведение перикардиоцентеза под контролем ЭхоКГ. Полученную жидкость следует тщательно исследовать, поскольку, как было отмечено, причина тампонады часто не связана с онкологическим заболеванием (даже у пациентов с доказанной опухолью). Если причина выпота — злокачественное новообразование, результаты цитологического исследования дают положительный результат приблизительно в 85% случаев.
3. Констриктивный перикардит. Констриктивный или констриктивно-экссудативный перикардит представляет собой позднее осложнение облучения грудной клетки и все чаще встречается вследствие увеличения продолжительности жизни пациентов с раком молочной железы и болезнью Ходжкина, которые обычно получают этот вид терапии.
В ретроспективном исследовании с участием 635 пациентов с болезнью Ходжкина у 44 пациентов развился отсроченный перикардит, при этом 12 больным понадобилась перикардэктомия. В это исследование были включены пациенты с облучением мантийной зоны с использованием субкариналыюго блока и без него, причем частота развития перикардита была ниже при использовании блока. Промежуток времени между лучевой терапией и перикардэктомией составил в среднем от 7 до 13 лет. В исследовании с участием 163 больных, которым была выполнена перикардэктомия по поводу констриктивного перикардита различной этиологии, предшествующая лучевая терапия оказывала существенный отрицательный эффект как на уровень периоперационной смертности (21,4% после лучевой терапии vs 2,7% при идиопатическом перикардите), так и на отдаленную выживаемость.
Причиной было развитие в результате облучения фиброза средостения, что уменьшало объем ткани перикарда, подлежащей удалению, и увеличивало риск остаточной констрикции. Кроме того, после облучения грудной клетки помимо констриктивного перикардита может развиться рестриктивная КМП, которая существенно увеличивает заболеваемость и смертность. Фиброз миокарда необходимо исключать до проведения перикардэктомии, а своевременное выявление таких пациентов позволяет снизить периоперационную смертность.
в) Обструкция верхней полой вены (ВПВ) опухолью. Синдром ВПВ развивается в тех случаях, когда обструкция тонкостенной ВПВ нарушает отток венозной крови от головы, верхних конечностей и органов грудной клетки к ПП. ВПВ окружена лимфатическими узлами, осуществляющими дренаж из правой половины грудной клетки и нижних отделов левой половины грудной клетки. Синдром ВПВ обычно проявляется медленно прогрессирующими симптомами, нарастающими в течение нескольких недель, и характеризуется вовлечением коллатерального кровотока по нескольким венозным системам, включая непарную вену и внутреннюю грудную вену. Если симптомы проявляются остро, синдром ВПВ представляет собой неотложную ситуацию.
1. Симптомы. Обструкция ВПВ может быть вызвана как злокачественными, так и доброкачественными заболеваниями. Больные обычно жалуются на постепенно прогрессирующую одышку (60%), отеки лица (50%), кашель (24%), отек верхней конечности (18%), боль в груди (15%) и дисфагию (9%), а также на нарушение зрения, осиплость голоса, тошноту, головные боли и синкопе. При физикальном обследовании можно обнаружить расширение шейных вен (66%) и вен грудной клетки (54%), отек лица (46%), плетору (19%) и цианоз (19%). Симптомы могут усугубляться в положении лежа на спине и при наклонах вперед. При наличии этих признаков возможно развитие жизнеугрожающих осложнений в виде отека гортани и головного мозга.
2. Причины. От 75 до 85% случаев синдрома ВПВ развиваются вследствие новообразований, при этом наиболее частой причиной является рак легких. У 2-5% больных с раком легких развивается синдром ВПВ, однако среди пациентов с мелкоклеточным раком легких, который составляет лишь 20% всех случаев злокачественных новообразований легких, синдром ВПВ возникает в 10-20% случаев, причем эти больные составляют почти 40% всех случаев синдрома ВПВ при раке легких. У 80% больных с синдромом ВПВ, ассоциированным с раком легких, наблюдается первичное поражение правого легкого.
Второй по частоте причиной синдрома ВПВ, обусловленной новообразованиями, является лимфома, которая ассоциируется с развитием синдрома ВПВ в 2-21% случаев. Чаще всего синдром ВПВ возникает при диффузной крупноклеточной лимфоме (64%), затем следует лимфобластная лимфома (33%). Синдром ВПВ развивается лишь у 1-5% больных с лимфомами (у 21% — с лимфобластной лимфомой и у 7% — с диффузной крупноклеточной лимфомой). Синдром ВПВ развивается у 57% пациентов с первичной медиастинальной В-клеточной лимфомой со склерозом. Хотя при лимфоме Ходжкина средостение поражается часто, синдром ВПВ наблюдается редко. Другими первичными злокачественными опухолями средостения, которые иногда сопровождаются развитием синдрома ВПВ, являются тимома и герминогенные опухоли. Из метастатических процессов синдром ВПВ наиболее часто развивается при раке молочной железы (11%).

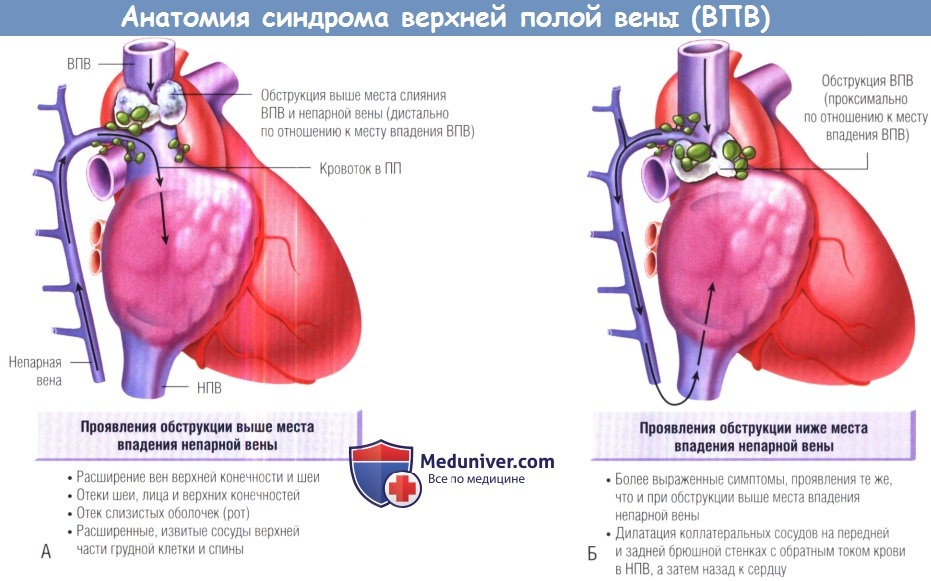
(А) Лимфатические узлы могут вызывать обструкцию венозного возврата выше места впадения непарной вены, что ведет к отекам лица, шеи, верхних конечностей и расширению вен шеи, верхних конечностей и верхней части грудной клетки.
(Б) Обструкция ниже места впадения непарной вены приводит к ретроградному току крови через непарную вену и коллатеральные сосуды в нижнюю полую вену (НПВ), что ведет к появлению всех симптомов и признаков, перечисленных на (А), в сочетании с расширением вен передней брюшной стенки. ПП — правое предсердие.
3. Дифференциальная диагностика. Доброкачественными заболеваниями неопухолевой природы, которые могут приводить к обструкции ВПВ, являются фиброз средостения после лучевой терапии, гистоплазмоз, туберкулез, заболевания соединительной ткани или васкулиты, артериовенозные фистулы. Возможно развитие тромбоза ВПВ как осложнения установки центральных венозных катетеров, электродов кардиостимуляторов, перитонеовенозных шунтов, катетеров Swan-Ganz и катетеров для гипералиментации. Имплантация кардиостимулятора или кардиовертера-дефибриллятора почти в 30% случаев сопровождается локальными венозными тромбозами, иногда осложненными инфекцией; однако развитие синдрома ВПВ встречается нечасто и ассоциируется с ост рым или остаточным инфицированием электродов или с наличием остатков разрушенного электрода. Другими доброкачественными причинами могут быть гранулемы, врожденные аномалии, а также фиброз средостения на фоне гистоплазмоза.
4. Диагностика. У больного с характерными симптомами обструкции ВПВ данные физикального обследования обычно достаточно информативны и позволяют поставить диагноз с высокой степенью вероятности. У 60% пациентов с синдромом ВПВ, вызванным новообразованием, в анамнезе отсутствуют данные о наличии онкологического заболевания. Как правило, на рентгенограмме видна опухоль в сочетании с расширением границ верхнего средостения и, нередко, с плевральным выпотом. КТ дает важную дополнительную информацию. КТ с контрастированием позволяет выявить наличие обструкции и установить ее уровень, протяженность, а также определить тактику ведения больного, поскольку дает возможность визуализировать коллатеральные и функционирующие сосуды, исключить ТЭЛА и выбрать соответствующий доступ для инвазивного вмешательства.
Широкое использование визуализирующих методов обследования у больных онкологическими заболеваниями позволяет выявить угрозу развития обструкции ВПВ при отсутствии клинических симптомов, что дает возможность начать лучевую терапию в целях предупреждения или замедления прогрессирования окклюзии. С помощью КТ можно выявить соотношение растущих опухолей или развитие внутрисосудистого тромбоза на ранней стадии, до развития окклюзии. Эту задачу с успехом решает и МРТ.
При синдроме ВПВ возможно развитие внутрисосудистой, пристеночной или внесосудистой обструкции. Причинами внутрисосудистой обструкции могут быть тромбирование опухолевыми массами или непосредственное прорастание опухоли. Обычные тромбы появляются, как правило, на фоне установки внутривенных систем или инфицирования электродов кардиостимулятора, но эти тромбы редко приводят к полной окклюзии. Обычные тромбы также могут быть проявлением пара-неопластического процесса, и, чтобы отличить обычный тромб от опухолевого, следует оценить васкуляризацию опухоли. Пристеночная обструкция может возникать на фоне формирования стриктур вследствие лучевой терапии. Внесосудистая обструкция обычно заключается в непосредственном сдавлении сосуда бронхогенными опухолями или лимфатическими узлами, этот вариант наиболее часто выявляют с помощью методов визуализации.
Поскольку выявление причины станет основой соответствующего лечения, необходимо получить образец ткани для диагностики основного заболевания. Цитологическое исследование мокроты может помочь в диагностике практически 50% случаев. Биопсия увеличенных лимфоузлов — сравнительно малоинвазивный метод, позволяющий поставить гистологический диагноз с высокой степенью достоверности. Торакоцентез дает возможность диагностировать злокачественное новообразование у 70% больных с выпотом в плевральную полость. В большинстве оставшихся случаев диагноз ставят с помощью бронхоскопии, включая браш-биопсию, исследование промывных вод и биопсию тканей. Для диагностики лимфомы и мелкоклеточного рака легких может иметь значение исследование костного мозга. Если диагноз остается неясным, эффективным и безопасным методом будет чрескожная трансторакальная тонкоигольная биопсия под контролем КТ.
Кроме этого, возможно выполнение медиастиноскопии, которая очень информативна, но ассоциируется с несколько более высоким риском осложнений (5%).

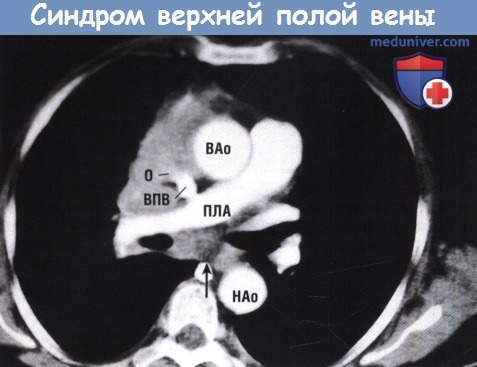
Результаты КТ с внутривенным контрастированием на уровне правой легочной артерии (ПЛА) демонстрируют наличие опухоли (О), инфильтрирующей суженную ВПВ.
Опухоль также присутствует в субкаринальном пространстве (стрелка). ВАо — восходящая аорта; НАо — нисходящая аорта.
5. Лечение обструкции верхней полой вены (ВПВ). В ходе обследования до начала специфической терапии назначают кислород для снижения СВ и венозного давления. Для уменьшения отеков следует приподнять головной конец кровати, назначить диуретики и низкосолевую диету, однако дегидратация увеличивает риск повторных тромбозов. У больных с синдромом ВПВ, обусловленным злокачественной опухолью, в качестве терапии первой линии наиболее часто используют лучевую терапию и химиотерапию. В ряде случаев назначение стероидов способствует уменьшению воспаления и степени обструкции, вызванной опухолью, однако при лимфоме эта терапия может усложнить диагностику.
Все чаще методом, обеспечивающим быстрый и длительный эффект при обструкции, оказывается внутрисосудистое стентирование. Традиционно считалось, что инвазивные диагностические процедуры в условиях повышенного внутригрудного венозного давления приводят к тяжелым кровотечениям и осложнениям анестезии, но оказалось, что в специализированных центрах частота осложнений очень невелика. Технически процесс имплантации стента успешен во многих случаях и быстро приводит к уменьшению выраженности клинической симптоматики. В дополнение может быть назначена лучевая или химиотерапия. Антикоагулянты не обладают доказанным положительным действием у больных с синдромом ВПВ, ассоциированным с новообразованиями, кроме того, антикоагулянты могут привести к осложнениям во время биопсии и инвазивной процедуры.
Хирургическое лечение предполагает наложение шунта между левой безымянной или яремной веной и ушком ПП с использованием аутологичного материала или дакрона. Однако такие серьезные инвазивные вмешательства очень сложны, поэтому их следует по возможности избегать и проводить только у пациентов с большой ожидаемой продолжительностью жизни. При достаточно длительном существовании тромба в отсутствие вмешательства на сосудах у больного может развиться сеть коллатеральных сосудов между стенкой грудной клетки и непарной и полунепарной венами, что эффективно восстанавливает венозный возврат к правым полостям сердца.
Для проведения специфической терапии при синдроме ВПВ следует максимально быстро определить гистологический вариант первичной опухоли (лимфома, герминогенная опухоль или мелкоклеточный рак легких) для начала ее лечения либо для оказания паллиативной помощи по поводу далеко зашедшего немелкоклеточного рака легких или метастазирующих солидных опухолей. Прогноз для больного с синдромом ВПВ зависит главным образом от прогноза, определяемого первичной опухолью. Комбинированная химиотерапия, которая может сочетаться с лучевыми методами лечения, уменьшает выраженность симптомов синдрома ВПВ в течение 1-2 нед у больных с впервые выявленным мелкоклеточным раком легких или лимфомой.
г) Поражение клапанов сердца при опухоли. Клапаны сердца могут непосредственно поражаться первичной опухолью или метастазами, а также в результате бактериальной или грибковой инфекции, асептического тромботического эндокардита, травмы при установке катетеров на длительный срок, а также поздних осложнений лучевой терапии.
Асептический тромботический эндокардит может встречаться при аутоиммунных заболеваниях, а также осложнять течение различных злокачественных опухолей, чаще всего — аденокарцином ЖКТ и легких. Заболеваемость и смертность связаны прежде всего с системной эмболией. В исследование были включены 200 амбулаторных пациентов с солидными опухолями, отобранных случайным образом (у них определяли уровень D-димера в плазме и обследовали для выявления признаков тромбоэмболий), а также 100 больных, составивших контрольную группу, у которых не было явных ССЗ (были направлены на ЭхоКГ для выявления потенциального источника артериальных эмболий). Из 200 пациентов с онкологическими заболеваниями у 38 были выявлены вегетации на клапанах, у 19 из них был поражен митральный клапан, у 18 — аортальный клапан и у 1 — трехстворчатый клапан.
Первичные диагнозы: лимфома (10), опухоли легких (9) и поджелудочной железы (3). Тромбоэмболии в сосуды конечностей отмечались у 4 пациентов, цереброваскулярные события — у 2, а у 4 больных при ЭхоКГ выявили бессимптомные нарушения локальной сократимости стенок ЛЖ. Тромбоэмболические осложнения возникли у 9 из 38 больных с вегетациями (24%) по сравнению с 13 из 162 пациентов без вегетаций (8%, р = 0,013). Уровень D-димера был повышен у 19 из 21 пациента с тромбоэмболиями (90%) и у 76 из 149 больных без тромбоэмболий (51%, р = 0,001). Вопросы лечения асептического тромботического эндокардита, ассоциированного со злокачественными новообразованиями, остаются нерешенными.
д) Ишемическая болезнь сердца (ИБС) при опухоли. Некоторые онкологические заболевания и ИБС имеют одинаковые ФР, в первую очередь курение, дыхание загрязненным твердыми частицами воздухом и возраст, поэтому нередко у пациентов сочетаются обе патологии. Кроме того, некоторые виды терапии онкологических заболеваний могут оказывать негативное влияние на сердечно-сосудистую систему, в т.ч. на КА, что способствует развитию НС и ИМ. В зависимости от характера и «агрессивности» противоопухолевой терапии, а также профиля риска пациента целесообразно до начала лечения оценить ФР с целью выявления и определения тяжести ИБС лаже при отсутствии симптомов и объективных критериев заболевания. В настоящее время нет четких рекомендаций, регламентирующих такой подход, тем не менее больным, которым планируют назначить препараты, провоцирующие развитие НС и ИМ, вероятно, следует выполнить тест с физической нагрузкой и использовать визуализирующие методы обследования для выявления ИБС до начала терапии.
и) Нарушения ритма при опухоли. Нарушения ритма у онкологических больных связаны, как правило, с сопутствующей патологией, а не с наличием опухоли как таковой. Разумеется, возможно развитие аритмий вследствие метастатического поражения миокарда или перикарда, но чаще всего нарушения ритма обусловлены гипоксемией (из-за распространенного опухолевого поражения легких, метастазов в легкие или инфекций легочной ткани), электролитными нарушениями, кардиотоксическим действием лучевой и противоопухолевой лекарственной терапии или наличием сопутствующих заболеваний, например ХОБЛ. Больным в терминальной стадии злокачественного процесса нередко проводят реанимационные мероприятия, однако вероятность выживания в подобных ситуациях очень низкая.
Так, в одном исследовании из 171 пациента, у которых остановка сердца была ожидаемой из-за ухудшения метаболического статуса, до выписки не дожил никто; напротив, из группы, в которой остановку сердца не прогнозировали, выжили 22%. Эти данные подчеркивают необходимость внимательного отношения к принятию решения о проведении реанимационных мероприятий у пациентов в терминальной стадии онкологического заболевания, что позволит избежать болезненных и дорогостоящих манипуляций, которые, как правило, бесполезны.
к) Синдром гипервязкости. Гипервязкость крови может возникать вследствие многих причин, в т.ч. в результате эритроцитоза (при истинной полицитемии), тромбоцитоза, который может быть реактивным или вторичным при миелопролиферативных заболеваниях (эссенциальная тромбоцитемия), лейкоцитоза, который иногда наблюдается при острых лейкозах, а также в результате повышения уровня белков плазмы (при множественной миеломе и макроглобулинемии Waldenstrom).
л) Список литературы:
- Luna A, Ribes R, Caro ?, et al: Evaluation of cardiac tumors with magnetic resonance imaging. Eur Radiol 15:1446, 2005.
- Chiles C, Woodard PK, Gutierrez FR, Link KM: Metastatic involvement of the heart and pericardium: CT and MRI imaging. RadioGraphics 21:439-449, 2001.
- Maisch B, Seferovic PM, Ristic AD, et al: Guidelines on the diagnosis and management of pericardial diseases. Eur Heart J 25:587-610, 2004.
- Tsang TS, Seward JB, Barnes ME, et al: Outcomes of primary and secondary treatment of pericardial effusion in patients with malignancy. Mayo Clin Proc 75:248-253, 2000.
- Tsang TS, Barnes DJ, Gersh BJ: Outcomes of clinically significant idiopathic pericardial effusion requiring intervention. Am J Cardiol 91:704-707, 2002.
- Lee PJ, Mallik R: Cardiovascular effects of radiation therapy. Cardiol Rev 13:80-86, 2005.
- Bertog SC, Thambidorai SK, Prarakh K, et al: Constrictive pericarditis: Etiology and cause-specific survival after pericardiectomy. J Am Coll Cardiol 43:1445-1452, 2004.
- Wudel LJ, Nesbitt JC: Superior vena cava syndrome. Curr Treat Options Oncol 2:77, 2001.
- Teo N, Sabharwal T, Rowland E, et al: Treatment of superior vena cava obstruction secondary to pacemaker wires with balloon venoplasty and insertion of metallic stents. Eur Heart J 23:1465, 2002.
- Rowell NP, Gleeson FV: Steroids, radiotherapy, chemotherapy and stents for superior vena cava obstruction in carcinoma of the bronchus: A systematic review. Clin Oncol 14:338-351, 2002.
- Edoute Y, Haim N, Rinkevich D, et al: Cardiac valvular vegetations in cancer patients: A prospective echocardiographic study of 200 patients. Am J Med 102:252-258,1997.
- Ewer MS, Kish SK, Martin CG, et al: Characteristics of cardiac arrest in cancer patients as a precitor of survival after cardiopulmonary resuscitation. Cancer 92:1905-1912, 2001.
- Читать "Влияние противоопухолевых препаратов на сердечно-сосудистую систему (кардиотоксичность химиотерапии)"
Редактор: Искандер Милевски. Дата публикации: 19.3.2019
- Влияние опухоли на сердечно-сосудистую систему
- Влияние противоопухолевых препаратов на сердечно-сосудистую систему (кардиотоксичность химиотерапии)
- Влияние таргетной противоопухолевой терапии на сердечно-сосудистую систему
- Влияние лучевой терапии на сердечно-сосудистую систему
- Рекомендации по лечению сердечной недостаточности вызванной химиотерапией
