Экология как причина инсулинорезистентности, ожирения, сахарного диабета 2-го типа
Во всем мире растет число заболеваний, связанных с инсулинорезистентностью (т.е. избыточный вес, ожирение, сахарный диабет 2-го типа, стеатоз печени, неалкогольный стеатогепатит, метаболический синдром). Это вызывает серьезную озабоченность, потому что такие состояния являются факторами риска сердечно-сосудистых заболеваний и рака, а также требуют больших затрат системы здравоохранения в разных странах.
В частности, заболеваемость ожирением постоянно растет как среди взрослых, так и среди детей без явной тенденции к обратному развитию и независимо от принятия конкретных мер по предотвращению эпидемии ожирения во все большем числе стран.
По данным Всемирной организации здравоохранения, с 1975 г. количество случаев ожирения во всем мире выросло почти втрое: по данным на 2016 г., более 1,9 млрд взрослых имеют избыточный вес, более 650 млн взрослых страдают ожирением, 41 млн детей в возрасте до 5 лет и 340 млн детей и подростков в возрасте от 5 до 19 лет имеют избыточный вес или ожирение.
Точно так же число пациентов с диабетом 2-го типа увеличилось со 108 млн в 1980 г. до 422 млн в 2014 г., а глобальная распространенность среди взрослых увеличилась с 4,7% в 1980 г. до 8,5% в 2014 г.
Такие эпидемиологические вариации, по-видимому, в некоторой степени не зависят от генетических факторов (т.е. генетического риска, зависящего от однонуклеотидных полиморфизмов и предрасположенности к возникновению и прогрессированию заболевания). Хотя генетическая предрасположенность играет ключевую роль в определении склонности к ожирению и диабету 2-го типа, эпидемиологические изменения, наблюдаемые в последние десятилетия, происходят слишком быстро, чтобы их можно было объяснить только с точки зрения генетических механизмов.
В большой выборке американцев, родившихся между 1901 и 1986 гг. и в возрасте от 25 до 64,9 лет на момент включения в исследование (продольное исследование Fels), уровень ожирения увеличивался в зависимости от года рождения, но оценка генетического риска развития ожирения (32 хорошо воспроизведенных общих однонуклеотидных полиморфизма, связанных с ожирением) оставалась стабильной (Demerath и соавт., 2013).
В свою очередь, все больше данных указывает на важную роль факторов окружающей среды в развитии болезни. Они включают образ жизни (диета, физическая активность), питание матери, прямое влияние пищи на микробиоту кишечника, попадание токсичных химических загрязнителей с пищей/водой, загрязнение воздуха. Взаимодействие генов с окружающей средой также играет роль после раннего (внутриутробного) воздействия, в частности, в отношении заболеваний с накоплением висцерального жира, ожирения и инсулинорезистентности (Di Ciaula и Portincasa, 2014, 2017).
Различия в национальных и локальных условиях могут способствовать разной распространенности ожирения в разных странах. Однако за последние 4—5 десятилетий на глобальном уровне произошли изменения в образе жизни и продовольственной системе, промышленных процессах (в частности, сжигание промышленных отходов, управление пищевыми продуктами и упаковка, мировая химическая промышленность), а также ухудшилась экологическая обстановка (воздух , почва, вода), что привело к созданию «обезогенной» среды, способствуя росту эпидемии ожирения.
В этом сценарии ХВРЭС играют решающую роль, поскольку они способны изменять метаболические пути и потребление энергии, производство, хранение и использование с помощью множества механизмов. Этапы включают изменение активности нейронов, которые контролируют потребление пищи, изменение состава кишечной микробиоты, изменение проницаемости кишечника, нарушение путей регуляции синтеза желудочно-кишечных пептидов, изменение экспрессии генов, нарушение контроля ключевых ферментов, изменение гормонального гомеостаза (например, уровня инсулина, гормонов щитовидной железы), нарушение сигнальных путей и уровней адипокинов, необходимых для метаболического и энергетического баланса.
Комбинированное воздействие ХВРЭС на различные органы (например, мозг, печень, поджелудочную железу, кишечник, скелетные мышцы, жировую ткань) может привести к нарушению механизмов, регулирующих накопление энергии, а воздействие на скелетные мышцы и гормоны щитовидной железы может повлиять на выработку энергии.
ХВРЭС могут влиять на метаболизм глюкозы и липидов и, в свою очередь, на механизмы, приводящие к развитию инсулинорезистентности, ожирения (как у детей, так и у взрослых) и диабета 2-го типа.
Ожирение в первую очередь проистекает из способности ХВРЭС влиять на пути, связывающие мультипотентные стромальные стволовые клетки со зрелыми адипоцитами, и вовлекать рецептор γ, активируемый пролифератором пероксисом, эпигенетические факторы (такие как повышенное деацетилирование гистонов и измененное метилирование ДНК) и другие механизмы, которые в конечном итоге приводят к увеличению образования адипоцитов и накоплению жира (Di Ciaula и Portincasa, 2014, 2017).
Жировая ткань является мишенью для нескольких липофильных ХВРЭС с серьезными последствиями с точки зрения совместного загрязнения, измененного метаболического гомеостаза и нарушения эндокринной функции поджелудочной железы (Di Ciaula и Portincasa, 2014, 2017).
В частности, СОЗ представляют собой группу из нескольких сотен галогенированных соединений (например, диоксинов, фуранов, полихлорированных бифенилов, хлорорганических пестицидов), характеризующихся высокой растворимостью в липидах. Эти органические химические вещества, как правило, устойчивы в окружающей среде и способны проникать в пищевую цепочку и накапливаться в организме человека, вызывая токсические эффекты также после хронического воздействия низких концентраций. После употребления загрязненной пищи (в частности, рыбы, яиц, мяса, молока) СОЗ сохраняются во висцеральной жировой ткани, с тенденцией к увеличению с возрастом; они обладают специфической взаимосвязью с инсулинорезистентностью, ожирением и другими компонентами метаболического синдрома (Di Ciaula и Portincasa, 2014, 2017).
С другой стороны, депонирование СОЗ в жировой ткани (т.е. во время набора веса) может снизить содержание этих химических веществ в других органах. Эта возможность представляет собой защитный фактор, снижающий влияние на эндокринную, иммунную, нервную и репродуктивную системы. Однако СОЗ, хранящиеся в жировой ткани, могут также высвобождаться из жировой ткани в процессе снижения веса или в случае инсулинорезистентности за счет повышения липолиза. Таким образом, конечное увеличение количества СОЗ в кровяном русле может приводить к снижению эффективности метаболизма, а при выведении эти токсичные вещества с более высокой вероятностью будут попадать в критически важные органы, такие как мозг, печень, почки и репродуктивные органы.
СОЗ также имеют важное значение с точки зрения передачи риска от поколения к поколению. Высокие концентрации стойких органических загрязнителей в сыворотке крови (в основном ПХД, хлорорганические пестициды дихлордифенилдихлорэтил и гексахлорбензол) у женщин в первом триместре беременности связаны с более высоким ИМТ, z-показателем и ожирением у их потомства (в возрасте 4 лет) (Vafeiadi и соавт., 2015).
В скандинавском проспективном исследовании когорты из 412 беременных женщин из Норвегии и Швеции концентрации перфтороктанового сульфоната в сыворотке крови матери на 17—20-й нед беременности были связаны с увеличением z-показателя ИМТ для пола и возраста и с увеличение z-показателя кожной складки трицепса у детей через 5 лет наблюдения. В той же когорте концентрации перфтороктаноата в сыворотке крови матери были достоверно связаны с избыточной массой тела/ожирением у детей. Следует отметить, что авторы описали данные, свидетельствующие о немонотонной зависимости доза-ответ между перфтороктановым сульфонатом и избыточным весом/ожирением у детей (Lauritzen и соавт., 2018).
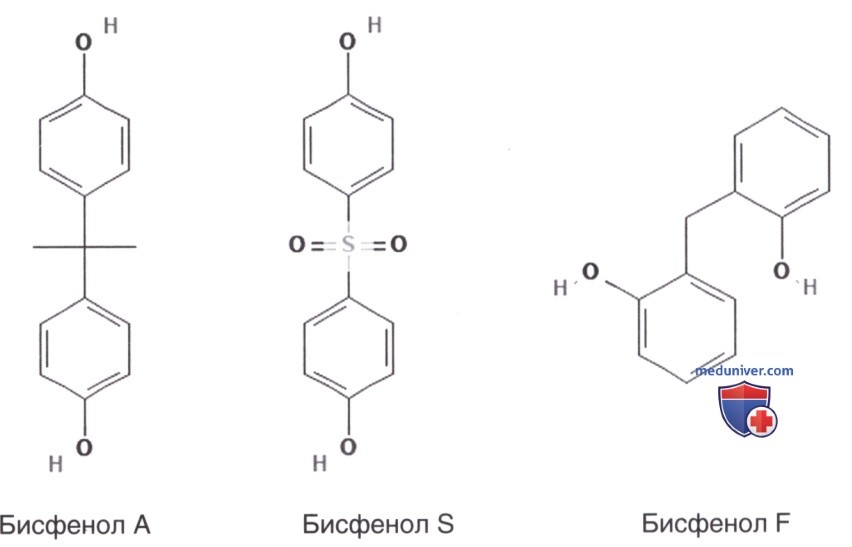
Бисфенол А (БСА) (рис. 1), загрязнитель пищевых продуктов, широко используется при производстве поликарбонатного пластика и эпоксидных смол, загрязняет пищу и напитки, попадая в них из тары. Концентрация БФА в организме была определенным образом связана с ожирением, набором веса и диабетом 2-го типа.
Недавно было показано, что у детей в возрасте 6—18 лет концентрация БФА в моче в третьем тертиле связана с повышением риска ожирения в 12,5 раз (Amin и соавт., 2019).
По данным другого исследования, в США в 2008 г. воздействие БФА было связано с развитием ожирения у детей в 12 404 случаев, и было подсчитано, что удаление БФА из продуктов питания могло бы предотвратить 6236 случаев развития ожирения в год, что было бы экономически выгодно (Trasande, 2014).
Есть свидетельства того, что во время беременности воздействие БФА увеличивает риск детского ожирения от + 20% до + 69%. Это изменение приведет к 42 400 новым случаям в год, а связанные с этим пожизненные расходы составят 1,54 млрд евро. Ожирение у взрослых, связанное с воздействием фталатов, является вторым по величине фактором, влияющим на затраты на здравоохранение (15,6 млрд евро в год) (Trasande и соавт., 2015).
Из-за хорошо известного разрушающего действия БФА на эндокринную систему это химическое вещество ряда изделий и в большинстве случаев заменено аналогами, бисфенолом F и бисфенолом S. Однако результаты некоторых предварительных исследований in vitro и исследований на животных вызывают озабоченность по поводу безопасности этих двух аналогов.
В крупном эпидемиологическом исследовании, проведенном в США среди взрослых (1521 участника Национального обследования состояния здоровья и питания за 2013—2014 гг.), оценивалась концентрация БФА, бисфенола F и бисфенола S в моче. Исследование подтвердило наличие значимой связи между воздействием БФА с общим и абдоминальным ожирением, в случае бисфенола F или бисфенола S значительной связи продемонстрировано не было (Liu и соавт., 2017). Напротив, недавнее крупное эпидемиологическое исследование у детей и подростков показало, что в этой возрастной группе наблюдалась положительная связь между концентрацией бисфенола F и более высоким риском ожирения (Liu и соавт., 2019).
Фталаты (рис. 2) широко используются в производстве в пластмасс для повышения их гибкости. Фталаты попадают в организм с загрязненными продуктами питания или выделяются из контейнеров. Было описано двукратное увеличение воздействия фталатов на фоне диеты с высоким содержанием мяса и молочных продуктов. Фталаты также обнаруживаются в смесях для младенцев, в вине и виноградном спирте; их метаболические эффекты аналогичны таковым у БФА и зависят от способности регулировать экспрессию генов, участвующих в дифференцировке адипоцитов и адипогенезе, а также от участия в ряде метаболических процессов (Di Ciaula и Portincasa, 2017).
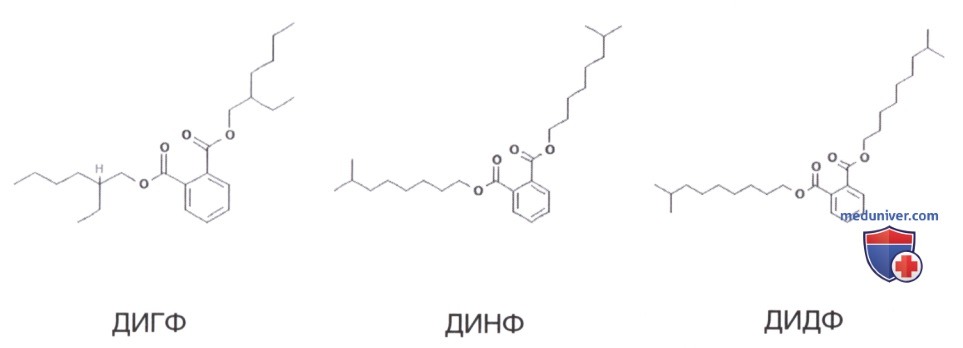
Анализ данных NHANES (766 детей в возрасте от 12 до 19 лет) показал прямую взаимосвязь между уровнями метаболитов диэтилгексилфталата (ДЭГФ) и инсулинорезистентностью с увеличением H0MA-IR на 0,27 для каждого log (примерно в три раза) увеличения уровня метаболитов ДЭГФ. Распространенность инсулинорезистентности в исследуемой популяции была значительно ниже (14,5%) в первом тертиле метаболита ДЭГФ, чем в третьем тертиле (21,6%) (Trasande и соавт., 2013).
Аналогичным образом, концентрации диизононилфталата в моче, предлагаемого в качестве заменителя ДЭГФ и обычно обнаруживаемого в обработанной пище, были связаны с повышенной инсулинорезистентностью в поперечном исследовании подростков из когорты NHANES 2009—2012 гг. (Attina и Trasande, 2015).
Только в Европейском союзе исследователи подсчитали, что воздействие фталатов может увеличить риск ожирения и диабета на 40-69%, при этом ежегодно у пожилых женщин возникает 53 900 случаев ожирения и 20 500 новых случаев диабета (Trasande, 2014).
Исследования на животных и людях указывают на конкретную взаимосвязь между воздействием фосфорорганических и хлорорганических пестицидов также и во время беременности, а также метаболическими нарушениями, включая ожирение (Di Ciaula и Portincasa, 2017).
Кроме того, глифосат, самый популярный гербицид, используемый во всем мире, влияет на экспрессию генов, участвующих в адипогенезе, из-за индукции рецептора у, активируемого пролифератором пероксисом и окислительного стресса (перекисное окисление липидов), изменяя клеточную физиологию (Martini и соавт., 2016).
Микробиота кишечника становится важнейшим фактором в сложных путях, определяющих риск метаболических нарушений, таких как ожирение и диабет 2-го типа, в основном за счет синтеза короткоцепочечных жирных кислот, которые способны действовать как молекулы передачи сигнала через G-белковые рецепторы (FFAR2, FFAR3, OLFR78, GPR109A) на различных уровнях (мозг, периферические нервы, мышцы, печень, кишечник), модулирующие метаболический гомеостаз.
Кишечная микробиота также может действовать посредством эпигенетических механизмов (главным образом, ингибирования активности гистондеацетилазы), способных модулировать экспрессию генов и способствовать возникновению метаболических нарушений, включая ожирение (Kasubuchi и соавт., 2015).
С другой стороны, микробиота кишечника является первой точкой, на которую воздействуют химические вещества после приема загрязненным пищи, играя таким образом ключевую роль в последующем развитии токсических эффектов, которые могут включать дисбактериоз кишечника.
Хлорпирифос, широко распространенный пестицид, при попадании в организм с загрязненной пищей может изменять состав кишечной микробиоты, тем самым нарушая ее действие на метаболические процессы и модулируя патологические механизмы, приводящие к развитию ожирения и инсулинорезистентности.
Было показано, что воздействие хлорорганических пестицидов (цис-нонахлор, оксихлордан и транс-нонахлор) приводит к изменению количества метанобактерий, что, в свою очередь, сопряжено с большей массой тела, окружностью талии (Lee и соавт., 2011) и ожирением (Н. Zhang и соавт., 2009).
По данным некоторых исследований на животных, было описано изменение микробиоты кишечника, вызванное попаданием в организм тяжелых металлов (в частности, мышьяка, свинца), фунгицидов (ВРА), фталатов, парабенов и триклозана, помимо пестицидов.
Метаанализ 41 поперечного и 8 проспективных исследований с участием этнически разнородных популяций показал, что концентрация диоксинов, ПХБ и хлорированных пестицидов в сыворотке крови имела значительную связь с риском развития диабета 2-го типа, значение объединенного ОР составляло, соответственно, 1,91, 2,39 и 2,3. Ассоциация с диабетом 2-го типа была также показана для концентраций БФА и фталатов в моче (объединенный ОР, соответственно, 1,45 и 1,48) (Song и соавт., 2016).
Анализ данных Национального исследования здоровья и питания (NHANES) за 2007—2010 гг. выявил среди населения США значительную зависимость доза-ответ между квартилем концентрации в моче 3-фенокси-бензойной кислоты (наиболее распространенный метаболит пиретроидов, широко распространенных инсектицидов) и распространенностью диабета с поправкой на факторы, искажающие результаты (Park и соавт., 2018). Кроме того, согласно данным исследования состояния здоровья населения, задействованного в сельском хозяйстве (13 637 участников), использование трех фосфорорганических пестицидов (фонофос, форат, паратион), хлорорганического пестицида дильдрин и гербицида 2,4,5-Т/2,4,5-ТР способствует повышению заболеваемости сахарным диабетом (Starling и соавт., 2014).
Следует отметить, что фенотипические проявления ожирения также могут развиваться в связи с появлением эпимутаций (то есть эпигенетических изменений в родительских сперматозоиде и яйцеклетке), наследуемых будущими поколениями. Недавнее исследование на животных показало, что временное воздействие дозы глифосата (повсеместно применяемого гербицида), соответствующей половине предельно допустимой концентрации у беременных самок крыс поколения F0 в течение 8—14 дней гестации, вызвало значительное увеличение случаев ожирения у самцов и самок глифосатной линии F2 (внучатое потомство) и F3 (правнуки) по сравнению с потомством контрольной линии. В частности, наследуемые случаи ожирения (поколение F3) наблюдались примерно у 40% самок и и 42% самцов линии глифосата.
Эти результаты были объяснены эпигенетическим наследованием (измененное метилирование ДНК) в сперматозоидах в поколениях F1 и F2 при прямом воздействии глифосата, а также в поколении F3 при воздействии на родителей (без прямого воздействия на потомство) (Kubsad и соавт., 2019).
Химические вещества, разрушающие эндокринную систему (ХВРЭС) также могут попадать в организм в процессе дыхания в результате загрязнения воздуха. Некоторые свидетельства указывают на то, что, помимо хорошо известных респираторных, сердечно-сосудистых, неврологических и онкологических эффектов, загрязнение воздуха (в основном в виде повышения концентрации в воздухе диоксида азота, твердых частиц и полициклических ароматических углеводородов) также может способствовать развитию инсулинорезистентности и, таким образом, рассматриваться как фактор риска развития ожирения, сахарного диабета 2-го типа и его осложнений.
Основными механизмами, связывающими атмосферные загрязнители с метаболическими нарушениями, являются усиление окислительного стресса, модуляция эпигенетических механизмов (в основном метилирование ДНК) и, возможно, изменения микробиоты кишечника.
Воздействие твердых частиц (РМ10) и диоксида азота приводит к развитию инсулинорезистентности у детей школьного возраста, даже при действии загрязняющих веществ в концентрациях намного ниже разрешенных действующим законодательством (Thiering и соавт., 2013).
Также было показано, что воздействие диоксида азота и РМ2,5 (мелких твердых частиц) на мать во время беременности приводит к увеличению уровня адипонектина в пуповинной крови, что может отрицательно сказаться на метаболическом гомеостазе плода (Lavigne и соавт., 2016). Точно так же воздействие полициклических ароматических углеводородов на беременных женщин увеличивает риск развития ожирения у детей (Rundle и соавт., 2012).
Давно известна роль мелких твердых частиц в повышении смертности от диабета. Как было показано в крупном канадском проспективном когортном исследовании (2,1 млн взрослых), риск смертности от диабета увеличивается в 1,49 раза при увеличении концентраций РМ2,5 в атмосфере на каждые 10 мкг/м3 и сохраняется при концентрациях ниже 5 мкг/м3 (Brook и соавт., 2013).
- Читать "Экология как причина сахарного диабета 1-го типа"
Редактор: Искандер Милевски. Дата публикации: 19.3.2023
- Химические вещества, разрушающие эндокринную систему (ХВРЭС)
- Экология как причина инсулинорезистентности, ожирения, сахарного диабета 2-го типа
- Экология как причина сахарного диабета 1-го типа
- Экология как причина заболеваний щитовидной железы
- Экология как причина репродуктивных нарушений
- Экология как причина гормонально-зависимых опухолей
- Эндокринные эффекты радиочастотных электромагнитных полей
