Микробиологическая диагностика возбудителя столбняка (C. tetani)
а) Отбор материала для исследования. При раневых клостридиозах (столбняк, газовая гангрена) у больного берут из раны (по возможности, из глубины, на границе измененных и здоровых тканей) кусочки тканей размером 0,5-1,0 см3, экссудат в объеме 0,5—1,0 мл, инородные тела, а также кровь из вены — 3-5 мл. В случаях постабортной инфекции берут содержимое матки, при столбняке новорожденных — материал из пупочного канатика. От трупа исследуют, помимо материалов из раны, пунктат из региональных лимфатических узлов, кровь из сердца, кусочки печени и селезенки.
Все пробы отбирают с соблюдением правил асептики в стерильную посуду, плотно закрывают пробками и не позднее чем в течение 3 ч доставляют в лабораторию, где сразу же приступают к анализу. При невозможности быстрой доставки пробы помещают в жидкие питательные среды, содержащие редуцирующие вещества (тиогликолат натрия, цистеин). Кроме того, материал можно сохранить в течение 1-3 сут. в замороженном состоянии.
б) Схема анализа на раневые клостридиозы. Учитывая, что все клостридиозы являются токсинообусловленными инфекциями, причем основополагающим признаком в лабораторной диагностике является обнаружение соответствующего токсина или токсигенного микроба, в схеме анализа предусматривают два параллельных направления: А — обнаружение токсина; Б — обнаружение микроба-возбудителя.
А. Обнаружение токсинов является одним из экспрессных способов лабораторной диагностики клостридиозов, ибо для этого не требуется высева материалов и культивирования на питательных средах. Токсины клостридий смертельны, что достоверно можно установить только по летальному эффекту и его нейтрализации на лабораторных животных (обычно белые беспородные мыши) в реакции биологической нейтрализации (РБН) с соответствующими антитоксическими сыворотками.
Иммуносерологические тесты для обнаружения токсина как антигена — реакция непрямой гемагглютинации (РИГА), иммуноферментный анализ (ИФА), латекс-агглютинация (ЛА), коагглютинация (КоАг) — достаточно специфичны при изготовлении тест-систем на основе высокоспецифичных иммуноглобулинов. РНГА и ИФА на один-два порядка чувствительнее и короче по времени получения ответа, чем РБН. Л А и КоАг менее чувствительны и специфичны, чем другие реакции, но ввиду быстроты проявления эффекта (минуты) могут служить ориентировочными, сигнальными тестами. Методики постановки указанных реакций должны содержаться в соответствующих «Наставлениях».
Подготовка материалов для токсикологического исследования зависит от того, какие тесты будут использованы для обнаружения токсинов. Для постановки РБН жидкие (исключая сыворотку крови) или разведенные 1:1 физиологическим раствором суспензии плотных материалов достаточно профильтровать через ватно-марлевый фильтр или осадить центрифугированием при 3000 об/мин 15 мин. Для использования иммуносерологических тест-систем требуется центрифугирование при 6000-7000 об/мин 15-20 мин. Фильтрация материалов через бумажные тальковые фильтры недопустима, так как они сорбируют на себе токсины.
Принцип постановки РБН заключается во взаимодействии токсина и соответствующего антитоксина сыворотки in vitro и проявлении нейтрализующего токсин эффекта in vivo, обычно на белых мышах массой 14-16 г. Техника постановки РБН идентична для всех видов клостридиальных токсинов, за исключением методов введения животным:
— в первую пробирку (опыт) вносят 1,5 мл испытуемого материала и 0,75 мл антитоксической сыворотки, активность 5-10 МК/мл;
— во вторую пробирку (контроль) вносят 1,5 мл испытуемого материала и 0,75 мл физиологического раствора.
После экспозиции 30-40 мин при комнатной температуре смесь вводят двум белым мышам одним шприцом по 0,75 мл сначала из контрольной, затем из опытной пробирки. В случае гибели контрольных животных и выживания опытных, РБН считается положительной, а вид и тип использованной для нейтрализации сыворотки указывает на вид и тип искомого токсина.
Метод введения токсинов клостридий влияет на проявление диагностически значимых клинических признаков у мышей. Для выявления столбнячного токсина материал вводят внутримышечно в заднюю лапку животного. Характерные симптомы столбняка развиваются сначала на стороне введения в виде резкого напряжения хвоста (ригидность) с искривлением его в сторону поражения, далее развиваются спазм и паралич мышц ноги, сопровождающийся искривлением позвоночника, затем наблюдается судорожный паралич тела и гибель от остановки дыхания. Быстрота развития симптоматики прямо зависит от концентрации токсина: при высоких концентрациях уже через несколько часов без выраженных симптомов локального столбняка могут наблюдаться паралитическая форма заболевания и гибель животного.
Б. Обнаружение микроба-возбудителя. Ввиду особенностей патогенеза столбняка, при котором малые дозы токсина способны вызывать необратимые явления с классической симптоматикой, лабораторный микробиологический анализ часто бывает ретроспективным и может лишь подтвердить диагноз при жизни или постмортально. Отсутствие положительного результата лабораторного анализа не отрицает наличия столбняка, так как травмы, послужившие входными воротами инфекции, бывают малы и незаметны, а количество токсина, вызвавшее заболевание, настолько мало, что его не удается выявить существующими методами. Серологическая диагностика у больных не имеет практического применения.
Обнаружение столбнячного токсина и микроба в организме больного возможно только в случаях, когда присутствует активно функционирующий локус инфекции, в котором идет вегетация микроба и токсинообразование. Это может наблюдаться при постоперационном, постабортном и пупочном столбняке.
В качестве экспресс-анализа используют световую микроскопию и реакцию иммунофлюоресценции (РИФ) мазков и мазков-отпечатков из раны, в которых по морфологии и при помощи РИФ можно обнаружить столбнячную палочку.
Посев содержимого ран и других материалов производят в две пробирки (одну из них прогревают при 80°С 20 мин) с жидкими средами обогащения: мясным или печеночным бульоном с 0,03% тиогликолевой кислоты или с 0,08% цистеина, которые инкубируют при 37 °С в течение 18-24 ч. Затем посевы испытывают на наличие токсина и путем микроскопирования, а также делают пересевы на плотные питательные среды (сахарный кровяной агар, печеночный агар, агар высоким столбиком) для выделения чистых культур. Определение чувствительности к антибиотикам столбнячного микроба не имеет практического применения.
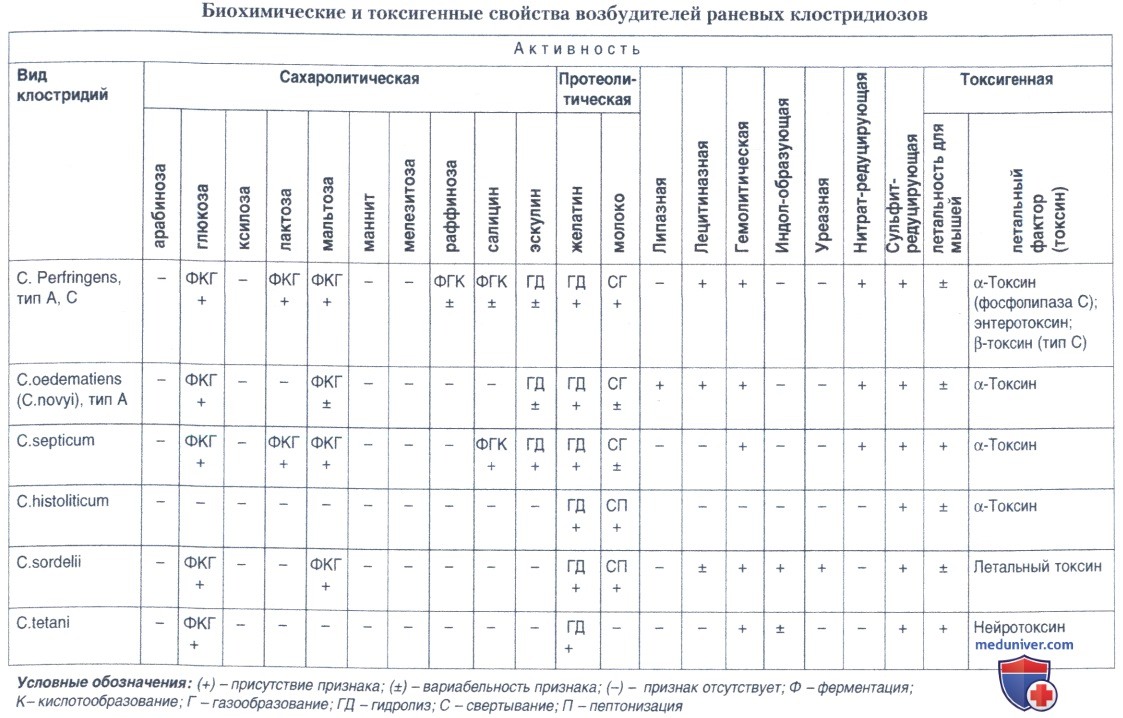
Идентификацию выделенных культур проводят в соответствии с данными, приведенными в таблице ниже.
Следует подчеркнуть, что столбнячный микроб является практически несахаролитическим и непротеолитическим видом клостридий. Окончательная его идентификация заключается в определении токсигенности, что в целом занимает не менее 96 ч.
в) Критерии диагностики столбняка:
1. Предварительный ответ дают по совокупности клинических данных и результатов световой микроскопии и РИФ мазков-отпечатков из раневого содержимого.
2. Окончательный положительный ответ выдают на основании обнаружения столбнячного токсина в организме больного или в культуральной жидкости посевов патологического материала.
3. Подтверждает диагноз выделение и идентификация столбнячного микроба.
- Читать далее "Лечение и профилактика столбняка"
Редактор: Искандер Милевски. Дата публикации: 16.12.2019
- Возбудитель столбняка (Clostridium tetani): таксономия
- Морфологические и культурально-биохимические свойства возбудителя столбняка (C. tetani)
- Факторы патогенности возбудителя столбняка (C. tetani)
- Патогенез и клиника столбняка
- Иммунитет при столбняке
- Эпидемиология столбняка
- Микробиологическая диагностика возбудителя столбняка (C. tetani)
- Лечение и профилактика столбняка
