Диагностика возбудителя внутрибольничного сальмонеллеза (ВБС)
Возбудитель инфекции — крайне важная составляющая часть эпидемического процесса. Характеризуя сальмонеллез как внутрибольничную инфекцию, необходимо отметить особенности биологических свойств возбудителей, имеющих едва ли не решающее значение в возникновении очагов инфекции. Это связано с тем, что практически все описанные внутрибольничные вспышки сальмонеллезов (за исключением пищевых) вызывают возбудители, отличающиеся одним общим свойством - множественной устойчивостью к химиотерапевтическим препаратам, и в первую очередь — к антибиотикам.
Госпитальные штаммы S. typhimurium, изолированные от больных и из внешней среды в процессе наблюдения за длительно существовавшим эпидемическим очагом внутрибольничного сальмонеллеза (ВБС) (33 мес.) в одном из крупных многопрофильных стационаров для взрослых г. Москвы, имели типичную для сальмонелл морфологию, биохимические и серологические свойства (97,2%). Следует отметить, что 98,6% штаммов с одинаковыми биохимическими свойствами по способности декарбоксилировать лизин и ферментировать инозит и рамнозу относились к одному субварианту: лизин +, инозит +, рамноза +.
Определение отношения S. typhimurium к международному набору индикаторных фагов Феликса и Келлоу показало, что штаммы биовара IIR (полирезистентного к антибиотикам) не типируются ими.
С помощью набора индикаторных фагов, разработанного в Тбилисском НИИВС, выявлено, что большинство госпитальных штаммов S. typhimurium относится к 20-му фаговару, но встречаются изредка также фаговары 25, 29 и 30.
Установлено, что 20-й типовой фаг набора индикаторных фагов Тбилисского НИИВС идентичен 208-му фагу из набора Андерсона. Абсолютное большинство зарубежных вспышек ВВС вызывает именно 208-й фаговар сальмонелл.
Известно, что значительная часть вспышек нозокомиального сальмонеллеза связана с полиантибиотикорезистентными штаммами S. typhimurium. Указанная тенденция сохраняется и в современный период.
У преобладающего количества выделенных госпитальных штаммов сальмонелл отмечена устойчивость к целому ряду антибиотиков (левомицетину, канамицину, ампициллину, тетрациклину, стрептомицину, гентамицину, ко-тримоксазолу) в концентрации, превышающей 100 мкг/мл.
В последние годы особое беспокойство вызывает появление и распространение устойчивости не только к традиционным вышеуказанным антибиотикам, но и к цефалоспоринам третьего поколения, что приводит к серьезным трудностям в лечении генерализованных и локализованных внекишечных форм сальмонеллезной инфекции.
Устойчивость к цефалоспоринам третьего поколения, как правило, связана с плазмидами, кодирующими р-лактамазы расширенного спектра. Так, в Мадриде описана вспышка сальмонеллеза в педиатрическом стационаре, вызванная штаммом цефтазидим-резистентной S. enterica subsp. enterica серотипа othmarschen. Его устойчивость была связана с наличием плазмидной β-лактамазы ТЕМ-27. Описано формирование резистентности к цефотаксиму у S. enteritidis в процессе лечения этим антибиотиком, причиной явилась также БЛРС.
В Стамбуле описана вспышка неонатальных гастроэнтеритов и менингитов в нескольких стационарах, вызванная S. typhimurium, которая имела плазмиду β-лактамазы расширенного спектра PER-1. Близкородственная β-лактамаза PER-2 была обнаружена у штамма S. typhimurium в Аргентине. Исследователями описаны р-лактамазы ТЕМ-1 и SHV-2, обеспечивающие полиантибиотикорезистентность госпитальных штаммов сальмонелл к цефалоспоринам III поколения, монобактамам, аминогликозидам, триметоприму, хлорамфениколу, сульфонамиду. A. Philippon и соавт. (1989) обнаружили β-лактамазу СТХ-1 (ТЕМ-3) у госпитальных штаммов S. typhimurium, резистентных ко многим цефалоспоринам.
Р.А. Bradford и соавт. (1998) описали р-лактамазу СТХ — М-5 — фермент, который явился причиной устойчивости госпитальных штаммов S. typhimurium к цефотаксиму.
В последние годы зарубежные исследователи стали часто упоминать о полирезистентном к действию антибиотиков нового госпитального штамма S. typhimurium DT104. Оказалось, что для S. typhimurium DT104 характерна устойчивость к действию фторхинолов, что ранее никогда не отмечалось у госпитальных штаммов, и этот факт ставит серьезную проблему перед учеными и практиками в отношении лечения этой инфекции.
В РФ также отмечается высокая частота антибиотикорезистентности сальмонелл. В Санкт-Петербурге и Ленинградской области в период с 1984 по 1991 гг. среди S. haifa более 90% штаммов проявляли устойчивость хотя бы к одному из традиционных антибиотиков (ампициллину, хлорамфениколу, аминогликозидам), среди S. typhimurium — 47,3%, S. enteritidis — 6,6% штаммов. Штаммов, устойчивых к ципрофлоксацину, выделено не было, данных об устойчивости к цефалоспоринам третьего поколения не обнаружено.
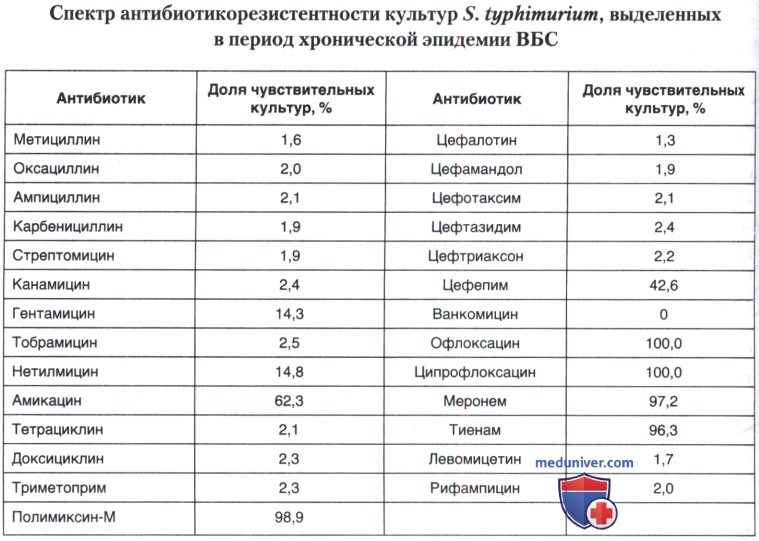
Культуры S. typhimurium (2584), выделенные от больных сальмонеллезом в ходе эпидемиологического наблюдения за очагом, проявляли аналогичную антибиотикорезистентность (табл. 10.6). Следует отметить, что основное количество выделенных штаммов S. typhimurium было полностью резистентно к 18 из 27 исследуемых антибиотиков, среди которых антибиотики пенициллинового ряда, значительная часть аминогликозидов, тетрациклины, цефалоспорины I—III поколений, макролиды, гликопептиды, антибиотики разных групп (левомицетин, рифампицин), сульфаниламидные препараты (триметоприм). На протяжении всей хронической эпидемии выделяемые штаммы были чувствительны к препаратам фторхинолонового ряда, карбапенемам, полимиксину-М и умеренно чувствительны к ряду препаратов группы аминогликозидов II и III поколений (гентамицину, нетилмицину, амикацину), цефалоспорину IV поколения — цефепиму.
Формирование множественной лекарственной устойчивости обусловлено наличием у госпитальных штаммов конъюгативной R-плазмиды. Основной механизм лекарственной устойчивости, сообщаемой бактериям R-плазмидами, — приобретение клетками способности синтезировать энзимы, разрушающие химиотерапевтический препарат. Широкое распространение множественной лекарственной устойчивости, детерминированной R-плазмидами, обусловлено как в основном селекционными преимуществами, связанными со способностью передавать устойчивость одновременно ко многим антибактериальным препаратам, используемым в практике, так и со способностью R-плазмид передаваться посредством конъюгации между бактериями, принадлежащими к разным типам, видам, родам и даже семействам.
Молекулярно-генетические исследования госпитальных штаммов, проводимые в различных странах, позволили установить неоднородность молекулярных масс плазмидных ДНК. Исследователями описаны плазмиды госпитальных штаммов сальмонелл с молекулярной массой 38 МДа, 65 МДа, 81 МДа, 59 kb, 98,0,6,76 и 3,8 kb.
Исследован плазмидный профиль части выделенных штаммов S. typhimurium. Выявлены типичный и нетипичный плазмидные профили. Типичный плазмидный профиль характерен для большинства исследованных штаммов (95,2%) и представлен тремя плазмидами размером 128,7 kb, 17,4 kb и 2,4 kb. Наличие плазмиды вирулентности размером 128,7 kb свидетельствует об антропонозном происхождении возбудителя сальмонеллеза, причем, что характерно для плазмид такого размера, в геном, вероятно, включен фактор антибиотикорезистентности.
Анализ плазмидных профилей штаммов, выделенных от персонала стационара, также позволил показать полное совпадение их спектров с типичным плазмидным портретом штаммов, выделенных от пациентов.
При определении чувствительности культур, выделенных от больных, к коммерческому препарату лечебного комплексного сальмонеллезного бактериофага производства ДП «Биофаг» НПО «Иммунопрепарат» (г. Уфа) установлено отсутствие его действия на основную часть (более 98%) штаммов S. typhimurium. В связи с этим возникла необходимость адаптации бактериофага к выделенным культурам S. typhimurium, которая была проведена производителем. Применение адаптированного препарата бактериофага продемонстрировало его высокие литические свойства к выделяемым в последующем культурам возбудителя. Фаголизабельность культур оценивалась «+++» и «++++» вне зависимости от исследуемого материала и времени его взятия. Изменения фаголизабельности бактерий не отмечалось в течение всего времени наблюдения за очагом (1,5 года). Фагорезистентных культур выявлено не было.
Исследования, направленные на изучение дополнительных факторов вирулентности штаммов S. typhimurium, выделенных в период хронической эпидемии, показали, что подавляющая часть выделенных госпитальных штаммов — 141 из 152 изученных (92,8%) — обладает антилизоцимной активностью.
При изучении в опытах с праймерами invA гена у госпитальных штаммов S. typhimurium выявляется положительная реакция в 90,8% случаев (89 из 98 изученных). Наличие invA гена коррелирует с адгезивной (89,8%) и инвазивной способностью (86,7%) сальмонелл и подтверждает сохранение патогенного потенциала возбудителя.
Способность S. typhimurium продуцировать IgA-протеазу исследовали с помощью реакции агрегатгемагглютинации (РАГА) и полимеразной цепной реакции. Показано, что музейные эталонные штаммы S. typhimurium не обладают iga-генами. Такие гены не обнаружены ни в хромосоме бактерии, ни в ДНК собственной плазмиды с молекулярной массой 60 МДа.
Госпитальные штаммы дали положительную реакцию на наличие iga-генов в 63,6% случаев (49 из 77 изученных штаммов). Указанное свойство у госпитальных штаммов S. typhimurium выявлено и описано нами впервые.
В процессе хранения и пересевов культур S. typhimurium, так же как и у многих других видов патогенных бактерий, отмечается утрата вирулентности, связанная с явлением сегрегации генов, определяющих выражение патогенных свойств. Это происходит вне организма хозяина, чувствительного к возбудителю, в связи с чем требуется либо пассирование штаммов через организм чувствительных лабораторных животных, либо хранение культур в лиофильно высушенном состоянии. Указанное явление позволяет объяснять способность синтеза IgA-протеазы лишь основной частью госпитальных штаммов S. typhimurium (63,6%), несмотря на однородность их молекулярно-генетических характеристик (95,2%).
Следует подчеркнуть, что сальмонеллы могут быть выделены не только из кала и крови (при бактериемии 75%) пациентов, но также довольно часто и из других биологических жидкостей организма (25%), в том числе желчи, мокроты, экссудатов грудной и брюшной полостей, гнойного отделяемого ран, промывных вод при бронхоскопии и др.
Серологическая диагностика при ВВС имеет вспомогательное значение, учитывая «фоновые» показатели населения и существенное снижение иммунного статуса пациентов. Подтверждением диагноза целесообразно считать наличие положительной динамики титров к групповому (В) сальмонеллезному О-антигену не менее чем в 4 раза (при отсутствии таковой в отношении антигенов других групп). При отсутствии положительной динамики титров условно-диагностическим считают титр не ниже 1:400.
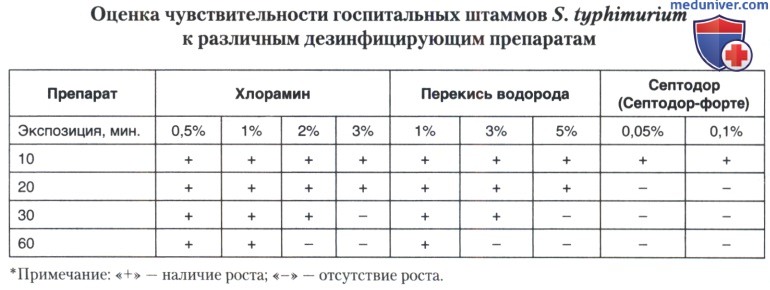
Важно подчеркнуть высокую устойчивость возбудителя инфекции к действию факторов внешней среды, в том числе дезинфектантов. Эта особенность является значимой для характеристики возбудителя, понимания специфики динамики проявлений эпидемического процесса и длительности существования эпидемических очагов внутрибольничного сальмонеллеза (ВБС).
Данные таблицы свидетельствуют о том, что госпитальные штаммы S. typhimurium обладают значительной устойчивостью к действию высоких концентраций традиционно используемых дезинфицирующих средств. В практической деятельности получен хороший эффект при использовании препаратов на основе четвертичных аммониевых соединений.
Другим важным свойством возбудителей внутрибольничного сальмонеллеза (ВБС) является длительная выживаемость на объектах внешней среды. Так, в смывах с предметов больничных палат секторов реанимации через 60-80 дней после окончания регистрации манифестных форм заболеваний обнаруживали S. typhimurium с характерными свойствами. Одним из важнейших факторов передачи сальмонелл является палатная пыль, в которой они длительное время сохраняются. Например, при исследовании пыли из труднодоступных мест палатных секций одного из хирургических отделений S. typhimurium была выделена через 127 дней после регистрации последнего заболевшего ВВС в данной палате.
Все эти свойства возбудителя в значительной степени определяют длительность существования эпидемического очага внутрибольничного сальмонеллеза (ВБС) и сроки его полной ликвидации, подчеркивая роль «госпитальной среды» в его формировании.
Таким образом, очевидно, что госпитальные штаммы сальмонелл (в большей степени S. typhimurium) представляют собой особую биологическую разновидность, характеризующуюся рядом свойств, позволяющих их дифференцировать от обычных штаммов соответствующих сероваров. Они обладают способностью поддерживать внутрибольничные очаги инфекции, характеризующиеся особенностями течения эпидемического процесса в отличие от классической сальмонеллезной инфекции (зооноза). Специфика свойств госпитальных штаммов S. typhimurium во многом определяет характер и тяжесть течения инфекционного процесса, ведущие пути и факторы передачи инфекции в стационаре для взрослых, длительность и особенности проведения комплекса противоэпидемических мероприятий по ликвидации очагов.
- Читать далее "Особенности лечения внутрибольничного сальмонеллеза (ВБС)"
Редактор: Искандер Милевски. Дата публикации: 28.7.2020
- Иммунитет при внутрибольничном сальмонеллезе (ВБС)
- Осложнения и причины летального исхода внутрибольничного сальмонеллеза (ВБС)
- Диагностика возбудителя внутрибольничного сальмонеллеза (ВБС)
- Особенности лечения внутрибольничного сальмонеллеза (ВБС)
- Профилактика внутрибольничного сальмонеллеза (ВБС) в ЛПУ
