Иммунитет при инфекции золотистого стафилококка (S. aureus)
Стафилококки заселяют покровы тела человека и других млекопитающих и в норме не вызывают заболевания. Из этого следует, что и человек, и животные обладают высокой резистентностью к стафилококковой инфекции. Сам характер большинства стафилококковых поражений говорит о высокой естественной резистентности хозяина-человека. Это проявляется в том, что очаги стафилококковой инфекции быстро ограничиваются благодаря скорой реакции полиморфноядерных лейкоцитов. Фагоциты хозяина взаимодействуют с микроорганизмами, в результате чего происходит образование гноя. При нарушении функции полиморфноядерных лейкоцитов, например, при дефектах их метаболизма, возникающая инфекция протекает более тяжело.
Токсины стафилококка (α-токсин, лейкоцидин) также могут убивать полиморфноядерные лейкоциты или вызывать сужение сосудов, тем самым препятствуя инфильтрации очага полиморфноядерными лейкоцитами. Тяжелые стафилококковые инфекции могут возникать в результате скопления микроорганизмов в местах, недоступных для полиморфноядерных лейкоцитов (например, в бронхах, придаточных пазухах носа, волосяных фолликулах).
Несмотря на то, что неспецифическая резистентность человека к стафилококковой инфекции высока, специфический иммунный ответ даже при реинфекции остается на низком уровне. Организм людей, у которых в результате стафилококковой инфекции развился фурункул, не может противостоять повторному заражению. Фурункулы могут рецидивировать, а микроорганизмы, вызывающие их, остаются идентичными по фаготипу тем, которые вызвали первичную инфекцию. Из сказанного можно сделать вывод, что высокая видовая резистентность человека в норме к стафилококковой инфекции сочетается с низким специфическим иммунным ответом на повторную инфекцию.
а) Неспецифические механизмы защиты от стафилококковой инфекции. К неспецифическим механизмам, играющим определенную роль в защите от стафилококков, помимо фагоцитоза, можно отнести действие клеток реснитчатого эпителия и продукцию защитного слоя слизи слизистыми оболочками респираторного и урогенитального трактов. Интактная кожа также служит физическим и химическим барьером для бактериальной инфекции. В случае нарушения этих естественных механизмов защиты может возникнуть инфекция. Прикрепившись в месте входных ворот, стафилококки противодействуют естественным механизмам защиты того или иного органа либо ткани. Так, например, некоторые штаммы стафилококков способны противостоять очистительным свойствам слизи и вымыванию их при прохождении мочи, молока или противодействуют антибактериальным факторам молозива.
К бактериостатическим (бактерицидным) компонентам сыворотки, имеющим антистафилококковую активность, относятся а-глобулин, железосвязывающие белки, лизоцим, прогестерон, С-реактивный белок, белки, выделяемые из тромбоцитов, высвобождающиеся при свертывании, а также катионные белки, высвобождаемые из фагоцитирующих клеток при фагоцитозе. Некоторые из этих факторов могут действовать совместно в воспалительном экссудате, но удельная значимость каждого из них при инфекции пока неизвестна.
В случае проникновения стафилококков через поврежденную ткань в результате травмы или благодаря своей способности формировать колонии и размножаться в волосяных мешочках и на слизистой они сразу же подвергаются атаке второго эшелона защиты хозяина. Эти механизмы объединяются под термином «воспаление». Одним из наиболее очевидных признаков воспаления является локальное повышение температуры и покраснение кожи вследствие усиления проницаемости капилляров. Другие изменения включают нарушение гибкости эндотелия капилляров, инфильтрацию полиморфно-ядерными лейкоцитами, отек и окклюзию (закупорку) кровеносных и лимфатических сосудов. Явления острого воспаления при интрадермальном введении стафилококков сходны с изменениями, вызванными инокуляцией других микроорганизмов. Эти реакции развиваются быстро, а исход повреждений наблюдается в течение 3-5 ч. Повышенная проницаемость капилляров развивается по следующей схеме: через 30 мин после введения инфекта происходит ее кратковременное понижение, после чего она резко повышается и достигает своего максимума через 3-5 ч после заражения. Расширение сосудов и увеличение их проницаемости способствуют притоку нейтрофилов и инфильтрации ими тканей.
Появление полиморфно-ядерных лейкоцитов можно обнаружить уже через 1 ч после заражения, их число достигает максимума через 3 ч. Окклюзия сосудов возникает не всегда и происходит через 6-8 ч после заражения.
Как уже указывалось, разрушение инфекта фагоцитирующими клетками является одним из важнейших способов борьбы с инфекцией, проникшей в организм в результате нарушения физических барьеров кожи и слизистых оболочек. При стафилококковой инфекции роль фагоцитов в борьбе с инвазирующими микроорганизмами имеет первостепенное значение. Больные с временной или постоянной дисфункцией фагоцитов наиболее подвержены заболеваниям стафилококковой природы.
Процесс фагоцитоза можно рассматривать как серию связанных между собой явлений, контролируемых различными метаболическими механизмами. Он начинается с движения фагоцитирующих клеток к очагу инфекции. Это движение, известное под названием «хемотаксис», может происходить в ответ на непосредственное высвобождение микроорганизмами соответствующих продуктов или в результате опосредованной активации хемотактических веществ, продуцируемых хозяином. Механизмы, при помощи которых фагоцитирующие клетки способны отличать вещества, продуцируемые хозяином, от инородных частиц или инвазирующих бактерий, полностью не установлены. Однако важную роль здесь, видимо, играет поверхностный заряд и гидрофобность частиц.
Антитела и компоненты комплемента взаимодействуют с бактериями и изменяют их поверхностные физические характеристики, тем самым способствуя эффективному распознаванию фагоцитами, прилипанию к ним бактерий с последующим поглощением. Этому предшествует попытка фагоцита прикрепиться при помощи цитоплазматической мембраны к микроорганизму. Если она оказалась успешной, то поглощение обычно происходит путем инвагинации (вдавливания) части поверхности фагоцитов с прикрепленным к ней кокком. Попадая внутрь фагосомы, микроорганизм подвергается мощному воздействию химических факторов, ферментов, окислительных механизмов и бактерицидных белков, которые высвобождаются в фагосому из мезосомальных гранул. Как уже упоминалось выше, наличие гноя, состоящего из погибших полиморфно-ядерных лейкоцитов, живых и убитых бактерий, является признаком стафилококкового повреждения. Следовательно, в большинстве случаев инвазирующие микроорганизмы могут быть локализованы при помощи полиморфно-ядерных лейкоцитов.
Однако образование гноя указывает и на то, что значительное количество полиморфно-ядерных лейкоцитов разрушено и может быть нарушена переваривающая способность фагоцитов, вследствие чего внутриклеточной гибели стафилококков не произойдет.
При попадании стафилококка из местного инфильтрата в кровь для успешной борьбы с инвазивными микроорганизмами фагоцитирующие клетки должны прежде всего войти с ними в контакт. Это может быть достигнуто несколькими путями. При кровяных инфекциях микроорганизмы входят в непосредственный контакт с фиксированными резидентными макрофагами селезенки, печени или легких во время прохождения крови через ткани этих органов. Одновременно полиморфноядерные лейкоциты из отдаленных участков могут быстро и эффективно двигаться к месту инфекции. Описаны как прямые, так и непрямые хемотактические и отрицательно хемотактические вещества для S. aureus. В этих механизмах важную роль играют пептидогликан и тейхоевые кислоты. Связанный с клеточной стенкой белок А, видимо, существенной роли не играет.
Острая воспалительная реакция при стафилококковой инфекции, опосредованная активацией комплемента, разворачивается двумя путями. Все пути (механизмы) активации комплемента (классический и альтернативный) ведут к образованию С3-конвертазы, которая расщепляет присутствующий в плазме крови компонент С3 на небольшой С3а-фрагмент и большой С3b-фрагмент. Установлено, что единственная молекула С3-конвертазы расщепляет сотни молекул С3. Подобное свойство делает С3-конвертазу важнейшим амплифицирующим (умножающим) звеном в системе комплемента, а расщепление С3 на С3а и С3b является центральным моментом любого из каскадов комплемента. Пути активации комплемента представлены на схеме ниже.
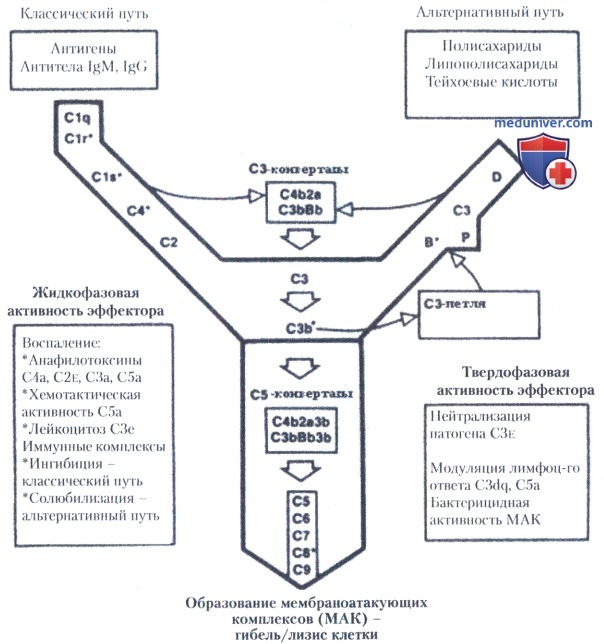
С3-конвертазы классического и альтернативного путей активации комплемента различны и обозначаются соответственно C4b2a и С3bВb. Фрагмент С3b, который отщепляют от С3 обе конвертазы, связывается с мембраной мишени (т.е. кокка) и становится фокусом дополнительного образования СЗЬ; эта ступень каскада получила название «петля усиления». Присоединяя дополнительно молекулу С3b, обе С3-конвертазы могут превращаться в конвертазу С5, которая функционирует как катализатор на первой ступени каскада, ведущего к образованию комплекса, лизирующего мембрану (мембраноатакующего комплекса — МАК). Начинается активация комплемента по альтернативному пути. С3-конвертаза закрепляется на поверхности микроорганизма и расщепляет большие количества С3. Фрагмент С3a выделяется, а многочисленные молекулы С3b связываются с микроорганизмом. Это активирует следующий этап с образованием С5а и лизирующего мембрану комплекса (МАК).
Далее С3а и С5а способствуют высвобождению медиаторов из тучных клеток и вместе с ними вовлекают полиморфноядерные нейтрофилы и другие компоненты системы комплемента в очаг проникновения микроорганизма. Все это вызывает расслабление стенок артерий и приводит к усилению кровотока и расширению мелких сосудов, в то время как сокращение клеток эндотелия капилляров позволяет выходить белкам плазмы из сосудов. Нейтрофилы замедляют движение у стенок капилляров, проникают в отверстия между эндотелиальными клетками (диапедез) и перемещаются по градиенту концентрации хемотаксических факторов до тех пор, пока не окажутся лицом к лицу с микроорганизмом, покрытым С3b. Далее происходит связывание микроорганизма с С3b-рецепторами нейтрофилов. С3а и С5а резко активируют клеточное дыхание, и мгновенно наступает финал последнего действия. Фрагмент С5а и другие продукты активации комплемента содействуют хемотаксису, агрегации и дегрануляции нейтрофилов и образованию свободных радикалов кислорода. Введение С5а животным приводит к артериальной гипотензии, сужению легочных сосудов, нейтропении и повышению проницаемости сосудов из-за повреждения эндотелия.
Благодаря субкомпоненту С3b происходит прочная фиксация возбудителя на поверхности разнообразных клеток-мишеней. Фиксированный С3b способен также взаимодействовать с IgG; такой биомолекулярный комплекс обладает высокой опсонизирующей активностью и служит пусковым механизмом для переваривания инфекта. Стафилококки, кроме капсульных штаммов, быстро адсорбируются на фагоцитирующих клетках и перевариваются, когда в окружающей среде имеется нормальная сыворотка. Последняя содержит количество антител, достаточное для того, чтобы произошла эффективная опсонизация. Она может происходить при помощи нескольких механизмов в зависимости от изучаемого стафилококкового штамма. Например, некоторые штаммы опсонизируются в присутствии IgG через классический путь активации комплемента, в других случаях антитела не требуются. В этом случае стафилококки опсонизируются, но более медленно через альтернативный путь активации комплемента. Опсонизация других штаммов происходит прежде всего через альтернативный путь активации комплемента и зависит от присутствия антител в сыворотке. IgG, по-видимому, являются наиболее важным классом иммуноглобулинов для опосредованной антителами опсонизации стафилококка.
Эффективное прикрепление фагоцитов к бактерии может быть вызвано взаимодействием антител и (или) компонентов комплемента с полимерами бактериальной клеточной стенки. Другой механизм включает взаимодействие цитофильных антител с фагоцитирующими клетками. Это взаимодействие происходит через Fc-фрагмент молекулы антитела, при этом Fab-фрагменты остаются свободны и способны связываться с антигенными детерминантами бактериальной клетки.
1. Роль компонентов клеточной стенки в опсонизации. Пептидогликан клеточной стенки стафилококков играет важную роль в опсонизации при помощи антител и (или) комплемента. Пептидогликан может активировать комплемент либо по классическому, либо по альтернативному пути.
Тейхоевые кислоты, видимо, играют несущественную роль в опсонизации. Мутант стафилококкового штамма, не содержащий тейхоевых кислот, опсонизируется и переваривается так же, как и его родитель, содержащий тейхоевые кислоты. Опсониновая активность не устраняется из человеческой сыворотки при адсорбции тейхоевых кислот. Однако было показано, что они активируют комплемент через классический путь.
Белок А. Общая картина эффективной опсонизации при помощи антител или комплемента может различаться в зависимости от штамма стафилококка, точнее от наличия или отсутствия на поверхности клеточной стенки белка А. Штаммы, содержащие наибольшее количество белка А, обладают наибольшей резистентностью к поглощению фагоцитами.
Капсула. Вирулентность стафилококка коррелирует с увеличением резистентности к фагоцитозу и размером капсулы. Капсульный материал стафилококка мешает опсонизации не только при классическом, но и при альтернативном пути активации комплемента. Механизм, при помощи которого капсула мешает активации комплемента, заключается в ее способности маскировать компоненты клеточной стенки стафилококка, активирующие комплемент. Определенный процент стафилококков может продуцировать капсульные антигены in vivo, а многие сыворотки человека содержат антикапсульные антитела. Тем не менее не все свежевыделенные капсульные штаммы стафилококков противостоят перевариванию фагоцитами.
2. Механизмы внутриклеточного уничтожения стафилококков при фагоцитозе. Необходимо отметить, что основная часть S.aureus погибает внутри фагоцита и лишь небольшое число микроорганизмов выживает внутри клетки. Внутриклеточного размножения S.aureus в нормально фагоцитирующей клетке практически не происходит.
После слияния фагосомы и лизосомы поглощенные бактерии подвергаются обработке рядом ферментов, бактерицидных белков и химических соединений, которые высвобождаются в фагоцитирующие вакуоли после дегрануляции, т.е. разрушения гранул. Эти бактерицидные механизмы включают низкое значение pH, миелопероксидазу, перекись водорода, катионные белки, различные протеазы, карбогидразы и липазы, продукты метаболизма кислорода, такие как супероксид, атомарный кислород и гидроксиловые радикалы, а также лактоферрин и лизоцим.
S. aureus способен продуцировать перекись водорода из супероксида как часть своего нормального метаболизма при помощи супероксид-дисмутазы. Накопление перекиси водорода нейтрализируется каталазой из S. aureus. Катионные белки также обладают способностью убивать стафилококки. Эти белки высвобождаются после дегрануляции фагоцитирующей вакуоли полиморфно-ядерных лейкоцитов, но не макрофагов.
Взаимоотношения, существующие между стафилококками и фагоцитирующими клетками, чрезвычайно сложны. Помимо общих наблюдений, что S. aureus и S. epidermidis эффективно поглощаются, S. aureus по неясным пока причинам имеет тенденцию к внутриклеточному выживанию в течение более длительного периода времени. Очевидно также, что механизмы фагоцитоза могут значительно различаться в зависимости от типа фагоцитирующей клетки, штамма стафилококка и присутствия или отсутствия антител или комплемента.
б) Специфические механизмы иммунного ответа. Стафилококки продуцируют большое количество внеклеточных продуктов. Иммунизирующая роль, которую они играют при естественно возникающих стафилококковых инфекциях, до конца не определена.
1. Роль антител к антигенам стафилококка. Продолжительность колонизации при назальном пути введения живой культуры стафилококка у добровольцев, которых сенсибилизировали и тестировали одним и тем же штаммом S. aureus, была значительно снижена при повторном заражении. Наоборот, продолжительность колонизации при действии гетерологичных штаммов стафилококка оставалась такой же, как и у контрольной группы добровольцев, т.е. неподверженных предварительному заражению. Это свидетельствует о штаммоспецифической защитной реакции в условиях локализованного лечения стафилококковой инфекции.
Новорожденные обладают врожденным видоспецифическим гуморальным иммунитетом. Организм детей старшего возраста и взрослых вырабатывает собственные антитела к стафилококкам в результате частого контакта с возбудителем, стафилококковых поражений кожи и мягких тканей, однако наличие антител не всегда предохраняет от заболевания. Общий уровень классов иммуноглобулинов при стафилококковой инфекции не дает четкого представления о характере процесса. Более информативны специфические иммуноглобулины, антигенами для выработки которых служат пептидогликан, тейхоевая кислота, суммарные антигены.
2. Гуморальный иммунный ответ на антигены стафилококка характеризуется продукцией IgM; усиление стимуляции вызывает выработку IgG.
Титр антистафилококковых антител достигает максимума через 6 сут. после однократной иммунизации. Затем происходит быстрое снижение (с постепенным замедлением) титров антител. Повторная иммунизация живой культурой стафилококка не приводит к существенному повышению титров антител. Таким образом, в обоих случаях имеет место анамнестическая реакция, высота которой зависит от предшествующих контактов с антигенами микроба.
3. Т-клеточный иммунный ответ. Клеточный иммунный ответ при инфекциях вызывают бактерии, которые могут выживать внутри фагоцитирующих соматических клеток, например, микобактерии, сальмонеллы, бруцеллы. Эта форма иммунного ответа опосредуется тимус-зависимыми лимфоцитами, которые отвечают на специфические антигенные стимулы неспецифической активацией.
Существует мало прямых доказательств, что Т-клеточный иммунный ответ играет существенную роль в предотвращении стафилококковой инфекции. Ни первичные, ни вторичные дефекты функции Т-лимфоцитов не связаны с увеличением чувствительности к стафилококковой инфекции. Клеточный иммунный ответ на S. aureus может быть зарегистрирован после повторяющейся стафилококковой инфекции, но только в том случае, если инфекцию сопровождала или ей предшествовала иммунизация (сенсибилизация) стафилококковым антигеном. Хотя опосредованная клетками реактивность к S. aureus распространена у человека, пока нет прямых доказательств, что она предотвращает хронические или рецидивирующие стафилококковые инфекции.
Развитие иммунологической памяти происходит достаточно быстро: уже через 2-3 сут. формируются клетки памяти в иммунокомпетентных органах. В течение последующих 4 сут. количество этих клеток увеличивается и долгое время остается постоянным. Иммунологическая память на стафилококк формируется при иммунизации высокими дозами антигена, а низкие дозы эффективны для индукции кратковременной памяти.
Существует несколько основных типов иммунологической гиперчувствительности в зависимости от места, где возникают эти реакции, и их интенсивности. В ответ на микробные стимулы они могут защищать, усиливать или не оказывать влияния на течение инфекции.
4. Гиперчувствительность немедленного типа. Стафилококковая тейхоевая кислота может вызывать анафилактическую гиперчувствителъностъ у людей, страдающих экземой и астмой, причем высокие уровни IgE могут отражать нарушения механизмов иммунного контроля.
5. Иммунокомплексная гиперчувствительность. Соединение антител IgM, IgG с антигеном может активировать комплемент. Иммунные комплексы в зависимости от их величины либо остаются в месте инфекции, либо циркулируют в периферическом сосудистом русле, гломерулах или суставах. Активация комплемента привлекает нейтрофилы, а высвобождение лизосомальных ферментов из фагоцитирующих клеток вызывает поражение тканей, некроз и кровоизлияние. При васкулите установлено наличие комплексов антигенов S. aureus и IgG-антител. Иммунокомплексный гломерулонефрит может возникать при подостром бактериальном эндокардите, вызванном S. aureus, и хронических инфекциях атриовентрикулярных клапанов, вызванных S. epidermidis. При излечении инфекций реакции гиперчувствительности прекращаются.
6. Гиперчувствительность замедленного типа (ГЗТ). При помощи кожных тестов показано, что у большей части человеческой популяции отмечается ГЗТ к S. aureus, хотя эта реактивность не является защитой от хронической или рецидивирующей стафилококковой инфекции.
Эксперименты, проведенные нами на животных, позволяют предположить, что сенсибилизация стафилококком по-разному влияет на исход инфекционного процесса. В одном случае при подкожном заражении ГЗТ сдерживает диссеминацию S.aureus, а в другом, наоборот, способствует распространению возбудителя при введении его непосредственно в кровь. Повреждение ткани, связанное с ГЗТ, обычно возникает при хронических бактериальных инфекциях, при которых микроорганизмы находятся внутри соматической клетки. Стафилококки обычно не выживают в течение длительного времени внутри клеток, однако у больных с дефектом оксидативных механизмов уничтожения микроб может выживать и размножаться внутри нейтрофилов и макрофагов. Возможно, что длительный антигенный стимул при таких состояниях приводит к неконтролируемой ГЗТ.
- Читать далее "Эпидемиология золотистого стафилококка (S. aureus)"
Редактор: Искандер Милевски. Дата публикации: 8.11.2019
- Золотистый стафилококк (Staphylococcus aureus): морфологические и культурально-биохимические свойства
- Антигены и гены золотистого стафилококка (S. aureus)
- Факторы патогенности золотистого стафилококка (S. aureus)
- Биологические модели золотистого стафилококка (S. aureus)
- Клинические проявления инфекции золотистого стафилококка (S. aureus)
- Иммунитет при инфекции золотистого стафилококка (S. aureus)
