Качественные методы выявления бактериофага
а) Обнаружение бактериофага в жидкой питательной среде. Два сосуда (пробирки или колбы) с питательными средами засевают одной и той же культурой микроба, гомологичного искомому фагу. Одновременно с посевом или после 3-4-часового инкубирования в термостате в один из сосудов (опытный) вносят фильтрат исследуемого материала. Второй сосуд, содержащий питательную среду, засеянную культурой микробов, является контролем. Оба сосуда ставят в термостат при 37 °С и через 24 ч учитывают результаты.
При учете результатов возможны следующие варианты:
1. Содержимое опытного сосуда прозрачно, в контроле — помутнение питательной среды. Это указывает на содержание в исследуемом фильтрате бактериофага высокой активности.
2. В опытном сосуде имеется менее выраженное по сравнению с контролем помутнение среды. Это свидетельствует о содержании в исследуемом материале бактериофага средней активности.
3. При одинаковом помутнении в обоих сосудах для окончательного заключения об отсутствии бактериофага необходимо произвести дополнительное исследование: высев на плотную питательную среду содержимого опытной и контрольной пробирок. Высев делают на среду в чашки Петри шпателем, чтобы получить сплошной рост микробов. Чашки ставят в термостат и после 24 ч инкубирования при 37 °С учитывают результаты. Посев из контрольного сосуда дает сплошной рост микробов.
При наличии фага в исследуемом материале на фоне сплошного роста микробов появляются стерильные пятна — колонии бактериофага.
б) Обнаружение бактериофага на плотных питательных средах — спот-тест. Мясопептонный 1,5% агар разливают в чашки Петри (более высокая концентрация агара угнетает развитие негативных колоний бактериофага). Хорошо подсушенные чашки с агаром засевают 3-6-часовой бульонной культурой или смывом с суточной агаровой культуры бактерий, гомологичных искомому фагу.
Для получения сплошного роста 2-3 капли культуры, нанесенные в центр чашки, растирают шпателем равномерно по всей ее площади или аккуратно распределяют бульонную культуру (около 2 мл) по поверхности чашки, избыток удаляют пипеткой. Затем 30-40 мин подсушивают при 37 °С, накрыв стерильным бумажным фильтром. На подсушенную поверхность посева наносят каплями исследуемый фильтрат. На одной чашке можно поставить несколько проб. Для этого на дне чашки намечают разделение питательной среды на секторы и в каждый сектор вносят по капле фильтрата.
После того как жидкость впитается в среду, чашки перевертывают вверх дном и ставят в термостат при 37 °С на 18-24 ч.
Учет результатов: доказательством наличия бактериофага служит полное отсутствие роста культуры в месте попадания капли фильтрата (активный бактериофаг) или появление в этом участке мелких стерильных пятен — колоний бактериофага (бактериофаг слабой активности).
в) Обнаружение бактериофага на плотных питательных средах двухслойным методом Грациа. Мясопептонный 1,5% агар разливают в чашки Петри в количестве 25-30 мл (первый слой). После застудневания среды чашки ставят на 1,5-2 ч для подсыхания. В пробирку с 2,5 мл 0,7%-ного расплавленного и остуженного до температуры 45 °С агара вносят 1 мл исследуемого фильтрата и 0,1 мл густого смыва суточной агаровой культуры, соответствующей искомому фагу. Содержимое пробирок быстро перемешивают, чтобы не произошло застудневания агара и выливают в ту же чашку вторым слоем. После застудневания агара посев ставят в термостат при 37 °С.
Учет результатов, как правило, возможен через 18-20 ч инкубации в термостате. Присутствие бактериофага определяют по наличию прозрачных пятен, хорошо видимых на матовом фоне глубинного роста бактерий.
В соответствии с современной вирусологической практикой можно сформулировать общие принципы изолирования бактериофагов.
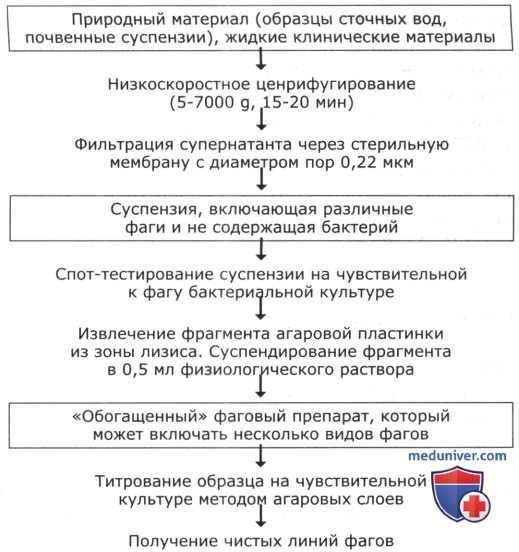
Прежде всего исследуемый образец необходимо перевести в жидкую форму. Пробы почв суспендируют в 0,1 М фосфатном буфере, pH 7,0. Для приготовления так называемых «почвенных болтушек» могут быть использованы и другие буферные растворы. Жидкие суспензии получают и на основе клинических материалов (испражнения, мокрота, выделения из дыхательных путей и т.д.). Полученную взвесь первоначально освобождают от крупных частиц и бактерий центрифугированием в низкоскоростном режиме (5000 g, 15-20 мин). Супернатант отделяют от осадка и фильтруют через мембраны с диаметром пор 0,22 мкм (популярны стерильные одноразовые мембранные фильтры, выпускаемые фирмой «Sartorius», Германия).
Следует подчеркнуть, что в отфильтрованных исследуемых образцах чаще всего содержится небольшое количество фагов. С учетом этого обстоятельства используют методы обогащения, один из которых—спот-тестирование. На поверхности твердой питательной среды производится посев соответствующей чувствительной бактериальной культуры (спот-тест). Далее в центральную часть посева наносится 10-15 микролитров фильтрата. Чашку инкубируют до появления видимого бактериального газона. Отсутствие роста культуры в месте нанесения исследуемого образца свидетельствуют о фаголизисе. Фрагмент агаровой пластинки из этой области стерильно переносят в 0,5 мл физиологического раствора.
Фаги быстро переходят (диффундируют) из пластинки в раствор. Полученный образец может содержать субпопуляции нескольких видов фагов. Суспензию титруют методом агаровых слоев. Чашки с пятнами лизиса используют далее для получения концентрированных препаратов отдельных видов бактериальных вирусов.
г) Получение чистых линий фага. Культуру индикаторного бактериального штамма инкубируют в жидкой питательной среде до экспоненциальной фазы роста. В полученную суспензию (30-50 мл) вносят фрагмент агаровой пластинки с единичным пятном лизиса. Извлечь пятно можно при помощи стерильной стеклянной трубочки с тонкими стенками. Трубкой прокалывают отдельное изолированное от других пятно на чашке. Далее материал переносят в бактериальную культуру выдуванием агаровой пробки. После этого систему инкубируют в течение суток в условиях, благоприятных для конкретной культуры. Полученный таким методом фаголизат содержит, как правило, фаги одного вида с высокой концентрацией (109-1010 БОЕ/мл).
- Читать далее "Количественные методы обнаружения бактериофага"
Редактор: Искандер Милевски. Дата публикации: 21.07.2019
- Бактериофаги: строение, морфология, взаимодействие с бактериями
- Методы выделения бактериофага из патологического материала и объектов внешней среды
- Качественные методы выявления бактериофага
- Количественные методы обнаружения бактериофага
- Электронная микроскопия бактериофага
- Применение бактериофагов: реакция нарастания титра фага
- Применение бактериофагов: фаготипирование бактерий
