Контроль качества оценки антибиотикочувствительности
Одновременно с выбором метода оценки антибиотикочувствительности необходимо планировать оценку качества исследования. Достоверность результатов исследования антибиотикочувствительности зависит от следующих основных параметров:
— состава питательной среды;
— соответствия реальной активности используемых в исследовании антибиотиков (или их содержания в дисках) паспортным характеристикам (активности);
— соблюдения стандартности при выполнении лабораторных процедур.
Контроль качества исследований антибиотикочувствительности основан на параллельной оценке клинических штаммов и контрольных (референтных). Референтные штаммы характеризуются генетической стабильностью по основным показателям, в том числе и по уровню чувствительности к антибиотикам. Если при исследовании чувствительности к антибиотикам референтных штаммов получены данные о величинах МПК или диаметрах зон ингибиции роста, соответствующие паспортным характеристикам этих штаммов, то это свидетельствует о стандартности условий постановки эксперимента.
Результаты оценки чувствительности клинических штаммов, полученные в этих условиях, следует признать достоверными.
Оптимальным является осуществление контроля качества при проведении каждого исследования. Однако на практике при получении достаточно стабильных результатов контроля качества в течение хотя бы одного месяца частота контрольных исследований может быть сокращена до 1-2 раз в неделю. Контрольные исследования необходимо проводить при использовании новых партий реагентов, прежде всего питательных сред.
Выбор референтных штаммов для проведения контрольных исследований определяется видом исследуемого микроорганизма. При контроле качества оценки антибиотикочувствительности отдельных групп микроорганизмов необходимо использовать следующие контрольные штаммы:
• Enterobacteriaceae — Е. coli АТСС 25922;
• Pseudomonas spp., Acinetobacter spp. и другие неферментирующие — Р. aeruginosa. АТСС 27853;
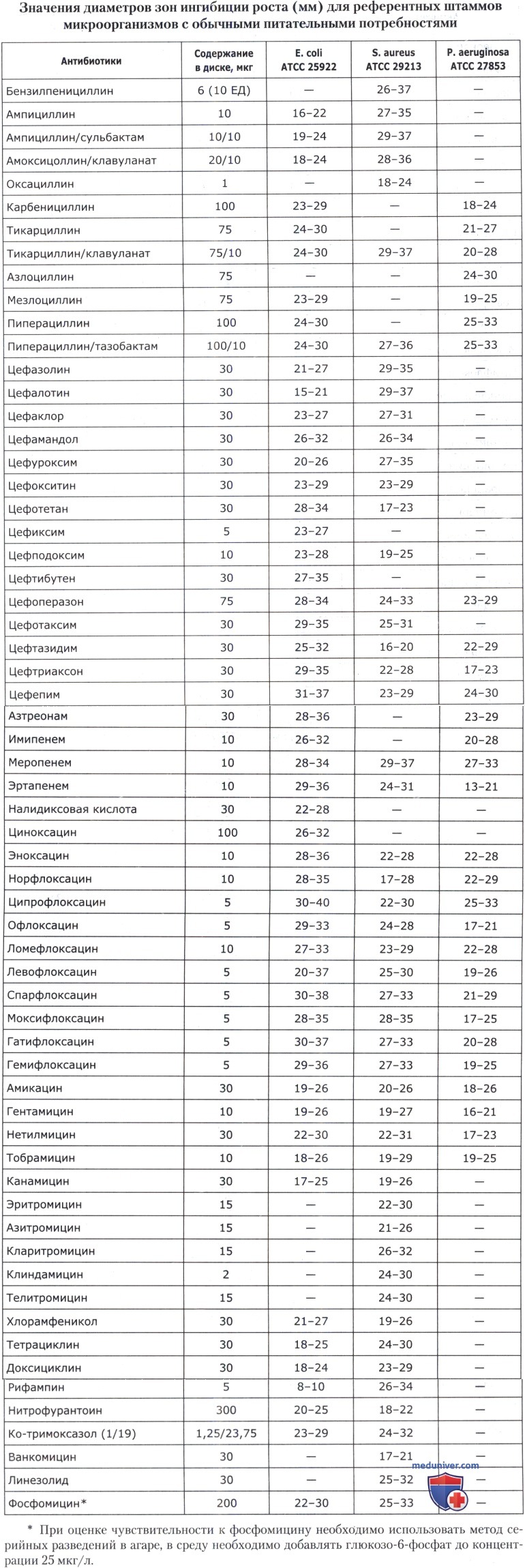
• Staphylococcus spp. — S. aureus АТСС 29213 (для методов серийных разведений) и АТСС 25923 (для диско-диффузионного метода);
• Enterococcus spp. — Е. faecalis АТСС 29212 — для метода серийных разведений и скрининга на высокий уровень резистентности к аминогликозидам; S. aureus АТСС 25923 —для диско-диффузионного;
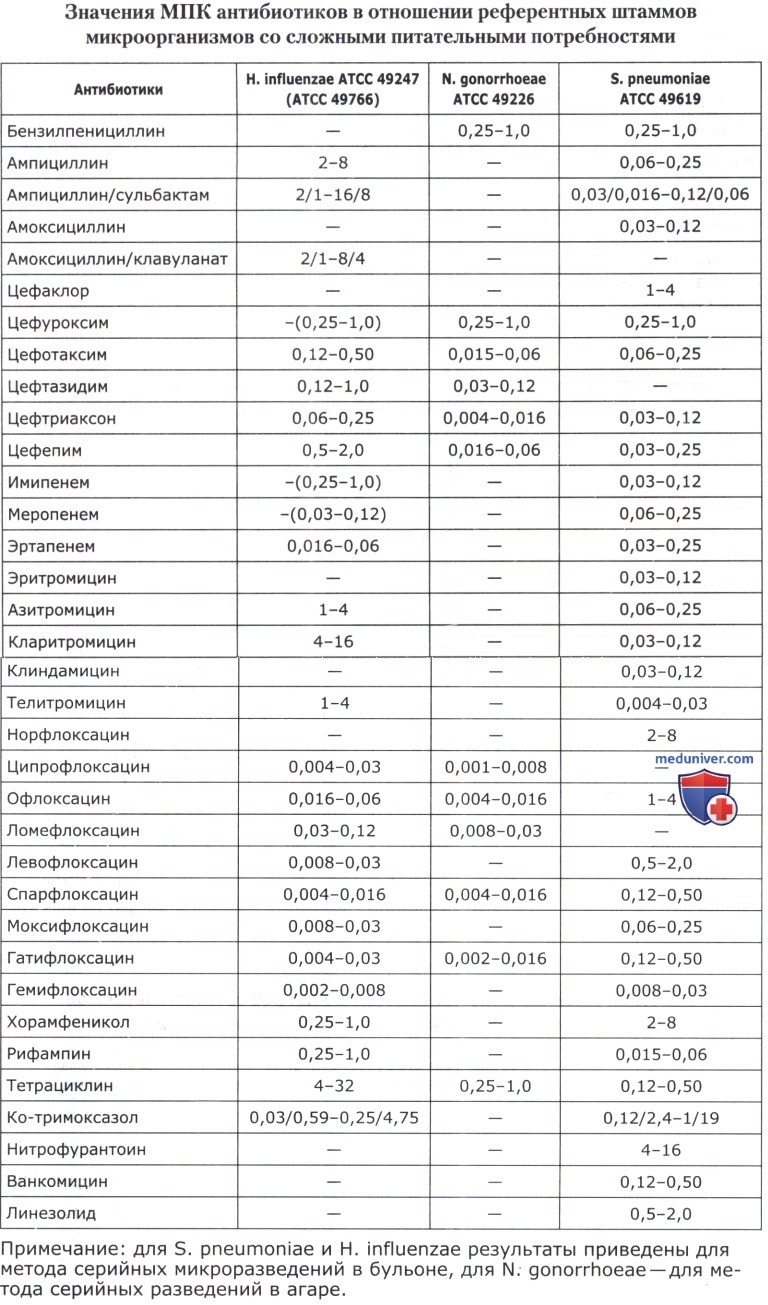
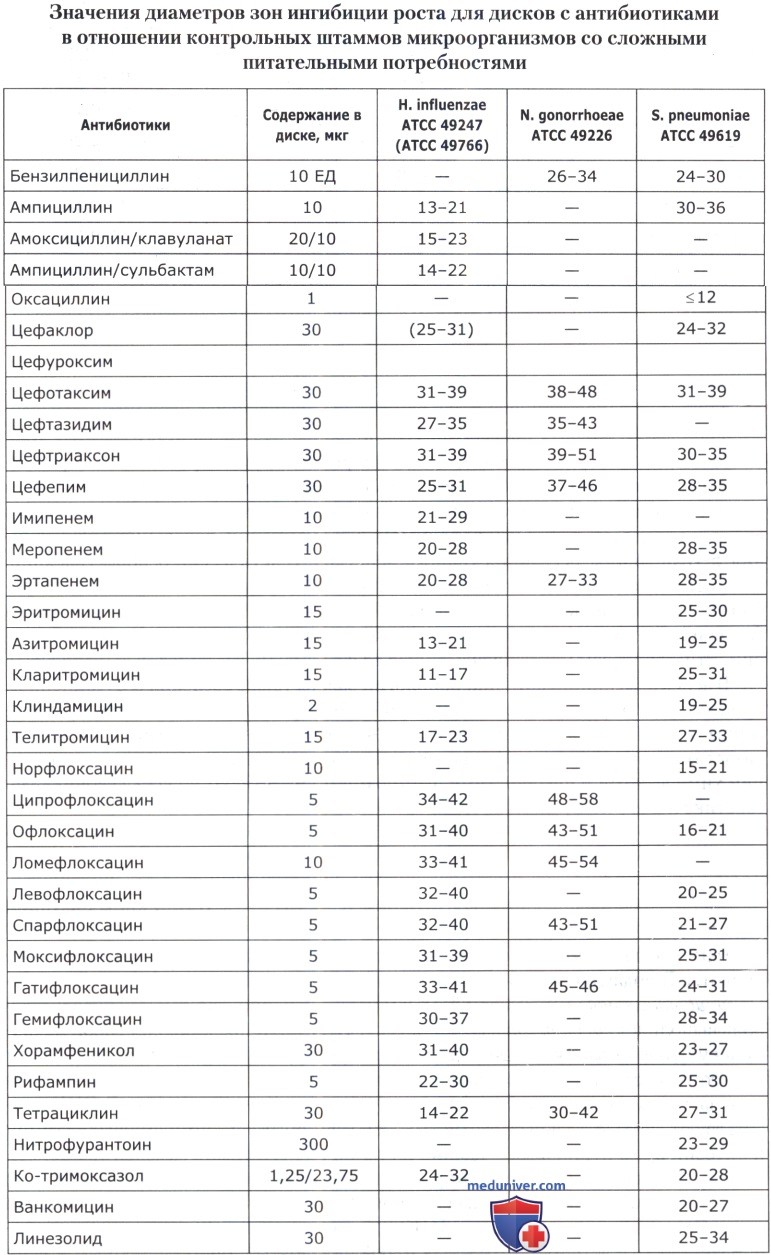
• Streptococcus spp. — S. pneumoniae АТСС 46619;
• Haemophilus spp. — H. influenzae ATCC 49247, H. influenzae ATCC 49766;
• Neisseria gonorrhoeae — N. gonorrhoeae ATCC 49266.
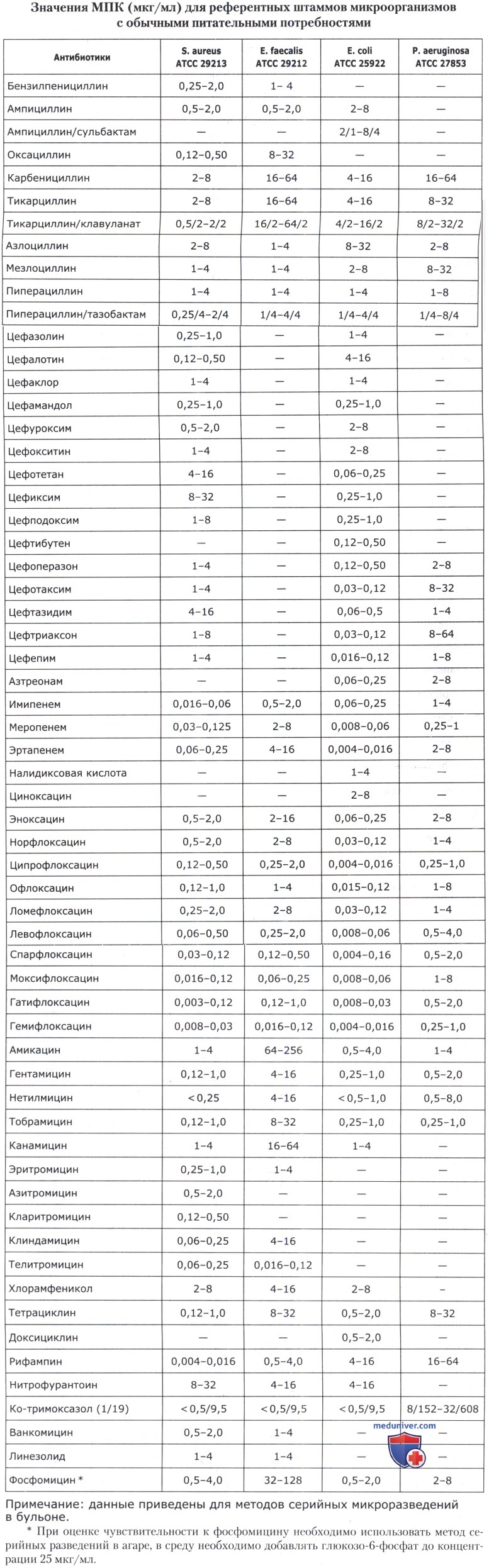
• Значения МПК антибиотиков и диаметры зон ингибиции роста для основных референтных штаммов представлены в таблицах ниже.
а) Контроль качества питательных сред. Качество питательной среды является одним из критических параметров для проведения корректной оценки антибиотикочувствительности. Важнейшим показателем качества питательной среды является концентрация двухвалентных катионов Са2+ и Mg2+, влияющих на активность аминогликозидных антибиотиков и тетрациклинов, которые являются антагонистами сульфаниламидных препаратов и триметоприма.
В международной практике основной средой, используемой во всех методах оценки антибиотикочувствительности, является среда Mueller-Hinton (бульон и агар), содержащая ионы Са++ в концентрации 20-25 мкг/мл, a Mg++ —в концентрации 10-12,5 мкг/мл. Рассматриваемые в последующих разделах критерии величины МПК, позволяющие отнести исследуемые микроорганизмы к одной из следующих категорий — «чувствительные», «устойчивые» или «промежуточные», разработаны именно для среды Mueller-Hinton.
Для оценки антибиотикочувствительности можно использовать и другие среды, но только в том случае, если они удовлетворяют описанным ниже требованиям. В этом случае можно применить критерии чувствительности, разработанные для среды Mueller-Hinton. Перед использованием в экспериментах по оценке антибиотикочувствительности каждая новая партия среды (Mueller-Hinton или какой-либо другой) должна пройти контроль на соответствие требуемым параметрам pH и катионного состава.
б) Определение pH среды. Определение pH среды проводят после автоклавирования, внесения всех необходимых добавок и охлаждения до комнатной температуры (25 °С). Приемлемый диапазон — 7,2-7,4. При pH среды, выходящем за указанные пределы, возможны существенные изменения МПК.
в) Контроль катионного состава. Для получения воспроизводимых результатов оценки антибиотикочувствительности питательная среда должна содержать Са2+ 20-25 мг/мл и Mg2+10-12,5 мг/мл. Применение метода атомной абсорбционной спектрофотометрии для непосредственной оценки концентрации двухвалентных катионов в среде в повседневной практике не реально. Наиболее доступным интегральным методом оценки качества сред (как жидких, так и агаризованных) является сопоставление экспериментально полученной МПК референтных штаммов микроорганизмов с этим показателем, приведенным в их паспортной характеристике. Наиболее подходящим штаммом для оценки качества жидких и плотных питательных сред, предназначенных для изучения антибиотикочувствительности, является штамм Pseudomonas aeruginosa АТСС 27853.
Среду следует считать удовлетворительной по качеству, если МПК гентамицина находится в пределах 0,5-2,0 мкг/мл. Выбор гентамицина для контроля качества связан с тем, что аминогликозидные антибиотики наиболее чувствительны к колебаниям концентрации двухвалентных катионов. Для контроля на наличие антагонистов сульфаниламидных препаратов и триметоприма рекомендуется использовать штамм Enterococcus faecalis АТСС 29212. При МПК триметоприма/сульфаметоксазола <0,5/9,5 мкг/мл среду следует признать удовлетворительной по качеству.
Определение МПК антибиотиков (или диаметров зон ингибиции роста) в отношении референтных штаммов с целью контроля качества среды проводят в соответствии с описанными выше методами. Категорическим требованием является использование антибиотиков с предварительно известной активностью.
- Читать далее "Геном бактерий - строение бактериальной ДНК"
Редактор: Искандер Милевски. Дата публикации: 11.07.2019
