Определение степени микробной обсемененности различных биоматериалов
а) Оценка качества питательных сред. Для этих целей в лунки планшета с исследуемой питательной средой вносят 10-кратные разведения (от 108 до 101) различных микроорганизмов и проводят динамическое измерение. Качество питательной среды определяется максимальным разведением культуры, в котором удается проследить рост микроорганизмов, а также величиной приращения оптической плотности.
Питательную среду можно считать пригодной для проведения экспериментов в том случае, если регистрируется рост даже прихотливых микроорганизмов (например, стрептококков) в разведении 101-102 микроорганизмов в 1 мл.
Данная методика позволяет подобрать жидкие питательные среды для проведения всех исследований, связанных с кинетикой размножения микроорганизмов.
б) Определение степени микробной обсемененности различных биоматериалов. Алгоритм обработки кривых роста для выявления степени обсемененности мочи перерабатывался минимум 4 раза: от первоначального, рассчитанного только на скрининг мочи здоровых людей для выявления скрытой патологии до последнего варианта, в котором алгоритмы расчета основаны на логистическом анализе. Данный алгоритм удалось сделать единым для расчета степени обсемененности любых биоматериалов.
1. Методика пробоподготовки для определения степени микробной обсемененности мочи. В стандартном 96-луночном планшете одновременно можно проанализировать 31 пробу мочи (моча определена как жидкий биосубстрат). Для исследования одной пробы мочи используют три ячейки в строке планшета, в которые вносится неразведенная моча и ее разведения. Титрование мочи проводят непосредственно в планшете методом «из ячейки в ячейку». Для этого во все используемые ячейки вносится по 200 мкл стандартного бульона Мюллер-Хинтона (Oxoid, Merck, Becton Dickinson, Sifin и др.), после чего в первую ячейку добавляется 22 мкл исследуемой мочи (разведение 1:10).
После смены наконечника и тщательного перемешивания 22 мкл содержимого первой ячейки переносится во вторую ячейку (разведение 1:100), из которой после смены наконечника и перемешивания 22 мкл содержимого переносится в третью ячейку (разведение 1:1000). В обязательном порядке три ячейки планшета заполняют стерильным бульоном для контроля его стерильности и определения оптических характеристик.
2. Методика пробоподготовки для определения степени обсемененности ран и других биосубстратов:
- Жидкие биосубстраты (экссудаты, пунктаты, выпоты, транссудаты, раневое отделяемое и т. д.) титруют в планшете аналогично моче. Очень вязкие пробы биоматериалов (с большим количеством взвешенных частиц, значительной примесью крови и т. п.) рекомендуется предварительно разводить в соотношении 1:10 стерильным физиологическим раствором (0,9 % раствор NaCl) и это разведение использовать далее для титрования в планшете аналогично моче. В обоих случаях программа «МИКРОБ-АВТОМАТ» производит расчет числа КОЕ в 1 см3 испытуемого биосубстрата.
Для получения четкого результата пробы биоматериала, взятые на фоне антибактериальной терапии, во всех случаях желательно разводить 1:10 стерильным физиологическим раствором.
- Тканевые биоптаты. Взвесить биоптат в асептических условиях и растереть в стерильной фарфоровой ступке с кварцевым песком и добавлением стерильного физиологического раствора в соотношении 1:10 к массе биоптата. Для титрования в планшете использовать надосадочную жидкость. Титрование проводить аналогично титрованию мочи. Программа производит расчет числа КОЕ в 1 г биоптата.
- Раневые поверхности. На раневую поверхность на 5 мин наложить слегка смоченную физиологическим раствором стерильную марлевую (10 слоев) салфетку площадью 25 см2. После чего салфетку доставить в лабораторию в стерильной чашке Петри. Салфетку с раневым отделяемым поместить во флакон с 50 мл стерильного физиологического раствора и отмыть в шюттель-аппарате в течение 30 мин. Для титрования в планшете используют отмывную жидкость. Титрование проводят аналогично титрованию мочи. Программа производит расчет числа КОЕ на 1 см2 раневой поверхности.
Для измерения кривых роста необходимо загрузить тест для измерения кривых роста через команду основного меню «Загрузить тест...». Порядок действий аналогичен порядку загрузки тестов для суспензий, описанному выше.
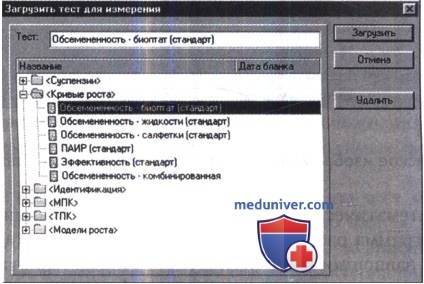
В зависимости от исследуемого материала загружается определенный тест: «Обсемененность — жидкости» — для получения результата по обсемененности мочи, неразведенных проб жидких субстратов (раневого отделяемого, пунктатов, экссудатов и других биологических жидкостей); «Обсемененность —биоптат» —для количественных определений в биоптатах и пробах субстратов, разведенных в 10 раз; «Обсемененность—салфетки» — для количественных определений обсемененности раневых поверхностей на 1 см2. Кроме стандартных, система позволяет составить комбинированную конфигурацию, в которой будут представлены все перечисленные биологические материалы.
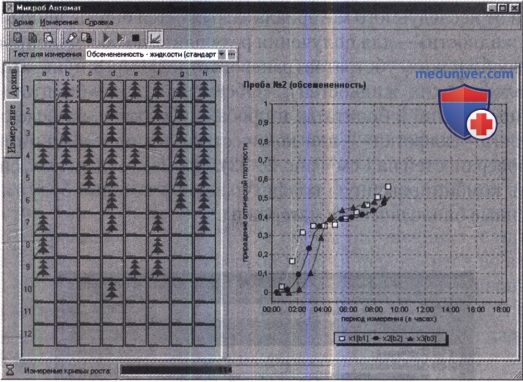
В процессе измерений на экране монитора слева появляются «елочки» — указание на вступление микроорганизмов в фазу логарифмического роста и количество микробных тел в каждой лунке планшета. Одновременно в экранной форме справа можно просмотреть кривые роста микроорганизмов в каждой пробе.
Нами установлено, что показатель времени вступления микроорганизмов в фазу логарифмического роста четко коррелирует с исходным количеством микроорганизмов в любом биосубстрате. При исходной обсемененности 108-109 микрооганизмов в 1 мл время вступления в фазу экспоненциального роста равняется 15-30 мин, при обсемененности 105 для большинства быстрорастущих микроорганизмов это время составляет 3-4 ч. Ориентируясь на этот показатель, пробы, высокообсемененные быстро растущими микроорганизмами, можно выявить в течение 4-5 ч.
Делают высев всех проб секторами на твердые питательные среды для получения чистой культуры с тем, чтобы на следующий день уже была возможность провести идентификацию выделенных культур и определить их анти-биотикочувствительность.
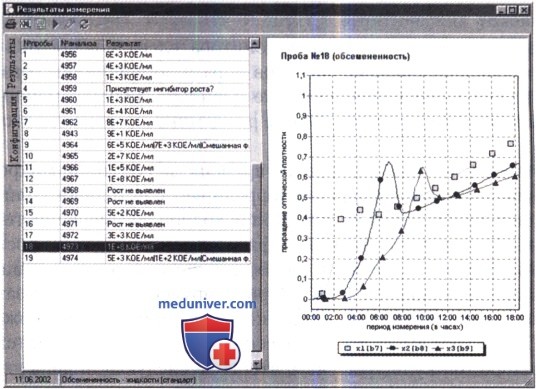
В результате математической обработки результатов динамических измерений в течение 18 ч программа рассчитывает количество микроорганизмов в пересчете на 1мл/г/ см2 в зависимости от исследуемого биоматериала (левая половина рисунка) и рисует кривые роста по каждой пробе (правая половина рисунка). На рисунке ниже в качестве примера приведены результаты определения микробной обсемененности проб мочи.
Данный метод позволяет обследовать большое число больных с низкими материальными и трудовыми затратами по сравнению с традиционными количественными и полуколичественными методами. Получаемое при этом точное количество микроорганизмов может служить тестом для проведения мониторинга эффективности проводимой антибактериальной терапии.

3. Лабораторный контроль эффективности проводимой антибактериальной терапии. Для оценки адекватности проводимой терапии и в случае необходимости ее корректировки предложена простая методика, по информативности равноценная двум трудно выполнимым исследованиям: определение концентраций антибактериальных препаратов в патологическом очаге и определение МПК применяемых препаратов в отношении выявленного возбудителя. Для выполнения данного исследования проводятся кинетические измерения роста интактных микроорганизмов, выделенных у конкретного больного, в жидкой питательной среде и в той же среде, но с добавлением сыворотки крови больного или другого биоматериала в зависимости от нозологии гнойно-септического осложнения или заболевания, взятых на максимуме и минимуме концентраций вводимых ему антибактериальных препаратов.
Для измерения кривых роста необходимо загрузить тест для измерения кривых роста через команду основного меню «Загрузить тест...». Порядок действий аналогичен порядку загрузки тестов для суспензий, описанному выше. Для получения результата по контролю эффективности антибактериальной терапии в меню программы необходимо выбрать тест «Эффективность» и загрузить его.
Для каждого больного должно быть минимум 3 лунки в планшете, условно обозначаемые как: «ЭК» — кинетика роста аутоштамма больного в питательном бульоне, «Э+» — кинетика роста аутоштамма в бульоне с сывороткой крови, взятой на максимуме концентрации препарата, «Э-» — кинетика роста аутоштамма в бульоне с сывороткой крови, взятой на минимуме концентрации препарата, т. е. перед очередным введением препарата. В результате математической обработки результатов динамических измерений в течение 18 ч программа рассчитывает процент подавления сывороткой крови больного роста аутоштамма больного.
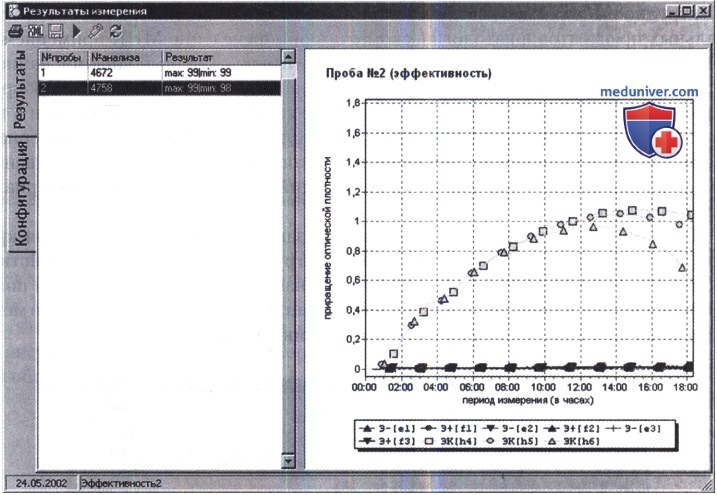
В приведенных ниже примерах у больных из крови был выделен S. aureus, устойчивый к оксациллину и чувствительный к ванкомицину. В качестве контроля использовали аутоштамм S. aureus, выделенный у каждого больного. В опытные лунки к суспензии данного микроорганизма (108 микробных тел/мл) добавляли по 0,05 мл сыворотки крови больных, взятой на максимуме концентрации препарата (после окончания внутривенной инфузии) и на минимуме концентрации (перед очередным введением препарата). Программа рассчитала процент подавления роста микроорганизмов сывороткой крови больного по сравнению с контролем и выдала готовый бланк анализа.
Как следует из рисунка ниже, у двух больных, которым на 3-й день лечения ванкомицином (500 мг 3 раза в сутки внутривенно капельно) осуществлен контроль проводимой антибактериальной терапии, который показал, что и на максимуме, и на минимуме концентраций антибиотика подавление роста составляло 98-99% по сравнению с контролем, при этом выявлена корреляция с наблюдаемой клинической эффективностью,
У третьего больного при проведении контроля эффективности на 5-е сутки после выделения S. aureus и начала лечения ванкомицином (1г 2 раза в сутки внутривенно капельно) на максимуме концентрации процент подавления роста по сравнению с контролем составлял 98%, на минимуме — 86%, клинический эффект в момент исследования был недостаточно выражен. Таким образом, в данном случае результаты, полученные при моделировании процесса in vivo, коррелируют с отсутствием клинического эффекта, что связано с нарушением режима введения препарата: повторная инъекция была сделана через 16, а не через 12 ч.
Накопленный нами опыт проведения этих исследований позволил сделать следующий вывод. Если процент угнетения роста составляет на максимуме и минимуме концентраций 98-100%, антибактериальную терапию следует считать эффективной; отсутствие подавления роста в обеих пробах — ошибка в определении антибиотикочувствительности или в определении этиологического агента; в случае, когда на максимуме концентраций отмечается полное подавление роста, а на минимуме оно составляет менее 98%, нужно сократить интервал между введениями антибиотиков. Тест очень информативен и с успехом используется в ряде клиник для контроля эффективности проводимой антибактериальной терапии. Мы присоединяемся к мнению ряда авторов, которые считают, что этот метод следует называть «Определение антибиотикорезистентности in vivo».
Программа предназначена для работы на персональном компьютере под управлением ОС «Windows 2000/ХР» и поэтому она более органично связана с другой программой «Система микробиологического мониторинга «МИКРОБ-2». Они могут работать одновременно, что позволяет при проведении динамических измерений получать сведения о высокообсемененных пробах различных биоматериалов в течение рабочего дня.
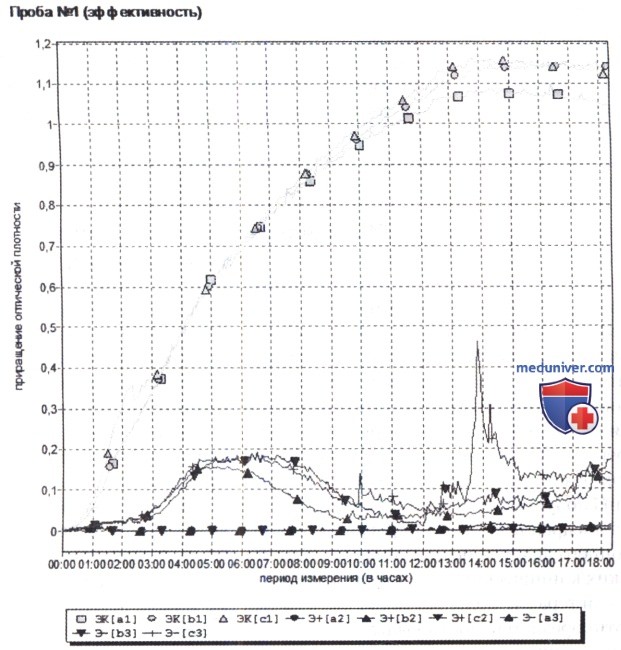
«ЭК» — рост S. aureus в контроле; «Э+» — рост S. aureus при добавлении сыворотки крови на максимуме концентрации ванкомицина; «Э-» — на минимуме концентрации ванкомицина.
- Читать далее "Система регистрации и анализа в работе микробиологических лабораторий"
Редактор: Искандер Милевски. Дата публикации: 6.09.2019
- Определение степени микробной обсемененности различных биоматериалов
- Система регистрации и анализа в работе микробиологических лабораторий
- Бланк-заключение результата исследования биоматериала
- Статистический анализ результатов исследования биоматериала
- Эпидемиологический отчет исследования результатов биоматериала
- Пакеты программ для микробиологических лабораторий
