Роды бактерий Bacteroides (сем. Bacteroidaceae), Tannerella, Porphyromonas (сем. Porphyromonadaceae), Prevotella (сем. Prevotellaceae)
Бактероиды — это группа грамотрицательных анаэробных бактерий, которых в настоящее время насчитывают свыше 50 видов, объединенных в четыре основных рода: Prevotella (18 видов), Porphyromonas (12 видов), Tannerella и собственно Bacteroides (более 20 видов). В настоящее время в эту группу объединяют мелкие грамнегативные палочки, овоиды и коккобактерии, не образующие спор. Полиморфны. Не имеют жгутиков, неподвижны.
Из рода Bacteroides в 90-е гг. XX века были выделены три новых рода. Род Prevotella назван в честь A. R. Prevot, род Tannerella — в честь Anne С. R. Tanner за ее вклад в изучение возбудителей заболеваний пародонта (Forsyth — институт в Бостоне, США, в котором впервые выделен пародонтопатогенный вид Tannerella forsythia). Название третьего рода — Porphyromonas определяется способностью черных пигментированных колоний возбудителя к флюоресценции в ультрафиолетовом свете.
В полости рта встречаются пигментообразующие и непигментированные виды бактероидов, относящиеся в основном к родам Prevotella (Р. melaninogenica, Р. nigrescens, Р. intennedia, Р. heparinolytica), Potphyromonas (Porphyromonas gingivalis) н T. forsythia.
В бронхиальном дереве, урогенитальном тракте и, особенно, в толстой кишке типичными обитателями являются представители собственно рода Bacteroides — В. fragilis, В. ruminicola, В. thetaiotaomicron, В. uniformis, которые, благодаря наличию бета-лактамаз нескольких типов и других механизмов резистентности, являются наиболее устойчивыми к антибиотикам.
Строгие (облигатные) анаэробы. Продуцируют разнообразные жирные кислоты, что используется при идентификации родов и видов. На питательных средах дают мелкие, выпуклые, округлые и гладкие колонии. Представители кишечной группы — В. fragilis устойчивы к действию желчи.
Для роста обязательными компонентами являются гемолизированная кровь и факторы роста — гемин, менадион (витамин К). Некоторые виды обладают гемолитической активностью. Выраженную зону гемолиза на 5 %-м гемин-агаре с кровью дает, например, Potphyromonas gingivalis. Бактерии данной группы in vitro продуцируют различные ферменты агрессии: коллагеназу, гиалуронидазу, хондроитинсульфатазу, гепариназу, IgA-, IgG-, IgM-протеазы, что позволяет рассматривать их как важнейших потенциальных возбудителей эндогенной инфекции.
Выделяются при разнообразных воспалительных процессах челюстно-лицевой области, чаще в ассоциации с анаэробными кокками (пептострептококки, вейлонеллы), фузобактериями, стрепто- и стафилококками. Встречаются в монокультурах при разнообразных гнойных процессах, эндокардитах, бактериемии и одонтогенном сепсисе. Бактероиды, как правило, являются доминирующей флорой в гнойном экссудате при абсцессах, флегмонах, остеомиелитах челюстно-лицевой области, содержимом пародонтального кармана при пародонтите и гингивите. При инвазии в ткани пародонта они обычно окружены капсульным слоем.
В последние годы настороженность клиницистов вызывает появление штаммов бактероидов с множественной резистентностью к метронидазолу, пеннциллинам, тетрациклинам, цефалоспоринам и клиндамицину.
Основные виды: Bacteroides fragilis, Potphyromonas gingivalis, Prevotella intermedia/nigrescens, Tannerella forsythia. Последние три вида включены ВОЗ в перечень так называемых пародонтопатогенных видов бактерий. Наряду с актинобациллами и Treponema denticola, их относят к основным возбудителям пародонтального воспаления — возбудителям первого порядка.
а) Porphyromonas gingivalis (десневая порфиромонада). Porphyromonas gingivalis (др.-греч. [порфю’рэос] — багряный; [монас] — единица, штука; лат. gingiva — десна) — один из основных пародонтопатогенных видов (первого порядка), способный к экзогенной передаче, инвазии и внутриклеточному паразитизму.
Факторы патогенности. Р. gingivalis вырабатывает множество различных протеиназ. Их основная функция — обеспечение растущей клетки пептидами, но ввиду способности разрушать белки хозяина (в том числе несущие защитную функцию) им приписывают роль основных факторов вирулентности:
• аргинин- и лизин-специфичные цистеиновые протеиназы или гингипаины R и К (их синтез кодируют 3 гена: rgpA. кодирует аргинпн-специфичную протеи-назу RgpA, имеющую домены адгезина/гемагглютинина, генетическая информация которых заключена в последовательности hag, rgpB — протеиназу RgpB; kgp — лизин-специфичную протеиназу Kgp, имеющую домены адгезина/гемагглютинина (последовательность hag),
• цистеиновые протеиназы, получаемые из продуктов гена prtT,— стрептопаин-подобная протеаза и периодонтаин — фермент, расщепляющий и инактивирующий ингибитор протеиназы (на С-концевом участке гена p?tT есть также область кодирования гемагглютинирующей активности, не сходная с областью hag гингииаинов). Ген tpr кодирует синтез Pz-пептидазы — фермента, напоминающего папаин. Он связан с бактериальной поверхностью и имеет широкий спектр активности — не действует на природный коллаген, но может гидролизовать желатин и Pz-пептид, что позволяет предположить его участие на поздних стадиях деградации коллагена.
• аминопептидазы, эндотелин-превращающая ферментоподобная эндопептидаза и пролилдипептидил-пептидаза IV (помимо участия в питании протеиназы имеют ряд биологических свойств, потенциально способствующих развитию заболевания) — таблица ниже.
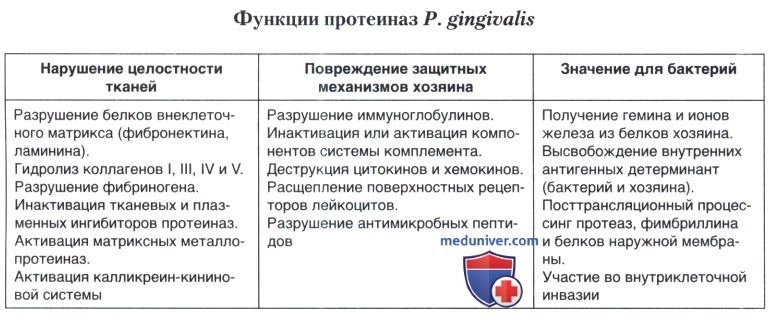
Связь бактерий с рецепторами клеток хозяина и последующую колонизацию могут обеспечивать поверхностные адгезины и гемагглютинины. У многих бактерий, включая Р. gingivalis, их рассматривают в качестве факторов патогенности.
Гемагглютинирующая активность Р. gingivalis определяется:
• фимбриями;
• липополисахаридом (ЛПС) клеточной стенки;
• липидом на поверхности клетки;
• соответствующими доменами протеаз;
• молекулами специфических протеинов HagA, HagB и HagC. HagA — крупный белок с молекулярной массой 230 kDa, содержащий 4 блока смежных прямых 440-и 456-аминокислотных повторов; белки HagB и HagC очень похожи и имеют молекулярную массу 40 kDa.
Все адгезины участвуют в прикреплении Р. gingivalis к клеткам хозяина, например, эпителиоцитам или эритроцитам. В связывании могут участвовать также поверхностно расположенные протеазы. Установлено, что у Р. gingivalis образование фимбрий, факторов адгезии, гемагглютинации и протеолиза тесно связано, что подтверждается исследованиями генома — в частности, генов протеинов HagA, HagB и HagC. По-видимому, этот сложный комплекс факторов важен для роста бактерий и проявления патогенности.
Следующий фактор патогенности — липополисахарид (ЛПС) у Р. gingivalis не содержит гептоз (или содержит их очень мало), его жирные кислоты более длинные и разветвленные и он менее токсичен, по сравнению с ЛПС энтеробактерий. Биологические отличия ЛПС этих бактерий, по-видимому, отражают несходство их химической структуры, что, в свою очередь, обусловлено разной ролью этих структур в патогенезе. ЛПС Р. gingivalis не стимулирует экспрессию эндотелиальными клетками Е-селектина, а подавляет его экспрессию, стимулируемую ЛПС других бактерий. По сравнению с Escherichia coli, микроб является слабым активатором ИЛ-1β и ФНО-α моноцитов (эти цитокины являются непрямыми активаторами экспрессии селектинов человека). На модели раннего воспаления у мышей показано, что ЛПС Р. gingivalis слабее, чем эндотоксин Е. coli, индуцирует цитокины фибробластов, Е- и Р-селектины, белок 1 хемотаксиса моноцитов.
Поверхность Р. gingivalis покрыта перитрихиальными фимбриями. На основе генов fimA, кодирующих субъединицу фимбрий FimA, выделяют 6 типов фимбрий, играющих ключевую роль во взаимодействии бактерий с тканями хозяина. Под электронным микроскопом различают 2 типа фимбрий, но встречаются и другие структуры. Так называемые главные фимбрии (они варьируют по длине от 0,3 до 3,0 мкм, по ширине — от 3 до 5 нм) состоят из субъединиц фибриллина массой ~ 45 kDa (FimA). Длинные фимбрии Р. gingivalis проявляют гомологию с фимбриальными доменами бактерий других видов. Короткие фимбрии встречаются реже и состоят из белка массой 67 kDa.
В опытах in vitro показана потенциальная роль фимбрий в адгезии, колонизации и деструкции тканей пародонта. Многочисленные исследования in vivo указывают на важную роль фимбрий при развитии инфекционного процесса. Например, предварительная иммунизация крыс очищенными фимбриями (FimA) или заражение мутантным штаммом без длинных фимбрий защищает животных от индуцируемой Р. gingivalis деструкции костной ткани. Кроме того, выпячивания наружной мембраны клеток образуют пузырьки, которые участвуют в связывании Р. gingivalis с эритроцитами, другими бактериями и поверхностью гидроксиапатита, агрегируют тромбоциты. На поверхности везикул Р. gingivalis находятся фимбрии. Предполагают, что адгезивные микропузырьки могут адресно доставлять факторы патогенности (токсины, протеазы) к клеткам-мишеням; их малые размеры позволяют проникать в места, недоступные целой клетке.
Наличие капсул у Р. gingivalis коррелирует с патогенностью для лабораторных животных. Так как инкапсулированные штаммы плохо фагоцитируются, капсулу считают важным фактором патогенности. Различают 6 сероваров капсул Р. gingivalis. Вирулентность бактерий различается в зависимости от серотипа капсулы. Полисахаридный слой на поверхности этих микробов может скрывать ЛПС, изменяя тем самым его активность.
Основные клинические синдромы; гингивит, пародонтит, абсцессы и флегмоны, инфекционный эндокардит. Развитие заболевания происходит вследствие контакта бактерий, колонизирующих поддесневую зубную бляшку с тканями десны и их последующего внедрения в ткань — инвазии. После колонизации слизистой оболочки Р. gingivalis преодолевают эпителиальный барьер и обнаруживаются в десневой ткани. Безусловным показателем вирулентности Р. gingivalis следует считать то, что они могут внедряться в эпителиоциты и размножаться внутриклеточно. При контакте с эпителиальными клетками Р. gingivalis индуцируют стрессорные метаболические процессы (увеличение реактивности на окислительный стресс и экспрессии генов белков теплового шока), что способствует выживаемости бактерий.
Инвазия является результатом взаимодействия главных фимбрий микроба с интегринами на поверхности эпителиоцитов. Это взаимодействие активирует сигнальную систему, что ведет к цитоскелетной перестройке клетки и погружению в нее прилипшей бактерии. Сигнальный путь включает изменение внутриклеточных концентраций ионов кальция и модулирование митоген-активируемых протеинкиназных каскадов эукариотической клетки. Этот процесс получил название интернализации. Он занимает несколько минут, и вскоре в перинуклеарном пространстве клетки накапливается множество бактерий.
При воспалении и кровотечении, сопровождающих инвазию соединительной ткани десны, бактерии полости рта могут поступать в кровоток (бактериемия) и формировать отдаленные очаги инфекции. Этот факт лежит в основе популярной гипотезы о связи заболеваний пародонта и сердечно-сосудистой системы (инфекционный эндокардит). Во всяком случае, установлена связь развития атеросклеротических бляшек с пародонтопатогенными бактериями, включая Р. gingivalis, подтвержденная результатами опытов in vitro по адгезии и инвазии бактерий в эндотелий коронарных артерий человека и аорты крупного рогатого скота.
Инвазия эндотелия Р. gingivalis сопряжена с атерогенным процессом; при этом стимулируются провоспалительные цитокины и молекулы клеточной адгезии — факторы, участвующие в патогенезе ишемической болезни сердца и стенокардии. Подобно инвазии эпителиоцитов, для проникновения в эндотелиальные клетки Р. gingivalis использует главные фимбрии. После обработки клеток Р. gingivalis амилоглюкозидазой, разрушающей полисахаридную капсулу, интенсивность инвазии еще более возрастает. Известно, что капсула препятствует взаимодействию некоторых бактерий с эпителиальными и эндотелиальными клетками. По-видимому, ферментная обработка высвобождает дополнительные адгезины. Внутри эндотелия Р. gingivalis остается в аутофагосоме, которая не сливается с лизосомами, что позволяет микробу избежать гибели.
Р. gingivalis может и активировать, и подавлять неспецифический воспалительный ответ хозяина. Клетки микроба и их компоненты индуцируют экспрессию различных цитокинов и хемокинов. Это ведет к появлению стимулированных ПЯЛ, моноцитов/макрофагов, фибробластов и эпителиоцитов. Такие цитокины, как ИЛ-1β, ФНО-а, ИЛ-6 и ИЛ-8, способствуют воспалению и деструкции тканей, включая костную. В опытах in vitro главные фимбрии стимулируют костные клетки к выработке ИЛ-1β и гранулоцитарно-макрофагального колониестимулирующего фактора, а фибробласты, макрофаги и моноциты — к выработке медиаторов костной резорбции (ИЛ-1β и ФНО-α). Другие цитокины (ИЛ-1α, ИЛ-4), напротив, препятствуют воспалению — разрушают имеющиеся цитокины и нарушают продукцию ИЛ-8 эпителиоцитами.
б) Tannerella forsythia (старое название Bacteroides forsythus). Tannerella forsythia — один из пародонтопатогенных видов (первого порядка), способный к инвазии и синтезу токсинов.
Род Tannerella назван по имени американского микробиолога Anne C.R. Tanner за ее вклад в изучение заболеваний пародонта.
Факторы патогенности. Ввиду высоких потребностей в питательных веществах (нуждается в производном пептидогликанового каркаса) микроб трудно культивировать, поэтому он изучен недостаточно. Известно лишь несколько предполагаемых факторов патогенности Т. forsythia, однако имеется ряд немногочисленных подтверждений передачи от человека к человеку в качестве экзогенного возбудителя. Прежде всего, Т. forsythia образует трипсиноподобные протеазы — аргинин-специфичную цистеиновую протеазу и сиалидазу. Цистеиновая протеаза обладает также гемолитической активностью; она обнаруживается в мембранных фракциях микроба, что может указывать на ее участие в приобретении железа из эритроцитов.
В связывании Т. forsythia с фибронектином и фибриногеном участвует BspA — поверхностный антиген с богатыми лейцином повторами. Т. forsythia может прикрепляться также к эритроцитам, фибробластам и лейкоцитам. При участии белково-белковых взаимодействий Т. forsythia коагрегирует с Р. gingivalis, причем процесс подавляется сывороткой крови. Возможна коагрегация и с S. cristatus — комменсальным стрептококком бляшки.
Основные клинические синдромы: гингивит, пародонтит, абсцессы и флегмоны.
в) Prevotella intermedia (превотелла средняя). Prevotella intermedia — один из пародонтопатогенных видов (второго порядка), способный к инвазии и синтезу токсинов.
Род Prevotella назван в честь французского микробиолога A. R. Prevot, пионера в области анаэробного культивирования микробов; латинское прилагательное intermedius означает «находящийся посреди, между».
Факторы патогенности. Для Р. intermedia характерна гидролитическая, в т.ч. протеолитическая, активность. Выраженность этих свойств зависит от штамма. Цистеиновые протеазы Р. intermedia отщепляют CD14 и липополисахарид-связывающий белок (LBP), модулируя тем самым вирулентность Л ПС. В дозозависимой манере они снижают экспрессию IL-16-специфической мРНК на активированных ЛПС макрофагоподобных клетках U937 и ТНР-1. Хотя эти свойства подробно не изучены, они могут играть важную роль в развитии инфекционного процесса с участием Р. intermedia. Р. intermedia могут агглютинировать эритроциты, причем термолабильная агглютинация может быть обусловлена главными фимбриями, а термостабильная — ЛПС-подобными структурами.
Р. intermedia обычно образуют фимбрии, диаметр и расположение которых зависят от штамма. Есть штаммы, у которых фимбрии вовсе отсутствуют. У некоторых штаммов все фимбрии имеют один и тот же диаметр. У других — фимбрии нескольких разных диаметров. По последнему признаку различают 4 типа фимбрий — А, В, С и D.
Связанные с поверхностью Р. intermedia везикулы наружной мембраны обладают термолабильной гемолитической активностыо. По-видимому, она обусловлена многокомпонентным гемолизином, существующим как минимум в двух функциональных формах.
Возбудитель активно взаимодействует с другими микроорганизмами, образуя биопленки, в том числе, путем коагрегации. Коагрегация Р. intermedia — высоко специфичный процесс. Определенные штаммы коагрегируют только с отдельными видами Actinomyces, так как некоторые структуры микроба видоспецифичны по отношению к актиномицетам. В коагрегации участвуют поверхностный белок или гликопротеин Р. intermedia.
Кроме того, клетки Р. intermedia могут прилипать к буккальным эпителиоцитам. Подобно гемагглютинации, эта способность зависит от штамма. Наибольшим аффинитетом обладают штаммы с фимбриями типа С.
Связываясь с коллагеном типа I, Р. intermedia может колонизировать внеклеточный матрикс. Микроб связывается также с фибриногеном, ламинином и IgG, а также разрушает лактоферрин (что способствует адгезии к эпителиоцитам, фибробластам и колонизации ткани).
Патогенность Р. intermedia и Р. nigrescens снижается в присутствии глюкозы, так как при этом они меньше выделяют конечные цитотоксические продукты метаболизма — сукцинат, изобутират, изовалериат и аммоний.
Инвазия бактерий из биопленки в соединительную ткань считается особенно важным этапом патогенеза пародонтита. У экспериментально инфицированных крыс Р. intermedia обнаруживали в эпителии и соединительной ткани полости рта. Инвазия микробом эпителиальных клеток, по-видимому, связана с присутствием фимбрий типа С.
ЛПС и поверхностные компоненты Р. intermedia могут индуцировать экспрессию лимфокинов воспаления (ИЛ-1, ИЛ-6, ИЛ-8). ИЛ-1β способствует резорбции костной ткани, ИЛ-8 — хемокин для ПЯЛ, а ИЛ-6 — провоспалительный цитокин, вызывающий пролиферацию Т- и В-лимфоцитов.
Гликопротеиновая фракция, не относимая к ЛПС, индуцирует секрецию ИЛ-8, гранулоцитарного и гранулоцигарно-макрофагального колониестимулирующих факторов, а также ICAM, десневыми эпителиоцитами человека. Некоторые штаммы могут активировать Vβ-специфические CD4+ Т-лимфоциты. Указанные механизмы воспаления, вероятно, участвуют в патогенезе не только заболевания пародонта, но и органных поражений.
Основные клинические синдромы: гингивит, пародонтит, абсцессы и флегмоны, эмпиема плевры, перитониты.
- Вернуться в оглавление раздела "Медицинская микробиология"
Редактор: Искандер Милевски. Дата публикации: 22.4.2020
- Возбудители анаэробной (неклостридиальной) инфекции
- Грамположительные анаэробные бактерии: таксономия, свойства, патогенность
- Роды бактерий Peptococcus (сем. Peptococcaceae), Peptostreptococcus, Peptoniphilus, Micromonas и др. (сем. Peptostreptococcaceae)
- Роды бактерий Actinomyces, Mobiluncus, Aggregatibacter (сем. Actinomycetaceae)
- Роды бактерий Propionibacterium (сем. Propionibacteriaceae), Eubacterium, Mogibacterium (сем. Eubacteriaceae), Olsenella (сем. Corynebacteriaceae)
- Роды бактерий Bifidobacterium (сем. Bifidobacteriaceae), Lactobacillus (сем. Lactobacillaceae)
- Роды бактерий Sarcina, Clostridium
- Грамотрицательные (бесспоровые) анаэробные бактерии: таксономия, свойства
- Роды бактерий Acidaminococcus, Dialister, Veillonella (сем. Acidaminococcaceae)
- Роды бактерий Bacteroides (сем. Bacteroidaceae), Tannerella, Porphyromonas (сем. Porphyromonadaceae), Prevotella (сем. Prevotellaceae)
