Алкилирующие противоопухолевые препараты - механизм действия
В химиотерапии опухолей наибольшие успехи достигнуты в лечении злокачественных заболеваний кроветворной ткани. С помощью только лекарственных средств возможно излечение или значительное продление жизни при таких заболеваниях, как острый лимфобластный лейкоз у детей, лимфома Беркитта, лимфогранулематоз, множественная миелома, острые лейкозы взрослых, эритремия, неходжкинские лимфомы.
В результате успехов молекулярной биологии, генетики в последние годы наряду с известными ранее мишенями для противоопухолевых препаратов (метаболические пути, ДНК, РНК, митоз) в центре внимания исследователей становятся специфичные для опухолевых клеток дефекты генома, а также сигнальные пути опухолевой клетки, обеспечивающие прохождение митогенного сигнала. Идентификация в опухолевой клетке генетических мутаций, специфичных для определенного типа опухолей или же общих для нескольких видов опухолей, синтез ошибочных белков или утрата генов-супрессоров позволили усилить рациональный подход к созданию противоопухолевых лекарств и создать основы для молекулярной терапии рака.
Примером могут служить недавно вошедшие в клиническую практику препараты: гливек, АТРА, ритуксимаб. Противоопухолевые препараты, ориентированные на специфичные опухолевые мишени, получили название «таргетные препараты» (от английского слова target — мишень).
Знание механизмов противоопухолевого и токсического действия препаратов разных классов, особенностей клеточной фармакологии и фармакокинетики, биохимических основ синергизма или антагонизма препаратов при их сочетанном применении создают основу для разработки рациональных схем и режимов использования противоопухолевых лекарственных средств в клинике. Кроме того, классификация препаратов основана преимущественно на механизмах первичного повреждения цитостатиками внутриклеточных мишеней. Именно эти механизмы кратко будут рассмотрены в данной главе.
Алкилирующие агенты - противоопухолевые препараты
Алкилирующие агенты — большой класс противоопухолевых препаратов, включающих несколько групп различающихся по структуре соединений: производные хлорэтиламинов, эфиры дисульфоновых кислот, производные нитрозомочевины, а также неклассические алкилирующие агенты — триазины и комплексные соединения платины.
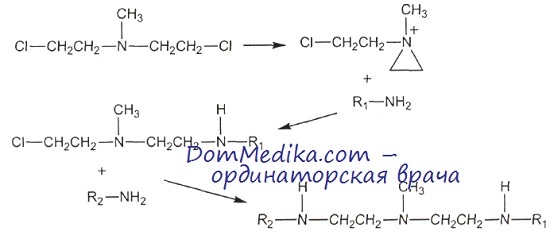
Механизм действия препаратов этого класса связан с модификацией ими биомакромолекул путем их алкилирования, т. е. ковалентного присоединения к ним алкильной группы, замещающей атом водорода. Высокая биологическая активность алкилирующих соединений связана с их способностью к диссоциации в водных растворах с образованием высокореактивных карбониевых, сульфониевых или азониевых положительно заряженных радикалов, которые атакуют нуклеофильные участки нуклеиновых кислот, белков, аминокислот и нуклеотидов.
В молекулах РНК и ДНК нуклеофильными участками являются остатки фосфорной кислоты, атомы азота пуринов и пиримидинов и главным образом азота гуанина в положении 7 (N7). Алкилирование N7-гуаниновых остатков ДНК вызывает лабилизацию нуклеозидных связей, образование апуриновых участков с последующими разрывами полинуклеотидных цепей.
Бифункциональные алкилирующие агенты, т. е. содержащие две алкилирующие группы, образуют ковалентные сшивки между основаниями одной и той же цепи ДНК или обеими цепями, а также между ДНК и ядерными белками. Алкилирование молекул ДНК с образованием межнитевых сшивок и разрывов приводит к нарушению ее матричной функции в процессах репликации и транскрипции, прекращению синтеза ДНК.
Узнавание повреждений ДНК клеточными контролирующими (checkpoint) белками, включая продукт гена ТР53, приводит к остановке клеточного цикла и началу процесса программированной клеточной смерти (апоптоза).
Мутагенное действие алкилирующих агентов является следствием неправильного спаривания оснований при репликации алкилированной ДНК. Алкилирование молекул информационных, транспортных и рибосомальных РНК приводит к нарушению процесса трансляции. Таким образом, алкилирование молекул нуклеиновых кислот блокирует все ступени передачи генетической информации в клетке, начиная с репликации ДНК и кончая синтезом белков. Итак, общая биологическая характеристика препаратов этого класса включает их общую основную внутриклеточную мишень — ДНК и как следствие этого их цитотоксические, мутагенные и канцерогенные эффекты.
Однако препараты этого класса существенно различаются по токсическим эффектам и спектру чувствительных к ним опухолей. Это является результатом их отличий по структуре, растворимости в липидах, способности транспортироваться в клетку, фармакокинетическим показателям, метаболизму, а также способности репаративных систем клеток восстанавливать поврежденные участки ДНК.
Рассмотрим особенности механизма действия отдельных групп препаратов алкилирующего типа.
- Читать "Хлорэтиламины: эмбихин, хлорамбуцил, мелфалан"
Оглавление темы "Противоопухолевая терапия (цитостатики)":- Механизмы действия цитостатиков - фармакодинамика
- Прогноз эффективности противоопухолевой терапии - цитостатиков
- Алкилирующие противоопухолевые препараты - механизм действия
- Хлорэтиламины: эмбихин, хлорамбуцил, мелфалан
- Цифелин - механизм действия
- Циклофосфан - механизм действия
- Стерицит - механизм действия
- Миелосан - механизм действия
- Кармустин, ломустин - механизмы действия
- Триазины (метилирующие агенты) - дакарбазин, прокарбазин
