Механизмы действия цитостатиков - фармакодинамика
Все многообразие использующихся в современной онкологической клинике химиотерапевтических препаратов условно можно разделить на 2 группы — цитостатические (подавляющие клеточную пролиферацию) и цитотоксические (вызывающие гибель клеток) лекарственные средства. Первые действуют циклозависимо, нарушая нормальный процесс клеточного деления (некоторые антиметаболиты нуклеинового обмена, аналоги нуклеотидов, алкалоиды барвинка, гидроксимочевина); вторые индуцируют внутриклеточные повреждения биомакромолекул, вызывая дезорганизацию биохимических процессов независимо от репликативного синтеза ДНК (алки-лирующие агенты, комплексные соединения платины, ингибиторы топоизомераз I и II, таксаны, антибиотики антрациклинового ряда и актиномицины).
Цитостатики слабо действуют на покоящиеся клетки, вызывают остановку пролиферирующих клеток в одной из фаз клеточного цикла с последующей индукцией их апоптоза вследствие незавершенности процесса деления. Цитотоксины также нарушают процесс клеточного деления, но, кроме того, вызывают генотоксический стресс, химически или стерически модифицируя матрицу ДНК (образование внутри- и межнитевых сшивок ДНК, разрывов молекулы, сшивок ДНК-белок, интеркаляция в двунитевую молекулу).
Они также вызывают инактивацию ключевых ферментов, оксидативный стресс и другие внутриклеточные повреждения, разрушающие не только репликативный аппарат, но нарушающие процессы транскрипции, процессинга и сплайсинга РНК, синтеза и фолдинга белка, поддержания электролитного баланса и трансмембранного электроосмотического потенциала, дестабилизируют цитоске-лет. Каждое из этих повреждений является потенциально апоптогенным стимулом.
Ранее отмечалось, что апоптогенный стимул, полученный клеткой, не подлежит немедленному исполнению: происходит его анализ на соответствие совокупности других сигналов. Более того, испытав неблагоприятное, вызвавшее стресс воздействие, клетка отвечает на него стрессовой реакцией (адаптационным синдромом). Биологическим предназначением стрессовой реакции является экстренная мобилизация защитных сил для предотвращения возможных последствий опасного воздействия, преодоления этих последствий и адаптация к вновь возникшим условиям существования.
Эта общая неспецифическая реакция живых систем присуща многим формам жизни, начиная от простейших одноклеточных организмов до высших многоклеточных растений и животных.
Не являются исключением и отдельные клетки многоклеточных. Мобилизацией защитных сил на клеточном уровне является активизация антиапоптогенной программы (смещение равновесия в сторону выживания). Примером могут служить стрессактивируемые белки теплового шока HSPs и стимуляция стрессактивируемых протеинкиназ SAPK (выше описано антиапоптогенное действие тех и других).
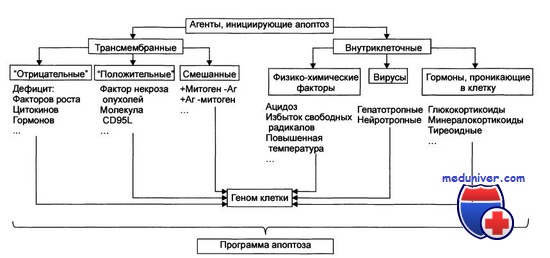
Активация МАР-киназ обнаружена в клетках четырех линий меланомы в ответ на применение цисплатина. С включением стрессиндуцированных механизмов клеточной адаптации связано также становление фенотипа множественной лекарственной устойчивости (МЛУ): недавно убедительно продемонстрирована транскрипционная активация гена Р-гликопротеина (Pgp, p170) в ответ на однократное применение противоопухолевого антиметаболита арабинозилцитозина. Примечательно, что этот цитостатик не входит в число ксенобиотиков, проникновение которых в клетку ограничивается системой АВС-транспортеров (ATP-binding Cassette Transporters), к числу которых принадлежит Pgp — белковый продукт гена MDR1 (Multidrug Resistance 1).
Следует напомнить, что эпигенетическое усиление экспрессии Pgp наблюдается и после теплового шока, воздействия солей мышьяка и УФ-облучения клеток. Следовательно, активация обратных транспортеров не является специфической защитной реакцией на конкретный токсин, а определяет общий адаптационный ответ на стрессорный стимул. Таким образом, немедленная суммарная реакция клетки на применение цитотоксина противоположна желаемой.
Однако возможности адаптационного синдрома не беспредельны: стрессовая реакция способна защитить организм в течение непродолжительного периода времени и при низкоинтенсивных воздействиях. Ресурс адаптационных возможностей зависит от природы стрессорного стимула, его интенсивности, а также от генетических особенностей и функционального состояния организма, органа, ткани, клетки.
Обслуживание стрессовой реакции требует серьезной перестройки метаболизма и энергозатратно, в связи с чем исчерпание адаптационного ресурса при продолжающемся стрессорном воздействии приводит к фазе истощения — баланс сигналов смещается в сторону клеточной гибели (на уровне многоклеточного организма — синдром становления болезни). Ранее приведен пример ответа клетки на генотоксический стресс р53-зависимой остановкой клеточного деления и активацией ДНК-репаративных процессов—защитная реакция; невозможность за определенное время преодолеть последствия стресса и восстановить структуру ДНК вызывает р53-зависимую индукцию апоптоза — фаза истощения.
Такое представление о клеточной реакции на цитотоксическую терапию позволяет сделать два теоретических заключения, справедливость которых уже давно эмпирически показали онкологи-клиницисты. Во-первых, полихимиотерапия должна обладать очевидными преимуществами перед монотерапией любым из комбинантов, поскольку стрессовая реакция клетки малоспецифична и разнообразие стрессорных стимулов быстрее приводит к фазе истощения. Разумеется, имеется в виду комбинация лекарств, к которым данная опухоль (клетка) чувствительна. Во-вторых, большей цитотоксической эффективностью должна обладать схема лекарственного лечения, связанная с применением длительных инфузий препаратов даже при неизменной курсовой дозе.
Такой режим обеспечивает длительное поддержание внутриклеточной терапевтической концентрации препарата в сравнении со струйным введением. Следовательно, генотоксический стресс растянут во времени. Разумеется, речь не идет о депо-формах лекарств и препаратах, действие которых обусловлено их активными метаболитами.
Таким образом, противоопухолевые лекарственные препараты цитотоксического действия вызывают разнообразные внутриклеточные повреждения клеток-мишеней, что приводит их в состояние токсического стресса. Ответной реакцией служит адаптационная активация систем выживания, действие которых направлено на репарацию повреждений (эксцизионная репарация ДНК, рефолдинг белков) в период временной остановки клеточного деления. После исчерпания резерва адаптационных возможностей при продолжающемся стрессорном воздействии баланс сигналов выживания и гибели смещается в сторону последних, результатом чего является включение программы самоликвидации клетки.
Такая последовательность событий характерна для клеток нормальных тканей и трансформированных клеток высокой степени дифференцировки, сохраняющих чувствительность к химиотерапевтическим средствам. Однако по мере прогрессии опухоли трансформированные клетки могут приобретать устойчивость как к отдельным цитотоксинам, так и к широкому спектру лекарственных средств с различным механизмом действия — МЛУ.
- Читать "Прогноз эффективности противоопухолевой терапии - цитостатиков"
Оглавление темы "Противоопухолевая терапия (цитостатики)":- Механизмы действия цитостатиков - фармакодинамика
- Прогноз эффективности противоопухолевой терапии - цитостатиков
- Алкилирующие противоопухолевые препараты - механизм действия
- Хлорэтиламины: эмбихин, хлорамбуцил, мелфалан
- Цифелин - механизм действия
- Циклофосфан - механизм действия
- Стерицит - механизм действия
- Миелосан - механизм действия
- Кармустин, ломустин - механизмы действия
- Триазины (метилирующие агенты) - дакарбазин, прокарбазин
