История противоопухолевой терапии - создание цитостатиков
Большинство противоопухолевых препаратов, используемых в современной онкологической клинике, были отобраны в результате эмпирического скрининга соединений, избирательно или преимущественно убивающих пролиферирующие опухолевые клетки. До недавнего времени большая часть исследований механизмов действия противоопухолевых лекарств относилась к поиску их внутриклеточных биомакромолекулярных мишеней, изучению природы и характера повреждений, индуцированных взаимодействием цитотоксических соединений с мишенью, а также механизмов резистентности, предотвращающих такое взаимодействие.
Однако в середине 70-х годов прошлого столетия после блистательного открытия J. Kerr и соавт. альтернативного некрозу механизма активной клеточной гибели, названного авторами «сморщивающим некрозом», а позднее — «апоптозом», обнаружено, что ионизирующее облучение и цитотоксическая химиотерапия вызывают гибель клеток с морфологическими проявлениями апоптоза. Глобальное значение этого открытия было оценено не сразу: потребовалось около 20 лет для начала формирования концепции, согласно которой индукция апоптоза опухолевой клетки является целью применения цитотоксических препаратов, следствием активации генетически заложенной в клетках программы гибели в ответ на первичное взаимодействие цитотоксинов с внутриклеточными мишенями.
Эта концепция не умаляет важности исследований молекулярных механизмов возникновения внутриклеточных повреждений, а лишь заполняет брешь в понимании последовательности событий, развивающихся в клетке после цитотоксического воздействия.
К концу XX в. в списке потенциальных индукторов апоптоза оказалось подавляющее большинство противоопухолевых лекарственных средств, от препаратов «первой волны» (эмбихин, хлорамбуцил, 5-фторурацил) до современных (гемзар, паклитаксел, гливек, ритуксимаб и др.). Показано, что нарушение нормального выполнения программы гибели в опухолевых клетках приводит к снижению лекарственной чувствительности опухолей.
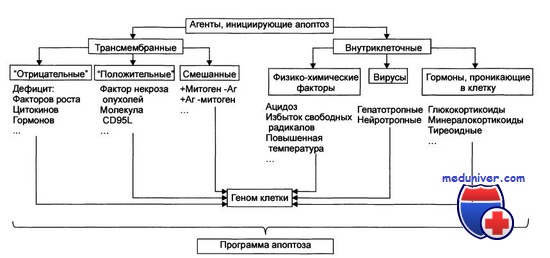
Цитотоксины даже с различающимися первичными мишенями могут активировать сходные пути индукции апоптоза клеток-мишеней, поэтому повреждение программы гибели клеток приводит к формированию их мультирезистентного фенотипа. Например, многие ДНК-повреждающие агенты активируют белок р53, и утрата этого продукта вследствие инактивирующей мутации гена ТР53 (ранее р53) или появление функционально неактивных мутантных форм белка снижает чувствительность клеток к цитотоксинам.
Восстановление в опухолевых клетках синтеза нормального белка р53 «дикого типа» (например, путем трансфекции соответствующей генной конструкцией) повышает их чувствительность к лекарственноиндуцированному апоптозу. Одновременно р53 не является единственным внутриклеточным триггером для включения программы лекарственно-индуцированного апоптоза: будучи примененными в соответствующей дозе, практически все противоопухолевые агенты способны индуцировать р53-независимый апоптоз опухолевых клеток. В то же время белковый продукт онкогена BCL-2 может повышать лекарственную резистентность к широкому кругу противоопухолевых соединений и даже предотвращать р53-независимый апоптоз.
Сформулированная концепция центральной роли апоптоза в реализации цитотоксического эффекта противоопухолевой терапии до настоящего времени вызывает определенную критику со стороны ее оппонентов. Одним из критических аргументов является отсутствие очевидных успехов в поиске прогностически значимых маркеров эффективности лекарственной и лучевой терапии опухолевых заболеваний среди многочисленных участников программы клеточной гибели.
На роль таких маркеров наиболее полно исследованы проапоптогенные факторы CD95, TNFR-1, Bax, Bad, Bid, p53 и супрессоры апоптоза Bcl-2, Bcl-XL, PI-3-K, HSPs, PKCs, lAPs.
Сигнальные каскады ферментативных реакций, в результате которых в конечном итоге определяется судьба каждой клетки (активация программы гибели или выживание), не могут быть, однако, представлены как один или несколько магистральных путей. В анализе сигналов смерти и выживания одновременно принимает участие огромное количество факторов, в связи с чем прогностическая ценность определения выделенных из общего контекста отдельных регуляторных компонентов не велика.
В последующих статьях на нашем сайте Доммедика внимание сфокусировано на общих закономерностях процессов трансдукции и анализа сигналов апоптоза, значении многоуровневой антиапоптогенной программы для становления фенотипа лекарственной устойчивости опухолевых клеток и ее роли в прогрессии опухолевых заболеваний. Изложение материала опирается на последние данные научной литературы, а их анализ и заключения представляют собственную концепцию автора и могут отличаться от опубликованных ранее.
- Читать "Программированная гибель клетки (апоптоз) - механизмы, патогенез"
Оглавление темы "Онкология":- Т-клеточный лейкоз человека - эпидемиология
- Клиника и диагностика Т-клеточного лейкоза человека (ТкЛЧ)
- Лечение Т-клеточного лейкоза человека (ТкЛЧ) - прогноз
- Тропический спастический парапарез (HTLV-I-accoциированная миелопатия (TSP/HAM)) - эпидемиология, клиника
- Взаимосвязь Т-клеточного лейкоза человека и Т-клеточных лимфом
- Роль HTLV-I - вируса Т-клеточного лейкоза человека в онкогенезе
- Роль организма в развитии Т-клеточного лейкоза человека (ТкЛЧ)
- Генетический фактор в развитии Т-клеточного лейкоза человека (ТкЛЧ)
- История противоопухолевой терапии - создание цитостатиков
- Программированная гибель клетки (апоптоз) - механизмы, патогенез
