Программированная гибель клетки (апоптоз) - механизмы, патогенез
Апоптоз, или программированная гибель клетки (ПГК), является регулятором тканевого гомеостаза. Многоклеточные организмы посредством апоптоза элиминируют состарившиеся, поврежденные или инфицированные клетки. Формирование современных представлений о программированной гибели клеток началось с публикаций британских ученых о существовании двух альтернативных путей гибели животной клетки — апоптоза и некроза.
За прошедшие три десятилетия продемонстрировано глобальное значение процесса программированной гибели клеток для онто- и филогенеза, возникновения органной и тканевой специфичности клеток, процессов эволюции, дифференцировки, специфической реакции на внешние воздействия, а также его роль в патогенезе многих заболеваний.
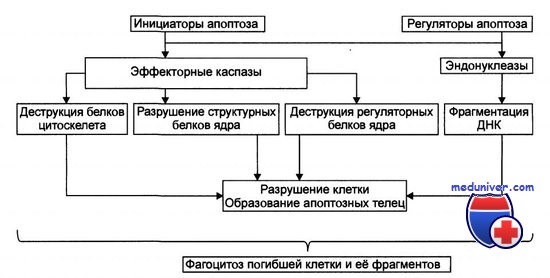
Термин «апоптоз» (от греч. apoptosis — опадающая осенняя листва) первоначально использовался для описания характерного для этого процесса комплекса морфологических проявлений программированной гибели клеток. При апоптозе наблюдается конденсация хроматина по периферии клеточного ядра, кариопикноз и кариорексис (сморщивание и фрагментация ядра). Параллельно происходит уменьшение размеров клетки, ее «ошаривание» (клетки адгезионных культур открепляются от субстрата), блэббинг клеточной стенки (от англ. bleb — волдырь): на цейтраферной микровидеосъемке поверхность клетки как бы кипит, на ней вследствие сокращений филаментов цитоскелета образуются и исчезают «волдыри».
Явление получило поэтическое наименование «танец смерти», который можно наблюдать, например, на одном из специализированных сайтов Интернета. Вслед за блэббингом происходит формирование цитоплазматических выростов клеточной мембраны, напоминающих псевдоподии амебы, в каждый из которых перемещается фрагмент клеточного ядра, после чего отдельные выросты отшнуровываются от клеточного остатка и формируют апоптозное тело.
Результатом процесса является распад клетки на ряд апоптозных тел, подготовленных для их утилизации макрофагами: на внешний слой клеточной мембраны перемещаются молекулы фосфатидилсерина, сосредоточенные в интактных клетках асимметрично исключительно во внутреннем листке мембранного бислоя. Экстернализация (или флиппинг, от англ. flip — щелчок) этого фосфолипида в процессе апоптоза, как полагают, играет роль метки «съешь меня» («eat me») для макрофага. Примечательные черты апоптоза — морфологическая интактность внутриклеточных органелл и относительная целостность клеточной мембраны на всех этапах процесса, что предотвращает попадание в межклеточное пространство содержимого цитозоля, вызывающего воспалительную реакцию.
Приведенная картина морфологических изменений клетки в процессе апоптоза по сути соответствует лишь финальным, необратимым его стадиям, тогда как стадия индукции смертельного сигнала, его анализа на соответствие прочим сигналам, в том числе сигналам выживания, и принятия клеткой «решения» на активацию или подавление процесса самоликвидации не имеет столь ярких морфологических проявлений, хотя стратегия развития дальнейших событий определяется именно на этой стадии.
Апоптоз назван программированной гибелью по причине наличия в клетках генетически детерминированного аппарата самоуничтожения (суицидный механизм), основные компоненты которого в норме конститутивно присутствуют в определенных компартментах клетки. Некоторые из них обслуживают отдельные метаболические процессы и могут быть мобилизованы для исполнения программы клеточной гибели в результате смещения баланса про- и антиапоптогенных сигналов; другие, вероятно, предназначены исключительно для исполнения программы гибели.
Одновременно со специализированной машиной смерти в процессах формирования, анализа и проведения к эффекторам сигнала апоптоза участвует ряд внутриклеточных регуляторов и мессенджеров, имеющих более широкие функции. Подобная интеграция специализированных и универсальных компонентов создает огромное многообразие клеточных ответов на сходные по природе стимулы и, напротив, однотипность реакций на стимулы различной природы.
Таким образом, апоптоз с характерными для него морфологическими и молекулярными признаками является лишь одним из частных механизмов развития процесса программированной гибели клеток. Отклонение от классической совокупности признаков (конденсации хроматина, уменьшения объема клетки и ее ядра, межнуклеосомной фрагментации ДНК, блэббинга и др.) — уже не апоптоз в строгом понимании термина. Но в рамках настоящей главы значение имеет сам факт активации суицидной внутриклеточной машины, ее программированность, а не морфологические проявления ее деятельности.
Это замечание важно для формирования изложенной ниже концепции и будет прокомментировано в соответствующих разделах, однако начать изложение целесообразно с исторически сложившихся представлений, приняв термин «апоптоз» синонимом программированной гибели клеток.
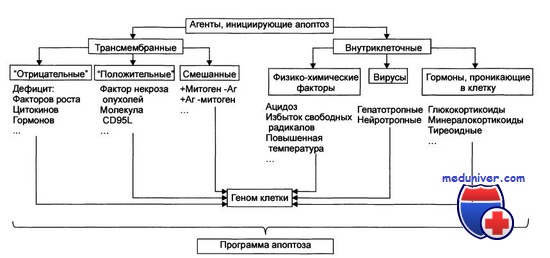
Общая схема про- и антиапоптогенных сигнальных, проводящих и исполнительных механизмов в настоящее время представляется следующей. Инициирующим апоптоз событием является сигнал смерти, роль которого может исполнять внеклеточный фактор (цитокины суперсемейства факторов некроза опухолей — TNF, гранзимы и др.) или внутриклеточные повреждения биомакромолекул и органелл (митохондрий, эндоплазматического ретикулума, цитоскелета и др.).
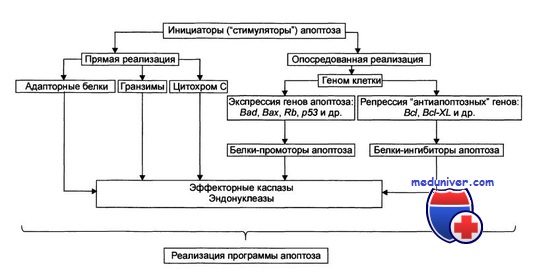
Первичный сигнал смерти не подлежит немедленному исполнению, а подвергается всестороннему анализу на его соответствие совокупности других сигналов, постоянно получаемых клеткой. Если сигнал смерти не отменен, его интенсивность достаточна, а проводящие сигнальные пути не заблокированы, активируется эффекторная суицидная машина, запускающая всю описанную последовательность необратимых событий.
Таким образом, принципиально существование по меньшей мере двух различных путей индукции сигнала апоптоза: внеклеточного (extrinsic) и внутриклеточного (intrinsic). Воспринятый соответствующим сенсором, сигнал смерти становится инициатором каскадной последовательной активации ряда «нижестоящих» проапоптогенных факторов. Самостоятельность внеклеточного и внутриклеточного сигнальных путей относительна: существуют многочисленные точки переключения сигнала, а на эффекторной стадии апоптоза различные сигнальные пути конвергируют и используют общий суицидный механизм.
- Вернуться в раздел "онкология"
Оглавление темы "Онкология":- Т-клеточный лейкоз человека - эпидемиология
- Клиника и диагностика Т-клеточного лейкоза человека (ТкЛЧ)
- Лечение Т-клеточного лейкоза человека (ТкЛЧ) - прогноз
- Тропический спастический парапарез (HTLV-I-accoциированная миелопатия (TSP/HAM)) - эпидемиология, клиника
- Взаимосвязь Т-клеточного лейкоза человека и Т-клеточных лимфом
- Роль HTLV-I - вируса Т-клеточного лейкоза человека в онкогенезе
- Роль организма в развитии Т-клеточного лейкоза человека (ТкЛЧ)
- Генетический фактор в развитии Т-клеточного лейкоза человека (ТкЛЧ)
- История противоопухолевой терапии - создание цитостатиков
- Программированная гибель клетки (апоптоз) - механизмы, патогенез
