Причины и механизмы развития гиперфункции коры надпочечников - гиперкортицизма
Заболевания коры надпочечников подразделяют на те, которые сопровождаются ее гиперфункцией, и те, которые сопровождаются гипофункцией органа.
Поскольку есть три основных типа кортикостероидов, вырабатываемых корой надпочечников, существуют три синдрома гиперфункции коры надпочечников:
(1) гиперкортицизм, или синдром Кушинга, характеризующийся избытком кортизола;
(2) гиперальдостеронизм (избыточная секреция альдостерона);
(3) адреногенитальный синдром, обусловленный избыточным синтезом андрогенов.
Клинические признаки перечисленных синдромов отчасти перекрываются из-за сходства функций некоторых гормонов надпочечников.
а) Патогенез. К гиперкортицизму приводят любые состояния, которые сопровождаются повышением уровня глюкокортикостероидов. Надпочечниковую форму гиперкортицизма называют синдромом Кушинга.
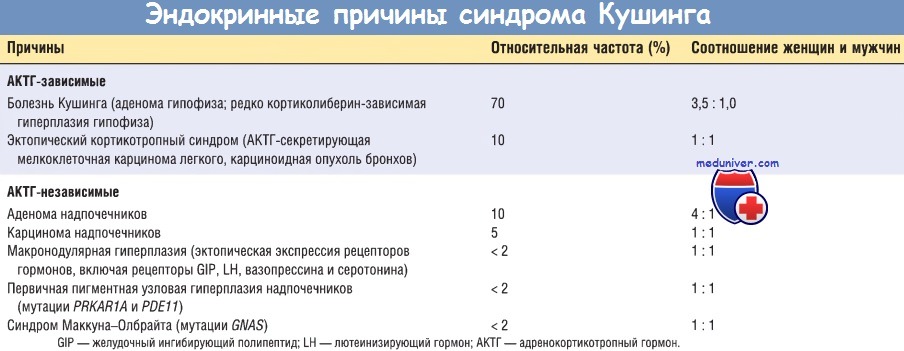
Причины синдрома Кушинга могут быть экзогенными и эндогенными. Подавляющее большинство наблюдений синдрома Кушинга являются результатом приема лекарственных препаратов из группы глюкокортикостероидов {ятрогенный синдром Кушинга). Эндогенные причины, в свою очередь, можно разделить на АКТГ-зависимые и АКТГ-независимые.
АКТГ-секретирующие аденомы гипофиза являются причиной 70% наблюдений эндогенного гиперкортицизма. В знак признания заслуг нейрохирурга Харви Кушинга, впервые полноценно описавшего этот синдром, гипофизарную форму гиперкортицизма назвали болезнью Кушинга. Гиперкортицизм в 4 раза чаще наблюдается у женщин, обычно молодых. В большинстве случаев причина гиперкортицизма — АКТГ-секретирующая микроаденома гипофиза.
Некоторые кортикотропные опухоли являются макроаденомами (> 10 мм). Реже в передней доле гипофиза обнаруживают участки гиперплазии кортикотропных клеток без образования аденомы. Гиперплазия кортикотропных клеток может быть первичной или развиваться вторично вследствие избыточной стимуляции АКТГ-секретирующих клеток гипофиза кортиколиберинпродуцирующей опухолью гипоталамуса.
В надпочечниках лиц с болезнью Кушинга наблюдается различная степень узловой гиперплазии коры надпочечников (см. далее), вызванной повышением уровня АКТГ. В свою очередь, гиперплазия коры надпочечников приводит к развитию гиперкортицизма.
Эктопическая секреция АКТГ негипофизарными опухолями является причиной 10% наблюдений АКТГ-зависимого синдрома Кушинга. Во многих случаях такой опухолью является мелкоклеточная карцинома легкого, хотя этот синдром могут вызывать и другие опухоли, включая карциноидные, медуллярную карциному щитовидной железы и опухоль из клеток островков Лангерганса. Кроме эктопической секреции АКТГ некоторые нейроэндокринные опухоли продуцируют эктопический кортиколиберин, который, в свою очередь, повышает секрецию АКТГ и вызывает гиперкортицизм.
Как и при гипофизарном варианте, развивается двухсторонняя гиперплазия коры надпочечников, летальный исход наступает относительно быстро, и надпочечники не успевают увеличиться. Этот вариант синдрома Кушинга обычно наблюдается у мужчин в возрасте 40-50 лет.
Первичные опухоли надпочечников, например аденома (10%) и карцинома (5%), являются самой частой причиной АКТГ-независимого синдрома Кушинга. Биохимическим маркером развития АКТГ-независимого синдрома Кушинга является повышение уровня кортизола в сыворотке крови на фоне низкого уровня АКТГ. Гиперкортицизм при карциноме коры надпочечников обычно больше выражен, чем при аденомах и гиперплазии.
При односторонней опухоли непораженная часть коры этого надпочечника и кора надпочечника с противоположной стороны атрофируются из-за снижения секреции АКТГ.
Большинство гиперплазий коры надпочечников являются АКТГ-зависимыми, а первичная гиперплазия коры надпочечников (т.е. АКТГ-независимая) развивается редко. При макроподулярной гиперплазии узлы достигают размера более 3 мм. Макронодулярная гиперплазия обычно возникает без связи с синдромными заболеваниями и чаще наблюдается у взрослых. Данное состояние является АКТГ-независимым, но не полностью автономное, т.е. продукцию кортизола регулируют и другие гормоны, что обусловлено эктопической гиперэкспрессией соответствующих рецепторов в клетках коры надпочечников.
Например, при гиперплазии в клетках коры надпочечников часто определяется гиперэкспрессия рецепторов желудочного ингибирующего полипептида, LH, АДГ и серотонина. Однако механизм, посредством которого в ткани коры надпочечников происходит гиперэкспрессия рецепторов для этих гормонов, неизвестен. Часть макронодулярных гиперплазий, развивающихся при синдроме Маккуна-Олбрайта, характеризуются наличием активирующих зародышевых мутаций гена GNAS, который кодирует синтез стимулирующего С.ча-белка. Кроме того, первичная гиперплазия коры надпочечников может возникать в результате мутаций других генов, контролирующих внутриклеточный уровень цАМФ, в т.ч. гена PRKR1A и гена PDE11А.

Для сравнения представлен нормальный надпочечник (слева).
На разрезе корковое вещество надпочечника имеет желтый цвет, утолщено, видна едва различимая узловатость.
У данного пациента с АКТГ-зависимым синдромом Кушинга диффузно гиперплазирована кора обоих надпочечников.
б) Морфология. Основные изменения при синдроме Кушинга происходят в гипофизе и надпочечниках. Изменения в гипофизе не зависят от причины синдрома. Самые частые изменения, происходящие в результате высокого уровня эндогенных или экзогенных глюкокортикостероидов, обозначают термином «гиалиновые изменения Крука». При синдроме Кушинга зернистая базофильная цитоплазма АКТГ-секретирующих клеток передней доли гипофиза становится гомогенной и бледной (гиалиновый вид). Такое изменение является результатом накопления в цитоплазме промежуточных кератиновых филаментов.
В зависимости от причины гиперкортицизма в надпочечниках определяется одно из следующих нарушений:
(1) атрофия коры надпочечников;
(2) диффузная гиперплазия коры надпочечников;
(3) макронодулярная или микронодулярная гиперплазия;
(4) аденома или карцинома коры надпочечников.
У пациентов с синдромом Кушинга, развившимся в результате терапии экзогенными глюкокортикостероидами, подавление выработки эндогенного АКТГ приводит к двухсторонней атрофии коры надпочечников вследствие недостаточной стимуляции АКТГ пучковой и сетчатой зон. При этом толщина клубочковой зоны не меняется, поскольку эта часть коры функционирует независимо от АКТГ. Напротив, при эндогенном гиперкортицизме надпочечники могут быть гиперплазированными или иметь новообразование.
У лиц с АКТГ-зависимым синдромом Кушинга наблюдается диффузная гиперплазия коры надпочечников. При этом обе железы увеличены в разной степени, а масса надпочечников достигает ВО г. Кора надпочечников диффузно утолщена, количество узлов различное, хотя последнее не так выражено, как при АКТГ-независимой узловой гиперплазии. При микроскопическом исследовании в гиперплазированной коре определяется расширение сетчатой зоны, содержащей компактные, эозинофильные, бедные липидами клетки, окруженной зоной вакуолизированных клеток, богатых липидами, напоминающих клетки пучковой зоны. Все узлы обычно состоят из вакуолизированных, богатых липидами клеток, что объясняет желтый цвет гиперплазированных желез.
При макронодулярной гиперплазии надпочечники практически полностью замещаются узлами различного размера (< 3 см), которые содержат смесь бедных и богатых липидами клеток. В отличие от диффузной гиперплазии при микроскопическом исследовании в участках между узлами также определяется узлообразование. Микронодулярная гиперплазия характеризуется наличием темных (от коричневых до черных) микроузлов диаметром 1-3 мм, чередующихся с участками атрофии коры.
Считается, что пигментация обусловлена накоплением липофусцина (пигмента старения).
Первичные опухоли коры надпочечников, приводящие к синдрому Кушинга, могут быть доброкачественными или злокачественными. Функционирующие аденомы и карциномы коры надпочечников, являющиеся источником кортизола, морфологически не отличаются от нефункционирующих опухолей (см. далее). Как доброкачественные, так и злокачественные образования чаще развиваются у женщин в возрасте 30-50 лет. Аденомы представляют собой опухоли желтого цвета, с тонкой или хорошо выраженной капсулой, обычно массой менее 30 г. При микроскопическом исследовании аденомы представлены клетками, напоминающими нормальные клетки пучковой зоны.
Карциномы, ассоциированные с синдромом Кушинга, обычно значительно крупнее аденом. Карциномы, масса которых часто достигает 200-300 г, представляют собой образования без капсулы, имеющие все признаки анаплазии, характерные для злокачественных опухолей (см. далее). При наличии функционирующей опухоли, как доброкачественной, так и злокачественной, прилегающая ткань коры и кора противоположного надпочечника атрофируются в результате подавления секреции эндогенного АКТГ высоким уровнем кортизола.
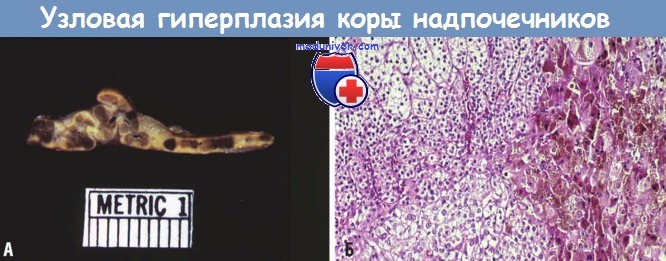
(Б) При гистологическом исследовании узлы представлены клетками, содержащими пигмент липофусцин, скопления которого хорошо видны справа.
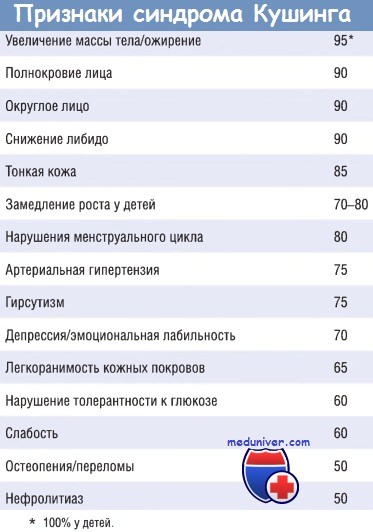
в) Клинические признаки. В связи с медленным развитием синдрома Кушинга ранние проявления могут быть выражены минимально. На ранних стадиях заболевание может проявляться гипертензией и увеличением массы тела. Со временем появляются более характерные признаки в виде избыточного отложения жировой ткани по центральному типу: лунообразное лицо и скопление жира на задней поверхности шеи и спине (так называемый горб бизона). Гиперкортицизм приводит к селективной атрофии мышечных волокон типа 2, что обусловливает снижение мышечной массы и слабость проксимальных отделов конечностей.
Глюкокортикостероиды индуцируют глюконеогенез и препятствуют поглощению глюкозы клетками, что ведет к гипергликемии, глюкозурии и полидипсии (вторичный СД).
Результат катаболического эффекта гормонов — разрушение коллагена и резорбция костей, вследствие чего кожа становится тонкой и легко ранимой, раны заживают плохо, появляются кожные стрии, преимущественно в области живота. Резорбция костей приводит к развитию остеопороза, сопровождающегося болями в спине и повышенной предрасположенностью к переломам. У лиц с синдромом Кушинга повышен риск развития различных инфекций, поскольку глюкокортикостероиды обладают иммуносупрессивным действием. Кроме этого, наблюдаются различные психические нарушения, включая перепады настроения, депрессию и выраженный психоз, а также гирсутизм и нарушения менструации.
Изменения при синдроме Кушинга характеризуются увеличением концентрации свободного кортизола в моче и нарушением секреции кортизола. Определить причину синдрома Кушинга помогает измерение уровня АКТГ в сыворотке крови и изменения экскреции стероидов с мочой после введения дексаметазона (дексаметазоновый тест). Существует 3 основных типа нарушений:
- при гипофизарном синдроме Кушинга (самой частой форме) уровень АКТГ повышен и не снижается при введении низких доз дексаметазона, при этом экскреция с мочой 17-гидроксикортикостероидов также не снижается. Однако на введение высоких доз дексаметазона гипофиз отвечает снижением секреции АКТГ, следствием чего является снижение экскреции стероидов с мочой;
- эктопическая секреция АКТГ приводит к повышению уровня АКТГ, который совершенно не меняется при введении малых и высоких доз дексаметазона;
- если синдром Кушинга возникает вследствие опухоли надпочечника, уровень АКТГ достаточно низкий из-за подавления активности гипофиза по принципу отрицательной обратной связи. Как и при эктопической секреции АКТГ, как низкие, так и высокие дозы дексаметазона не влияют на экскрецию кортизола с мочой.

лунообразное лицо и стрии на коже живота.
- Читать "Причины и механизмы развития гиперальдостеронизма"
Оглавление темы "Патогенез эндокринных болезней":- Причины и механизмы развития осложнений сахарного диабета
- Морфология осложнений сахарного диабета
- Симптомы сахарного диабета
- Классификация эндокринных опухолей поджелудочной железы
- Причины и механизмы развития гиперинсулинизма (избытка инсулина)
- Причины и механизмы развития синдрома Золлингера-Эллисона
- Строение и функции надпочечников
- Причины и механизмы развития гиперфункции коры надпочечников - гиперкортицизма
- Причины и механизмы развития гиперальдостеронизма
- Причины и механизмы развития адреногенитального синдрома
