Причины и механизмы развития осложнений сахарного диабета
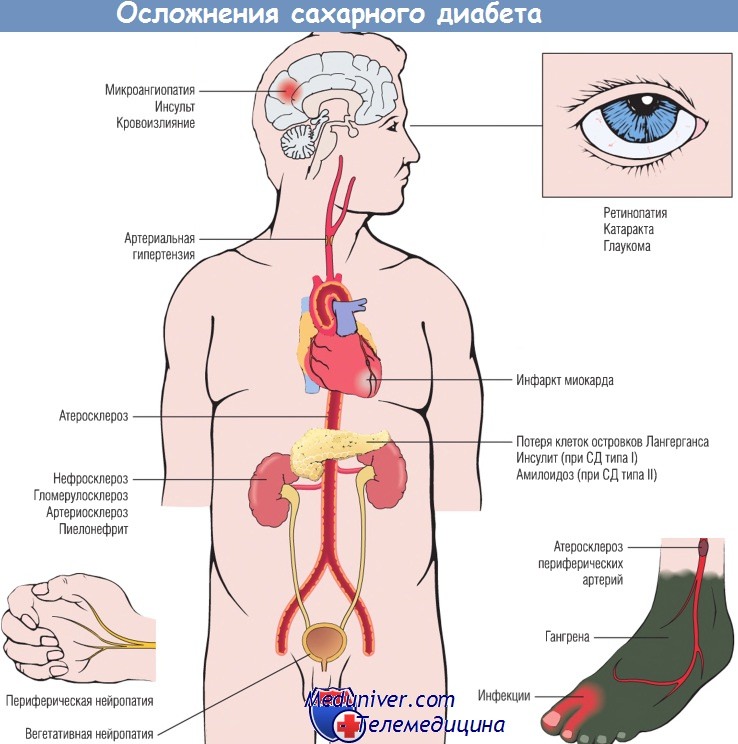
Длительно существующий СД любого типа характеризуется развитием серьезных осложнений, обусловленных поражением артерий мышечного типа крупного и среднего калибра (макроангиопатией), а также дисфункцией капилляров в органах-мишенях (микроангиопатией).
Макроангиопатия у лиц с СД приводит к быстропрогрессирующему атеросклерозу с высоким риском развития инфаркта миокарда, инсульта и гангрены нижних конечностей. Микроангиопатия сильнее всего проявляется в сетчатке, почках и периферических нервах, приводя к диабетической ретинопатии, нефропатии и нейропатии соответственно.
Патогенез осложнений СД многофакторный, однако ключевую роль, вероятно, играет персистирующая гипергликемия («глюкотоксичность»). По результатам широкомасштабных рандомизированных исследований установлено, что ведущая роль в профилактике поздних осложнений СД принадлежит контролю уровня глюкозы в крови.
Гликемический контроль в этих исследованиях осуществляли, определяя уровень гликозилированного гемоглобина — HbA1c, который образуется в результате не опосредованного ферментами ковалентного присоединения остатка глюкозы к гемоглобину в эритроцитах. НЬА1С обеспечивает гликемический контроль на протяжении всей жизни эритроцитов (120 дней), и его уровень в течение суток изменяется минимально.
Согласно рекомендациям American Dietetic Association, НЬА1С у пациентов с СД должен оставаться на уровне менее 7%. Важно подчеркнуть, что гипергликемия — не единственный фактор, ответственный за развитие поздних осложнений СД. В числе других — инсулинорезистентность и сопутствующие заболевания, например ожирение.
Существует по крайней мере три механизма повреждающего воздействия длительно существующей гипергликемии на периферические ткани, но какой из них является основным, пока неясно.
а) Образование конечных продуктов гликирования. Конечные продукты гликирования (AGE) образуются в результате не опосредованных ферментами реакций между внутриклеточными предшественниками бикарбонатов, которые являются производными глюкозы (глиоксаль, метилглиоксаль и 3-дезоксиглюкозон), и аминогруппами внутри- и внеклеточных белков.
Скорость образования AGE при гипергликемии значительно повышается. AGE связываются со специфическим рецептором RAGE, который экспрессируется на клетках воспаления (макрофагах и Т-лимфоцитах), эндотелиальных и гладкомышечных клетках сосудов. Отрицательное влияние сигнала AGE и RAGE на сосудистую систему заключается в:
(1) выделении провоспалительных цитокинов и факторов роста из макрофагов интимы;
(2) образовании активных форм кислорода в эндотелиальных клетках;
(3) усилении воздействия прокоагулянтов на эндотелиальные клетки и макрофаги;
(4) усилении пролиферации гладкомышечных клеток сосудов и увеличении синтеза основного вещества соединительной ткани.
Действительно, гиперэкспрессия RAGE в эндотелиоцитах у мышей с СД усиливает повреждение крупных сосудов и приводит к прогрессированию микроангиопатии, тогда как у мышей, лишенных рецептора RAGE, скорость этих процессов уменьшается. Разработаны антагонисты RAGE, которые проходят клинические испытания в лечении СД. Помимо рецептор-опосредованных эффектов AGE могут «сшивать» между собой внеклеточные белки.
Такое «сшивание» молекул коллагена типа I в стенке крупных сосудов снижает ее эластичность и устойчивость к перерастяжению и усиливает повреждение эндотелия. Кроме того, «сшивание» молекул коллагена типа IV в базальных мембранах снижает адгезию эндотелиальных клеток к стенке сосуда и увеличивает экстравазацию жидкости. Белки, «сшитые» AGE, устойчивы к протеолитическому расщеплению. Таким образом, «сшивание» препятствует удалению поврежденных белков, что способствует их накоплению.
AGE-модифицированные компоненты внеклеточного вещества также удерживают негликилированную плазму крови и белки плазмы. В крупных сосудах удержание липопротеинов низкой плотности усиливает отложение холестерина в интиме и ускоряет атерогенез. В капиллярах, включая капилляры почечных клубочков, белки плазмы, например альбумин, связываются с гликозилированной базальной мембраной, в результате происходит ее утолщение, что является характерным признаком диабетической микроангиопатии.
б) Активация протеинкиназы С. Активация внутриклеточной протеинкиназы С ионами кальция и вторичным мессенджером диацилглицеролом является важным путем передачи сигнала во многих клетках организма. Внутриклеточная гипергликемия стимулирует синтез диацилглицерола de novo из промежуточных продуктов гликолиза, что активирует протеинкиназу С. Многочисленные нисходящие эффекты активации протеинкиназы С включают:
- продукцию проангиогенного VEGF, участвующего в неоваскуляризации, характерной для диабетической ретинопатии;
- повышение концентрации вазоконстриктора эндотелина-1 и снижение концентрации вазодилататора оксида азота вследствие уменьшения экспрессии эндотелиальной синтазы оксида азота;
- выделение профибриногенных факторов, таких как TGF-P, приводящее к повышению отложения белков во внеклеточном матриксе и базальной мембране;
- выделение ингибитора активатора плазминогена типа 1, что ведет к снижению фибринолиза и, возможно, тромбозу;
- выделение провоспалительных цитокинов эндотелиальными клетками сосудов.
Очевидно, что некоторые эффекты AGE и активированной протеинкиназы С перекрываются, но все они способствуют развитию осложнений, связанных с диабетической микроангиопатией. Клинические испытания лечения диабетической ретинопатии ингибитором протеинкиназы С рубоксистаурином показывают обнадеживающие результаты. Путь активации протеинкиназы С исследуют в качестве терапевтической мишени при диабетической нефропатии.
в) Внутриклеточная гипергликемия и нарушение пути метаболизма полиола. В некоторых тканях, которым для поглощения глюкозы не нужен инсулин (например, нервах, хрусталике, почках, кровеносных сосудах), длительная внеклеточная гипергликемия приводит к повышению концентрации глюкозы внутри клеток этих тканей, где она метаболизируется ферментом альдозоредуктазой при участии кофермента никотинамидадениндинуклеотидфосфата (NADP) до сорбитола, полиола и в конечном итоге до фруктозы.
NADP — необходимый кофермент для глутатионредуктазы в реакции регенерации глутатиона. Глутатион является одной из важнейших антиоксидантных систем клетки, и любое снижение уровня глутатиона повышает чувствительность клетки к окислительному повреждению. На фоне постоянной гипергликемии прогрессирующее истощение внутриклеточного NADP под действием альдозоредуктазы нарушает регенерацию глутатиона, повышая восприимчивость клеток к окислительному повреждению.
Длительная гипергликемия является главной причиной развития диабетической нейропатии (глюкозная нейротоксичность). Несмотря на то что результаты клинических исследований ингибитора альдозоредуктазы пока неутешительны, воздействие на этот путь с целью предотвращения развития осложнений СД остается перспективным.
- Читать "Морфология осложнений сахарного диабета"
Оглавление темы "Патогенез эндокринных болезней":- Причины и механизмы развития осложнений сахарного диабета
- Морфология осложнений сахарного диабета
- Симптомы сахарного диабета
- Классификация эндокринных опухолей поджелудочной железы
- Причины и механизмы развития гиперинсулинизма (избытка инсулина)
- Причины и механизмы развития синдрома Золлингера-Эллисона
- Строение и функции надпочечников
- Причины и механизмы развития гиперфункции коры надпочечников - гиперкортицизма
- Причины и механизмы развития гиперальдостеронизма
- Причины и механизмы развития адреногенитального синдрома
