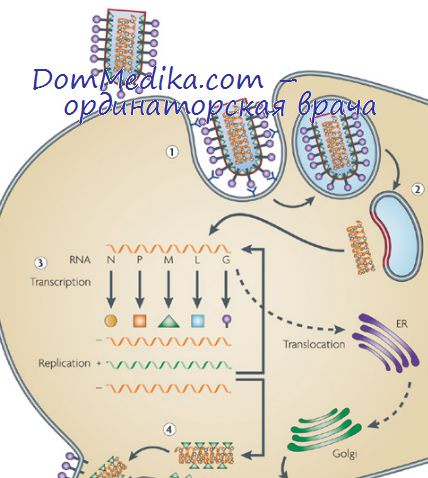
Сборка и выход паповавирусов из клетки. Метаболизм зараженных паповавирусами клеток
Все паповавирусы собираются в ядре, где они могут образовывать кристаллические скопления. Вирус полиомы и SV40 развиваются довольно сходным путем в ядрах зараженных мышиных эмбриональных клеток (Мэттерн и др., 1966) и клеток обезьян Cercopithecus (Гранбулан и др., 1963) соответственно. Мэттерн и др. (1966) изучали внутриклеточное развитие вируса полиомы при одноступенчатом размножении в мышиных эмбриональных клетках. К сожалению, использованный для заражения материал содержал, кроме единичных вирионов, связанные с мембранами агрегаты, что затрудняет интерпретацию ранних, следующих за поглощением вируса стадий.
Через 16—20 ч после заражения в ядре возникали пучки интенсивно окрашиваемых нитей, которые постепенно становились все более и более явными. Через 24 ч после заражения в ядре обнаруживали много нитей, рассеянные сферические частицы и небольшие кристаллические скопления сферических частиц; позже иногда появлялись крупные кристаллы. Через 28 ч в цитоплазме клеток, чьи нагруженные вирусом ядра дегенерировали, были обнаружены вирионы, а не нити. Дочерние вирионы были уложены на клеточных мембранах как монослои плотноупакованных частиц. Вирионы, выходящие из ядра, обладают высоким сродством к клеточным мембранам. Их можно отделить от мембран лишь с помощью нейраминидазы. Последнее обстоятельство придает особую ценность этому ферменту при приготовлении концентрированных суспензий вируса (Крофорд, 1962).
Метаболизм зараженных паповавирусами клеток
При продуктивном заражении сплошных монослойных культур вирусом полиомы или SV40 скорость синтеза клеточной ДНК заметно увеличивается (Дульбекко и др., 1965; Вайль и др., 1965). Увеличение скорости зависит от нескольких факторов, в том числе от начального состояния клетки и множественности инфекции (Фогт и др., 1966; Брэнтон и Шайнин, 1968).
Наибольшая стимуляция синтеза ДНК наблюдается в монослойных первичных клетках, которые в норме обладают низкой ДНК-синтезирующей активностью.
SV40 индуцирует синтез ДНК при заражении клеток CV-1 (Кит и др., 1967b), но не BSC-1 (Гершон и др., 1966). Если заражать вирусом полиомы мышиные эмбриональные клетки в экспоненциальной фазе роста, то синтез ДНК не индуцируется при высокой, но индуцируется при низкой множественности инфекции (Брентон и Шайнин, 1968).
Для дерепрессии синтеза ДНК клетки-хозяина необходимо функционирование только части вирусного генома, так как инфекционность инактивируется в пять раз быстрее, чем способность вируса полиомы или SV40 индуцировать синтез ДНК (Дефенди и Дженсен, 1967; Гершон и др., 1966).
Стимуляция репликации ДНК вирусом полиомы и SV40 характерна для клеточных ДНК всех классов, в том числе для митохондриальной, и сопровождается индукцией синтеза гистонов. Когда в результате смены среды стимулируется репликация в сплошных неделящихся культурах незараженных фибробластов, немедленно возрастает и скорость синтеза кислых ядерных белков (Фарбер и др., 1971).
После заражения пермиссивных или непермиссивных клеток SV40 синтез этих же кислых белков индуцируется уже через 3 ч, т. е. примерно на 9 ч раньше, чем происходит индукция синтеза ДНК и гистонов (Ровера и др., 1972). Аналогия между изменениями синтеза кислых ядерных белков, индуцируемыми вирусом и сывороткой, свидетельствует о каком-то общем механизме индукции синтеза ДНК этими различными стимуляторами.
После заражения пермиссивных клеток SV40 или вирусом полиомы возрастает активность по крайней мере восьми ферментов (Грин, 1970а). Эти ферменты, в том числе тимидинкиназа и ДНК-полимераза, участвуют в превращениях дезоксирибонуклеотидов. Для кодирования стольких ферментов вирусной генетической информации явно недостаточно, и вполне вероятно, что они появляются в результате дерепрессии функций клетки-хозяина.
Эта точка зрения подтверждается тем, что тимидинкиназа не синтезируется в мутантных клетках, лишенных киназы, ни при трансформации, ни при продуктивном заражении их вирусом полиомы (Литлфилд и Базилико, 1966; Базилико и др., 1969). Однако есть сообщения о различиях в физико-химических свойствах тимидинкиназы и ДНК-полимеразы до и после заражения (Карп, 1967; Кит и др., 1967а). Остается установить, указывают ли эти различия на модификацию предсуществующих ферментов в результате вирусной инфекции, на дерепрессию клеточных генов, кодирующих изозимы, или на кодирование вирусом нового фермента.
При заражении вирусом полиомы или SV40 синтез рибосомных и транспортных РНК ощутимо не меняется (Ода и Дульбекко, 1968), а синтез клеточных мРНК стимулируется примерно в два раза (Бенджамин, 1966; Ода и Дульбекко, 1968).
- Читать далее "Цикл размножения аденовирусов. Начальные стадии аденовирусной инфекции"
Оглавление темы "Паповавирусы. Аденовирусы":1. Цикл размножения паповавирусов. Транскрипция паповавирусов
2. Трансляция паповавирусов. Репликация ДНК паповавирусов
3. Интеграция клеточного и вирусного геномов. Интегративность паповавирусов
4. Сборка и выход паповавирусов из клетки. Метаболизм зараженных паповавирусами клеток
5. Цикл размножения аденовирусов. Начальные стадии аденовирусной инфекции
6. Транскрипция аденовирусов. Механизмы транскрипции аденовирусов
7. Трансляция аденовирусов. Этапы трансляции аденовирусов
8. Репликация аденовирусной ДНК. Сборка и выход аденовируса из клетки
9. Изменение метаболизма инфицированного аденовирусом клетки. Цикл размножения герпесвирусов
10. Начальные стадии герпесвирусной инфекции. Транскрипция герпесвирусов
