Нарушение гликемии при критических состояниях
а) Общие концепции и оценка. Интерес к изучению дисгликемии возник в 2001 г., когда группа Берге (Berghe) продемонстрировала, что у 1543 хирургических пациентов на искусственной вентиляции легких значительно снизилась смертность на фоне интенсивного гликемического контроля (ИГК) (van den Berghe и соавт., 2001). Понятие дисгликемии включает в себя различные специфические колебания уровня глюкозы: стресс-индуцированную гипергликемию, гипогликемию, вариабельность гликемии (ВГ) и так называемое время достижения целевой гликемии (индекс TIRG), которое является прогностической переменной, недавно введенной в клиническую практику (Aramendi и соавт., 2017; Krinsley и Grover, 2007).
В последние 20 лет большое внимание уделялось дисгликемии у пациентов в критическом состоянии, поскольку она может представлять собой биомаркер тяжести заболевания и связана с более высокой смертностью.
Как правило, дисгликемия считается хорошо контролируемой при уровне HbAlc и глюкозы, находящихся в целевом диапазоне, а также низкой ВГ. Следует отметить, что эти параметры должны быть соотнесены с общим состоянием пациентов (Gaede и соавт., 2008). Тем не менее существуют некоторые опасения, связанные с использованием классических биомаркеров, таких как HbA1c, поскольку они основаны на плохой воспроизводимости (т.е. имеют значение только в большой выборке, как, например, в клинических испытаниях), а также на клинических и методологических ограничениях в интерпретации HbA1c, что делает основанное на этих результатах лечение недостаточно точным (Shepard и соавт., 2015). Действительно, использование уровня HbA1c для определения клинического статуса и ответа на фармакологические и немедикаментозные методы лечения менее точно, поскольку не дает информации о ВГ и краткосрочных изменениях уровня глюкозы.
Клинически использование неклассических методов оценки гликемического контроля позволило идентифицировать несколько маркеров, которые оценивают более короткие периоды воздействия глюкозы, чем HbAlc, например, фруктозамин, гликозилированный альбумин и 1,5-ангидроглюцитол (Ribeiro и соавт., 2016).
То, что белки плазмы крови более чувствительны к гликированию, что более точно отражает ВГ, делает этот показатель клинически более интересным, чем уровень внутриклеточного гемоглобина (Rondeau и Bourdon, 2011). Поскольку гликированные белки имеют более быстрый оборот, чем HbA1c, который зависит от цикла жизни эритроцитов, занимающего около 120 дней, на них не влияют характеристики эритроцитов или гемоглобина, поэтому они предоставляют важную информацию об уровнях глюкозы в крови за предыдущие 2—4 нед. Следовательно, они являются краткосрочными маркерами, повышающимися при повышении концентрации глюкозы (Ahmed и Furth, 1992; Selvin и соавт., 2014). Референсный диапазон для фруктозамина составляет 200—285 мкмоль/л, что отражает вклад гликозилированного альбумина, а также всех гликозилированных белков, каждый с разным периодом полураспада и разным уровнем гликозилирования.
Поскольку для его измерения не требуется голодание, уровень фруктозамина является подходящим и экономически эффективным показателем, а также обеспечивает лучшую краткосрочную оценку эффективности терапии (Austin и соавт., 1999).
Тем не менее следует отметить, что на уровень фруктозамина могут влиять состояния, связанные с изменением метаболизма или потерей белка. Как и фруктозамин, гликированный альбумин отражает гораздо более короткий предыдущий период воздействия циркулирующей глюкозы, чем HbAlc, и, по-видимому, примерно в 10 раз более чувствителен, чем HbA1c (Koga и Kasayama, 2010; Diamanti-Kandarakis и соавт., 2016). «Пробел гликирования» — это разница между фактически измеренным значением HbAlc и ожидаемым HbA1c на основании других показателей гликемического контроля, таких как гликозилированные белки (фруктозамин или гликозилированный альбумин), основанная на популяционной регрессии HbA1c и фруктозамина, а также отличием показателей HbAlc и ожидаемого HbA1c от среднего значения глюкозы крови (Ahn и соавт., 2017; Rodriguez-Segade и соавт., 2012).
«Пробел гликирования» может иметь положительное или отрицательное значение. Например, пациенты с более высоким HbA1c по сравнению с уровнем глюкозы в крови (положительный «пробел гликирования», подразумевающий более высокую скорость гликирования) имеют более высокий риск гипогликемий (Cohen и соавт., 2003). 1,5-ангидро-глюцитол — это нетрадиционный биомаркер углеводного обмена, основанный на механизме неферментного гликирования и используемый в клинических исследованиях, поскольку глюцидные мономеры распространены повсеместно и в относительно стабильной концентрации (Mukai и соавт., 2017).
При гипергликемии нарушается реабсорбция 1,5-ангидроглюцитола в канальцах почек, так как он конкурирует с глюкозой за Na+/глюкозный котраспортер 4-го типа. При этом усиливается его выведение с мочой, что приводит к снижению концентрации в плазме (Cohen и соавт., 2003). В отличие от других биомаркеров, при усилении гипергликемии ожидается снижение концентрации 1,5-ангидроглюцитола в плазме. Однако, поскольку у пациентов с диабетом, диагностированным или недиагностированным, а также у пациентов с гипергликемией на фоне критических состояний повышение уровня глюкозы можно расценить как стрессовое, HbAlc может служить для дифференциальной диагностики этих состояний, особенно в случае разделения стрессовой гипергликемии и хронической гипергликемии. Значение гликированного гемоглобина коррелирует со средним значением гликемии за предыдущие месяцы и является хорошим маркером для диагностики предшествующей гипергликемии.
Считается, что пациенты с HbA1c 6,5% и выше имеют фоновую гипергликемию. На данный момент существует потребность в надежном и прогностически значимом биомаркере, который бы помогал распределять различные состояния гликемии по соответствующим группам риска и, таким образом, помогал бы принимать более правильные решения относительно оптимальной терапии и прогноза.
б) Патогенетические механизмы и последствия. При наличии тяжелого заболевания гипергликемия может быть вызвана стрессовыми факторами или плохим контролем хронической гипергликемии. Разные причины гипергликемии могут иметь разный прогноз. Вызванная стрессом гипергликемия, определяемая как гипергликемия натощак выше 126 мг/дл, может служить лучшим прогностическим маркером острого заболевания (Capes и соавт., 2001). Острые метаболические и гормональные изменения у людей в критическом состоянии отражаются на стрессовой гипергликемии. Стрессовую гипергликемию характеризуют чрезмерно активный выброс глюкозы печенью, глюконеогенез, гликогенолиз и инсулинорезистентность. Таким образом, усиление глюконеогенеза печенью и снижение поглощения глюкозы в периферических тканях, таких как скелетные мышцы, по-видимому, частично зависит от кортизола, адреналина и норадреналина (Dungan и соавт., 2009). Действительно, повышение уровня кортизола приводит к повышению синтеза глюкозы в печени, стимуляции катаболизма белков с сопутствующим повышением уровней циркулирующих аминокислот, являющихся субстратом для глюконеогенеза (Chan, 1984).
Более того, норадреналин оказывает дополнительный эффект, увеличивая поступление глицерола в печень посредством липолиза, а адреналин стимулирует секрецию глюкагона, что приводит к выработке глюкозы в печени (Hamilton и соавт., 2018). Аналогичным образом наблюдаемый при сепсисе липолиз может частично мобилизовать эндогенные жирные кислоты с сохранением мышечного протеолиза за счет увеличения доступности кетоновых тел посредством кетогенеза, что может защитить от мышечной слабости, вызванной сепсисом (Goossens и соавт., 2019). Синтез производных конечных продуктов гликирования (КПГ), образующихся при стрессовой гипергликемии, был связан с полиорганной недостаточностью у тяжелобольных пациентов (Meertens и соавт., 2016; Baumann, 2009). При этом было замечено, что повышенное количество провоспалительных цитокинов, таких как ИЛ-1, ИЛ-6, антинуклеарный фактор (АНФ)и ФНОа, нарушает гомеостаз глюкозы и передачу сигналов инсулина, что приводит к гипергликемии (Stentz и соавт., 2004; Lang и соавт., 1992).
Эффекты КПГ могут быть связаны со снижением активности митохондрий, что вместе с воспалительной реакцией вызывает полиорганную дисфункцию (Singer и соавт., 2004). Описанное повреждение митохондрий, вызванное нитрозативным и окислительным стрессом, при септическом шоке или остановке сердца вызывает повреждение митохондриальной ДНК, что приводит к снижению выработки энергии и клеточных функций (Brealey и соавт., 2002). Способность митохондрий к регенерации в раннем биогенезе, по-видимому, связана с более благоприятными исходами (Carre и соавт., 2010). Причина возникновения стрессовой гипергликемии и вопрос о том, представляет ли она эволюционно сохранившуюся реакцию, позволяющую хозяину выжить в период тяжелого стресса, все еще остаются невыясненными (Soeters и Soeters, 2012).
Гипогликемические явления, наблюдаемые у пациентов в критическом состоянии, обычно ассоциированы с попыткой улучшения гликемического контроля с помощью применения инсулина. Тем не менее, также возможно развитие спонтанной гипогликемии, факторами риска ее развития являются сепсис, диабет, тяжелые критические заболевания, почечная или печеночная дисфункция. Приведенные механизмы гипогликемических явлений, следовательно, могут быть основаны на неконтролируемом эффекте инсулина или быть следствием увеличения активности инсулина липополисахаридами, частично за счет снижения клиренса инсулина и ускорения наступления опасного гипогликемического шока (Hagar и соавт., 2017). Действительно, липополисахариды и оксид азота регулируют клиренс инсулина, подавляя его и увеличивая биодоступность инсулина, что, в свою очередь, может вызвать гипогликемию (Hagar и соавт., 2017; Natali и соавт., 2013). Гипогликемия губительна для всех органов, особенно для мозга. Между гипогликемией и смертностью имеется устойчивая связь, при этом четко определено, что гипогликемия возникает у пациентов с острым некрозом печени и является маркером тяжести заболевания (Egi и соавт., 2010).
Таким образом, ВГ имеет огромное значение для пациентов в критическом состоянии, особенно если проиходит развитие гипогликемии. Действительно, при резких колебаниях гликемии нарушается клеточный метаболизм, что может приводить к развитию окислительного стресса. При этом усиливается апоптоз в культурах клеток человека, а также могут развиваться эндотелиальная дисфункция и повреждение сосудов. В моделях на животных ВГ приводила к повышению адгезии моноцитов к эндотелиальным клеткам.
Оценка вариабельности гликемии путем предотвращения гипогликемических событий с использованием более точных биомаркеров может иметь первостепенное значение.
Время в целевом диапазоне гликемии — это недавно появившееся понятие, которое отражает количество времени, в течение которого показатели гликемии у пациента могут находиться в целевом диапазоне. Теоретически целевой диапазон варьируется для каждого пациента и теоретически приближен к более точному медицинскому вмешательству.
в) Дисгликемия у разных тяжелобольных пациентов. Более поздние исследования также подтверждают, что колебания уровня глюкозы крови и/или гипер- и гипогликемия являются независимыми факторами риска смерти у пациентов в критическом состоянии, при этом исследование «Нормогликемия в оценке интенсивной терапии и выживаемости с использованием регулирования алгоритма глюкозы» (NICE-SUGAR) показало, что ИГК также увеличивает смертность в отделениях интенсивной терапии (Finfer и соавт., 2012). В некоторых других исследованиях, напротив, не было продемонстрировано влияние ИГК на уровень смертности (группа исследователей NICE-SUGAR, 2009; Finfer и соавт., 2015; Yang и соавт., 2009; van den Berghe и соавт., 2006; Kalfon и соавт., 2014; Bilotta и соавт., 2009; Krinsley и соавт., 2015; Coester и соавт., 2010). В исследовании NICE-SUGAR апостериорный анализ показал, что повышение смертности коррелировало с увеличением числа эпизодов гипогликемии у пациентов группы интенсивного контроля глюкозы (Egi и соавт., 2010; Hermanides и соавт., 2010; Finfer и соавт., 2012).
При наличии тяжелого заболевания гипергликемия может быть вызвана стрессовыми факторами или плохим контролем хронической гипергликемии. Разные причины гипергликемии могут иметь разный прогноз. Вызванная стрессом гипергликемия может служить наилучшим маркером неблагоприятного прогноза острого заболевания (Capes и соавт., 2001). И гипо-, и гипергликемия могут иметь неблагоприятное прогностическое значение у пациентов, госпитализированных по поводу острого инфаркта миокарда или острого ишемического инсульта в каротидном бассейне (Lee и соавт., 2014; Kosiborod и соавт., 2005; Kim и соавт., 2016). В рамках многоцентровой программы регистрации, включающей 21 центр по лечению инсульта в Китае, пациенты прошли эндоваскулярное лечение острого ишемического инсульта в каротидном бассейне с одновременным обследованием на предмет дисгликемии. У пациентов с диабетом трудно отличить фоновую гипергликемию от стрессовой гипергликемии (Capes и соавт., 2001). Даже при том, что хроническая гипергликемия может повлиять на прогноз, влияние стрессовой гипергликемии более значимо как у пациентов с диабетом, так и у пациентов без диабета (Vanhorebeek и van den Berghe, 2006), поэтому в этом случае пригодится рассчитать коэффициент стрессовой гипергликемии.
Значение коэффициента стрессовой гипергликемии рассчитывается как отношение уровня глюкозы в крови при случайном измерении, деленное на средний уровень глюкозы, который оценивается по гликированному гемоглобину (HbA1c) (Roberts и соавт., 2015). Стрессовая гипергликемия представляет собой уровень относительной гипергликемии и объясняется тяжестью физиологического стресса, а также связана с риском неблагоприятного прогноза. В систематическом обзоре частота стрессовой гипергликемии колебалась от 3% до 71% у лиц, не страдающих диабетом, и от 46% до 84% у пациентов с диабетом (Capes и соавт., 2001). У людей, включенных в исследование реестра пациентов после эндоваскулярного лечения острого ишемического инсульта в каротидном бассейне и перенесших механическую тромбэктомию, традиционная формула коэффициента стрессовой гипергликемии не показала достаточной эффективности для выявления прогностического влияния гипогликемии и гипергликемии, поэтому был введен новый индекс, стратифицирующий пациентов в три разных тертиля. Гликемию измеряли до и после тромбэктомии, HbA1c — сразу после нее, а коэффициент стрессовой гипергликемии рассчитывали по формуле: [глюкоза (мг/дл)/18]/(1,59*HbА1с)—2,59 (Roberts и соавт., 2015). Эта формула для расчета коэффициента стрессовой гипергликемии отражает относительную изменчивость уровня глюкозы в крови.
В исследовании Wang и соавт., включавшем более 300 пациентов после механической тромбэктомии по поводу острого ишемического инсульта в переднем бассейне мозгового кровообращения, согласно среднему значению коэффициента стрессовой гипергликемии пациенты были разделены на три группы тертилей. Гликемия во 2-й группе была наиболее близка к нормальным показателям глюкозы натощак. Напротив, гликемия в 1-й и 3-й группах отражала относительную гипогликемию и относительную гипергликемию соответственно (Wang и соавт., 2017, 2019).
ВГ — это независимый фактор риска смерти у тяжелобольных пациентов. Первоначально она определялась как стандартное отклонение гликемии. ВГ отражает тенденцию к развитию частых скачков уровня глюкозы в плазме крови в течение относительно короткого периода времени и за пределами диапазона, ожидаемого при нормальной физиологической реакции (Braithwaite, 2013). Однако референсные диапазоны для времени и вариабельности колебаний уровня глюкозы в плазме крови для нормального физиологического ответа установить трудно. В ретроспективном исследовании с участием более 7000 пациентов увеличение ВГ служило независимым биомаркером смертности (Egi и соавт., 2006). Дальнейшие наблюдательные исследования подтвердили существование связи между ВГ и смертностью (Farrokhi и соавт., 2014), и в нескольких статьях было показано, что связь между ВГ и смертностью была очевидна у лиц со средними значениями гликемии в пределах от 70 до 99 мг/дл. Этот диапазон обычно считается эугликемическим (Krinsley, 2008). С другой стороны, в некоторых докладах указывается, что ВГ является биомаркером смертности, независимым от метода лечения, используемого для коррекции или поддержания гликемии, или от тяжести критического состояния.
В заключение необходимо отметить, что недавние ретроспективные и наблюдательные исследования также показали тесную связь между повышением ВГ и смертностью. Однако на данном этапе развития науки используются очень разнородные формулы для расчета ВГ. Необходимы дальнейшие исследования для того, чтобы установить, является ли показатель ВГ лишь маркером тяжести заболевания или он может играть важную негативную роль, ускоряя смертельный исход при критических состояниях (рис. ниже).
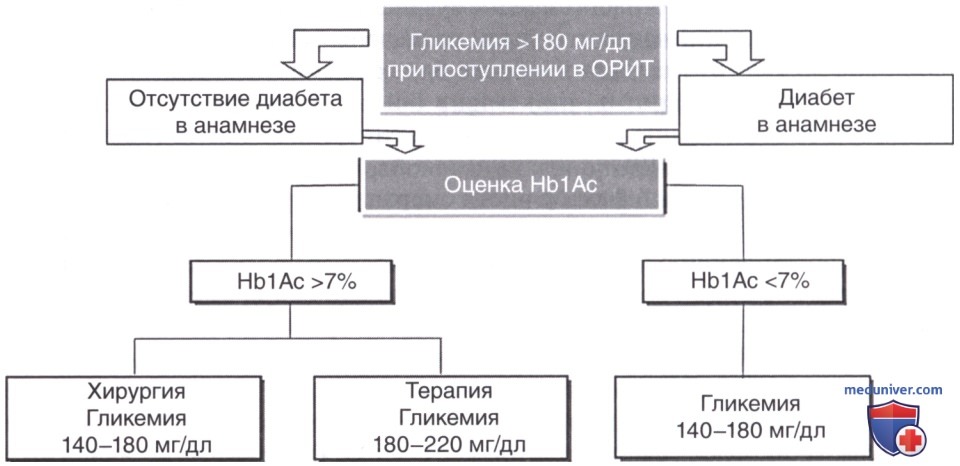
Влияние на смертность периода времени, в течение которого гликемия находится в целевом диапазоне (TITR), было ретроспективно проанализировано у пациентов ОРИТ, включенных в исследование NICE-Sugar. TITR представляет собой процент времени, в течение которого гликемия пациента составляет от 71 до 126 мг/дл в одних исследованиях и от 70 до 140 мг/дл в других. С другой стороны, целевые значения для хирургических пациентов в критическом состоянии несколько отличаются от таковых для пациентов терапевтического профиля. При хронической гипергликемии следует снижать уровень глюкозы более осторожно, учитывая отрицательные результаты строгого гликемического контроля в уже опубликованных крупных РКП. При ретроспективном анализе взаимосвязи между T1TR 71— 126 мг/дл и больничной смертностью наличие TITR более 70% было достоверно сопряжено с увеличением выживаемости пациентов в критическом состоянии (Signal и соавт., 2012).
У хирургических пациентов TITR влияет не только на смертность, но и на сопутствующие заболевания. У пациентов после кардиохирургического вмешательства значение TITR более 80% было ассоциировано со значительно более коротким временем нахождения на искусственной вентиляции легких и пребыванием в ОРИТ, а также со снижением частоты возникновения послеоперационной фибрилляции предсердий и инфицирования операционной раны (Penning и соавт., 2014). Был проведен апостериорный анализ другого очень интересного исследования GluControl (Omar и соавт., 2015). Последний анализ показал, что среди пациентов с TITR выше 50% отмечалась более высокая выживаемость. В GluControl входили как группа вмешательства, так и контрольная группа, исследование было преждевременно завершено в связи с трудностью достижения установленных в нем целевых диапазонов гликемического контроля. В 2015 г. Krinsley и Preiser изучили связь между TITR в диапазоне от 70 до 140 мг/дл и смертностью.
Это исследование интересно тем, что оно является одним из немногих, в которых рассматривались пациенты с диагнозом диабета или без него. Смертность лиц без диабета составляла 15,7% при TITR менее 80% и почти половину от этого значения (8,4%) среди пациентов с TITR более 80%. Удивительно, но такой же связи не было обнаружено у пациентов с диабетом в анамнезе. Следовательно, целью контроля гликемии в настоящее время должно являться снижение ВГ и увеличение TITR более чем на 80% в диапазоне 70—140 мг/дл.
Что касается повышения показателя смертности, что было зарегистрировано у некоторых пациентов в критическом состоянии, которым проводился ИГК, в недавнем метаанализе авторы рассмотрели рандомизированные клинические исследования эффектов ИГК по сравнению с обычным контролем глюкозы, о которых сообщалось в PubMed, EMBASE и Кокрановской библиотеке до декабря 2017 г. (Fu и соавт., 2018). Авторы рассмотрели влияние ИГК на краткосрочную, трех- и шестимесячную смертность, а также на риск развития сепсиса и начала диализа. Было найдено 4247 исследований, но извлечены из них данные 27 исследований, включавших 17 582 госпитализированных по поводу критического заболевания в хирургическое или терапевтическое отделение пациента. В этих исследованиях использовалось два вида вмешательства: непрерывная инфузия инсулина или подкожные инъекции инсулина, а целевой уровень глюкозы крови варьировался в диапазоне от менее 6,9—12,5 ммоль/л в исследуемой группе и в пределах 4,4-6,1 ммоль/л. Для расчета суммарных относительных рисков сопряженных исходов применялись модели случайных эффектов.
В 20 исследованиях были представлены данные, касающиеся ИГК и риска краткосрочной смертности, но почти в половине исследований рассматривалась как краткосрочная, так и 3—6-месячная смертность.
Девять испытаний были включены в анализ ИГК и риска нового диализа, а 13 испытаний предоставили данные, касающиеся анализа ИГК и риска сепсиса. Согласно этому метаанализу, ИГК имеет нейтральный риск краткосрочной или 3—6-месячной смертности, сепсиса или новой потребности в диализе. Существует вероятность того, что нулевой эффект может быть результатом ограниченного числа исследований и ограниченного размера выборки исследований, о которых сообщалось в литературе. Однако у пациентов с ИГК было отмечено значительное увеличение риска гипогликемии и смертности в хирургических, терапевтических и смешанных отделениях ОРИТ (Fu и соавт., 2018).
Таким образом, нарушение гликемии может иметь место при различных критических состояниях. При наличии тяжелого заболевания гипергликемия может быть вызвана стрессовыми факторами или плохим контролем хронической гипергликемии. В развитии стрессовой гипергликемии играют роль чрезмерное повышение выработки глюкозы в печени, глюконеогенез, гликогенолиз и инсулинорезистентность. Кортизол, адреналин и норэпинефрин ответственны за усиление глюконеогенеза в печени и ингибирование поглощения глюкозы периферическими тканями, такими как скелетные мышцы. Действительно, повышение уровня кортизола приводит к продукции глюкозы в печени, стимуляции катаболизма белков с сопутствующим повышением уровней циркулирующих аминокислот в качестве субстрата для глюконеогенеза. Недавно было предложено рассчитывать у тяжелобольных пациентов коэффициент стрессовой гипергликемии (SHR) и время в диапазоне. Время в диапазоне или TITR — это новый показатель, который отражает процент времени, в течение которого уровень гликемии у пациента остается в пределах целевых значений. TITR более 70% достоверно связан с увеличением выживаемости при критическом состоянии.
Что касается ИГК, повышение смертности, зарегистрированное в некоторых докладах, не подтверждается большинством исследований и коррелирует с увеличением числа эпизодов гипогликемии и вариабельности уровня глюкозы в крови, возникающим у пациентов в критическом состоянии при строгом гликемическом контроле, а не на фоне ИГК самого по себе.
- Читать "Синдром низкого Т3 (синдром эутиреоидной патологии)"
Редактор: Искандер Милевски. Дата публикации: 13.2.2023
- Психиатрические проявления заболеваний надпочечников
- Психиатрические проявления заболеваний щитовидной железы
- Психиатрические проявления заболеваний паращитовидных желез
- Психиатрические проявления синдрома поликистозных яичников (СПКЯ)
- Психиатрические проявления сахарного диабета
- Психиатрические проявления ожирения
- Психиатрические проявления лечения гормонами
- Психиатрические заболевания как причина эндокринной патологии
- Нарушение гликемии при критических состояниях
- Синдром низкого Т3 (синдром эутиреоидной патологии)
