Синдром низкого Т3 (синдром эутиреоидной патологии)
а) Общие концепции и оценка. В отделениях интенсивной терапии часто можно наблюдать пациентов с клинической картиной, характерной для нарушений функции щитовидной железы, но отсутствием соответствующих изменений уровня ТТГ. Типичными признаками этого синдрома являются снижение уровня трийодтиронина в крови и низкий или нормальный уровень тироксина при нормальном или незначительно пониженном уровне ТТГ.
В ОРИТ этот комплекс изменений обычно именуется синдромом низкого Т3 или синдромом эутиреоидной слабости, поскольку низкий уровень Т3 в плазме, по-видимому, является начальным и характерным изменением (Wartofsky и Burman, 1982).
Некоторые острые и хронические заболевания, включая инфекционные, сердечно-сосудистые и желудочно-кишечные заболевания, рак, ожоги и травмы, могут приводить к развитию этого синдрома. При остром состоянии вследствие травмы, хирургического вмешательства или инфекционного заболевания расход энергии и катаболизм белков увеличиваются вместе с возрастающей потребностью в витаминах и минералах (Shenkin, 2006; van den Berghe и соавт., 1999).
Схожая с синдромом низкого Т3 картина также встречается у лиц, находящихся на длительном голодании (Longo и Mattson, 2014; Boelen и соавт., 2008; Garruti и соавт., 1995).
В большинстве случаев лечение не требуется (Kerr и соавт., 2017), но существует прямая корреляция между степенью снижения Т3 и прогнозом (Huang и Bianco, 2008). Патогенез этого состояния на первых этапах развития критического состояния может быть связан с реакциями острой фазы как на серьезное ограничение поступления макроэлементов, так и на системное поражение.
Патогенез синдрома низкого Т3 при тяжелых хронических заболеваниях исследовался в разных работах, при этом было установлено, что главную роль в этом процессе играет подавление выработки ТРГ гипоталамусом, который отвечает за нормальный/низкий уровень ТТГ, не реагирующий на нормальные механизмы обратной связи при низких уровнях циркулирующих гормонов щитовидной железы. ТРГ-секретирующие нейроны гипоталамуса считаются основными детерминантами уровня гормонов щитовидной железы (Alkemade и соавт., 2005).
Тем не менее некоторые исследования демонстрируют, что уровень гормонов щитовидной железы может измениться в ответ на воспаление или количество поступающих питательных веществ (Fekete и Lechan, 2007).
Конкретная роль рецептора тиреоидного гормона в развитии синдрома низкого Т3 окончательно не установлена. Однако β-рецепторы тиреоидного гормона обычно регулируются уровнем тиреоидных гормонов по типу отрицательной обратной связи как на уровне гипоталамуса, так и на уровне передней доли гипофиза. При синдроме низкого Т3 этот механизм нарушается. Этот синдром был выявлен у пациентов с острыми и хроническими заболеваниями, включая инфекционные, сердечно-сосудистые и желудочно-кишечные заболевания, рак, ожоги и травмы.
В этих условиях терапия тироксином не приводит к нормализации уровня Т3, при этом инфузия ТРГ сопровождается анаболическими явлениями и способна восстановить нормальную работу системы гипоталамус—гипофиз—щитовидная железа, а также улучшить прогноз. Этот синдром также часто диагностируется у пациентов с инфарктом миокарда. У пациентов, перенесших хирургическое вмешательство на органах брюшной полости, отмечался очень низкий уровень Т3 в крови в первые 2 ч операции (Michalaki и соавт., 2001).
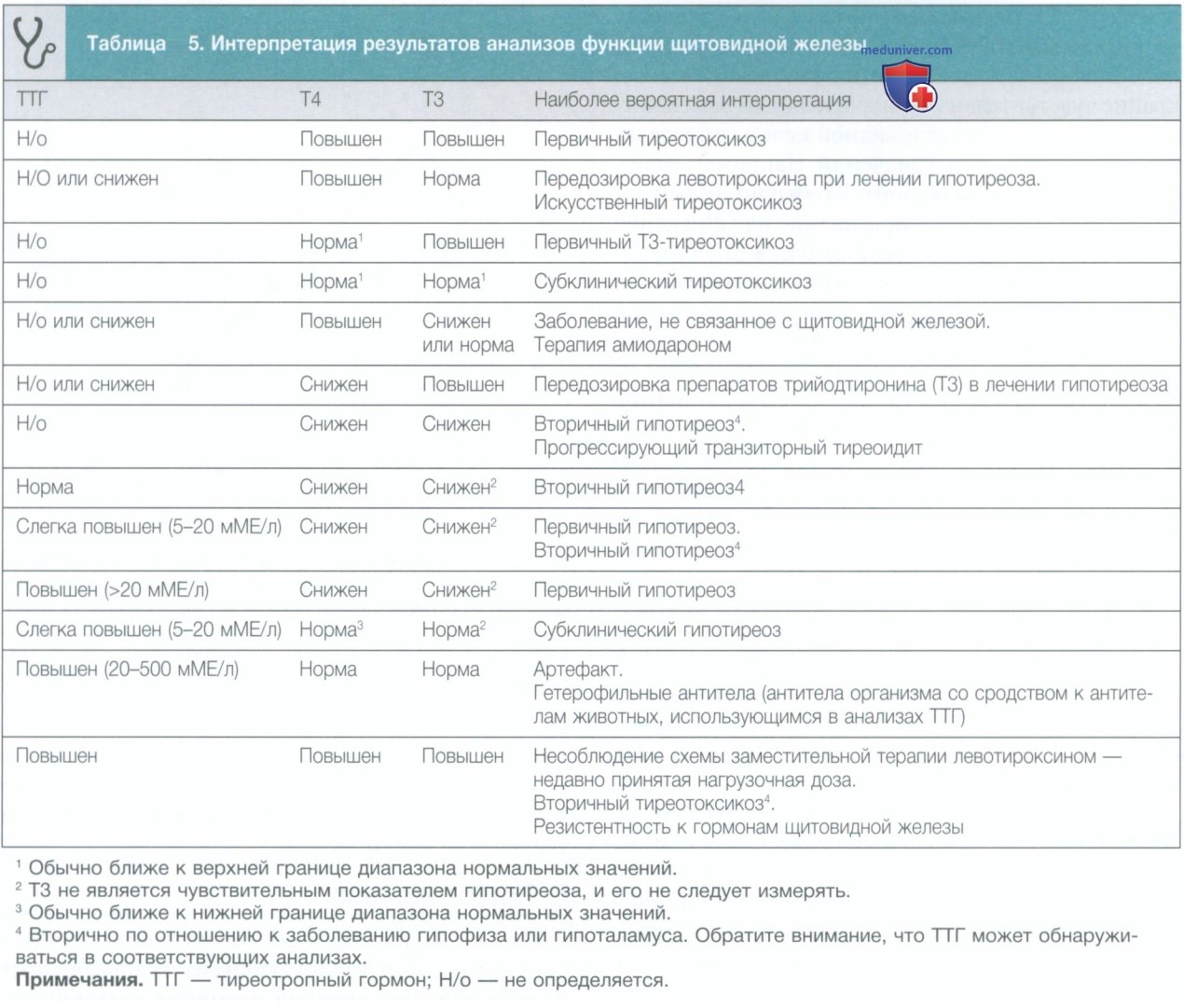
У пациентов в критическом состоянии заметно нарушается метаболизм гормонов щитовидной железы в печени, что объясняет повышенный уровень циркулирующего рТ3 и снижение уровней активных Т3 и Т4 в плазме крови даже при нормальном или слегка пониженном уровне ТТГ. Клинические проявления синдрома могут варьироваться в зависимости от степени поражения периферических тканей, а также продолжительности и тяжести заболевания (Kaptein и соавт., 1987).
В этих периферических изменениях важную роль играет концентрация белков, связывающих тиреоидные гормоны, и дейодиназ (Д). В печени экспрессируются по крайней мере два вида дейодиназ (DIO): DIO1 и DIO3. D1O1 находится в клеточных мембранах и участвует в превращении Т4 в ТЗ, поскольку она участвует в дейодировании как внутреннего, так и внешнего колец Т4. Вместе с тем DIO1 также дейодирует внешнее кольцо рТ3.
В нормальных условиях DIO1 не экспрессируется в печени, но в наглядном исследовании модели воспаления на мышах было продемонстрировано, что экспрессия Д2 в клетках Купфера имеет решающее значение в индукции, опосредованной воспалением активации макрофагов. DIO2 действительно активируется в печени мышей при остром и хроническом воспалении; этот процесс не зависит от сывороточного Т3, но коррелирует с провоспалительным цитокином ИЛ-1β.
Вызванная воспалением экспрессия DIO2 не наблюдалась в гепатоцитах, но была подтверждена в макрофагах и была связана со стимуляцией как монокарбоксилатного транспортера-10 (селективный переносчик тиреоидного гормона), так и а-рецептора тиреоидного гормона (Kwakkel и соавт., 2014).
Интересно отметить, что печень экспрессирует как монокарбоксилатный транспортер-8, так и монокарбоксилатный транспортер-10, а также оба типа тиреоидных рецепторов, а и β. В нормальных условиях DIO1 в печени синтезирует только одну пятую часть циркулирующего ТЗ, однако при синдроме низкого ТЗ снижается количество мРНК Д1 в печени, а активность DIO3 начинает играть ключевую роль в увеличении соотношения рТ3/Т3 (Peeters и соавт., 2005; Boelen и соавт., 2011).
При критических состояниях решающую роль в основных изменениях играет уровень экспрессии DIO в таницитах. При изучении острого воспаления на животных моделях (грызуны) было продемонстрировано, что инъекция липополисахаридов или бактериального эндотоксина сопровождалась локальным превращением Т4 в ТЗ из-за повышения уровня мРНК Д2 в специализированных клетках (таницитах), которые располагаются вдоль границы третьего желудочка (Peeters и соавт., 2005; Lechan и Fekete, 2004; Fliers и соавт., 2006). Как у грызунов, так и у людей повышенный уровень ТЗ в гипоталамусе может подавлять синтез мРНК ТРГ (Boelen и соавт., 2004; Fekete и соавт., 2004).
Патогенная роль ТРГ при синдроме низкого Т3 была выявлена по результатам патологоанатомических исследований, полученных 20 лет назад и показавших, что у этих пациентов экспрессия гена ТРГ в паравентрикулярном ядре однозначно снижена (Fliers и соавт., 1997); при этом увеличение активности D1O2 у людей подтверждено не было. В развитии синдрома низкого Т3 у пациентов в критическом состоянии также играет роль DIO3. Гипоксия и ишемия всегда ассоциированы с повышением активности DIO3, за которым следует усиление катаболизма как ТЗ, так и Т4. По данным вскрытия повышенная экспрессия DIO3 была зарегистрирована при ишемическом повреждении (ишемический инсульт и/или инфаркт миокарда) как на животных моделях, так и у людей (Huang и Bianco, 2008).
Снижение циркулирующих уровней гормонов щитовидной железы положительно коррелирует с тяжестью прогноза. Низкое значение Т3 является надежным предиктором смертности у пациентов с инфарктом миокарда или сердечной недостаточностью (Gerdes и lervasi, 2010). В исследовании тяжелобольных пациентов, классифицированных в соответствии с различными системами оценки (АРАСНЕи TISS), уровень Т4 в сыворотке ниже 40 нмоль/л являлся предиктором смертности с чувствительностью и точностью 75% и 80% соответственно (Arem и Deppe, 1997). При оценке пациентов как по высокому уровню кортизола, так и по низкому уровню Т4 в сыворотке, прогноз смертности достигал чувствительности около 100%, а конкретное значение превышало 80% (Arem и Deppe, 1997).
Трудно понять, сколько состояний, возникающих у тяжелобольных пациентов, связано с развитием анорексии на фоне заболевания и снижением количества потребляемой пищи. У здоровых лиц, подвергающихся длительному голоданию, в органах-мишенях снижается активность DIO1 и повышается активность DIO3, что в конечном итоге приводит к увеличению отношения рТ3/Т3 (Gallon и соавт., 2014). Пр этом также снижается сывороточная концентрация гормонов щитовидной железы, в основном из-за подавления секреции лептина и активности ТРГ-секретирующих нейронов гипоталамуса, что объясняет неадекватное снижение ТТГ в сыворотке (Fekete и Lechan, 2014).
Большое исследование, опубликованное в 2011 г., сравнивало раннее и позднее начало парентерального питания у взрослых в критическом состоянии и продемонстрировало, что ограничение потребления калорий связано с развитием синдрома низкого Т3. В исследовании приняло участие более 4600 взрослых пациентов. Около половины из них начали получать парентеральное питание очень поздно (через 8 дней после поступления в ОРИТ), а оставшаяся половина — намного раньше (через 2 дня после госпитализации) (Casaer и соавт., 2011). В первой группе наблюдалось значительно меньшее количество осложнений, а выздоровление шло быстрее, чем во второй группе.
Однако у пациентов с синдромом низкого Т3 ретроспективный анализ, касающийся только небольшой подгруппы пациентов (280), показал, что, несмотря на более быстрое восстановление, соотношение Т3/рТ3 и уровень ТТГ, по-видимому, хуже у пациентов с поздним началом парентерального питания (Langouche и соавт., 2013). Так или иначе, инактивацию Т3 в рТ3 можно рассматривать как положительный адаптивный ответ на голодание.
б) Первичный гипотиреоз при критических заболеваниях. В отделениях интенсивной терапии возникновение необъяснимой гипотензии может быть признаком гипотиреоидного статуса, который часто игнорируется, поскольку гипотензию ошибочно связывают со снижением объема циркулирующей крови, сепсисом, сердечно-легочной или надпочечниковой недостаточностью. По некоторым данным у пациентов с продолжительной дыхательной недостаточностью, комой и очень низким уровнем артериального давления имел место типичный гипотиреоз, а не синдром низкого Т3. В нескольких клинических исследованиях, касающихся пациентов ОРИТ, было отмечено снижение уровня тироксина (0,24—0,66 нг/дл; референсный интервал 0,93—1,70). Определение низкого уровня тироксина имеет решающее значение для дифференциальной диагностики гипотиреоза и синдрома эутиреоидной патологии.
Согласно некоторым исследованиям у небольшого числа пациентов в критическом состоянии с ТТГ в диапазоне от 2,36 до 7,7 МЕ/мл (референсный интервал 0,27—4,2) (Kumar и соавт., 2018) и очень низким уровнем циркулирующего тироксина (0,24—0,66 нг/дл; референсный интервал 0,93—1,70) внутривенное введение левотироксина натрия (L-T4) в суточной дозе 75—100 мкг давало положительный результат. При этом было подтверждено наличие гипотиреоза, и после лечения L-T4 у пациентов определялось повышение уровня артериального давления и отсутствие необходимости в искусственной вентиляции легких (Kumar и соавт., 2018).
в) Синдром низкого Т3 и его лечение. Пациентам в критическом состоянии при наличии синдрома низкого Т3 иногда назначается терапия тиреоидными гормонами. По данным некоторых исследований при применении Т3 или Т4 (перорально или внутривенно) у этих пациентов улучшения прогноза не отмечалось. Следовательно, невозможно однозначно сделать вывод об их эффективности при лечении тяжелобольных пациентов (Gerdes и lervasi, 2010).
В довольно любопытных исследованиях сравнивали людей с низким уровнем Т4, госпитализированных в отделения интенсивной терапии, с пациентами, перенесшими операцию на сердце, имеющими почечную недостаточность или поступившими с ожогами. Несмотря на неоднородность возраста в группах, эти исследования демонстрируют, что терапия гормонами щитовидной железы часто нормализует циркулирующие уровни свободного Т3 и Т4 (Becker и соавт., 1982; Choi и соавт., 2009, 2013) у тяжелобольных пациентов, однако в этом случае часто обнаруживается, что концентрация Т3 в органах-мишенях (например, в печени) значительно и аномально выше таковой в сыворотке крови и мышцах (Peeters и соавт., 2005). В нескольких исследованиях использовались очень высокие концентрации L-T4 или L-Т3, которые, вероятно, приводили к изменению активности DIO и сильному подавлению синтеза ТТГ.
В исследовании с участием пациентов с острой почечной недостаточностью, получавших L-T4, не только не было выявлено снижение риска необходимости диализа, но и наблюдалась тенденция к увеличению смертности по сравнению с группой контроля. Интересно, что последней группе проводилось интенсивное лечение, и здесь была отмечена более низкая смертность, чем это предполагалось (Acker и соавт., 2000).
В пилотном исследовании введение однократной суточной дозы человеческого рекомбинантного ТТГ (30 мкг) приводило к нормализации уровня ТТГ, качества жизни и сна у пациентов с гипотиреозом, вызванном гипофизарными причинами (Dixit и соавт., 2013). Однако ни в одном исследовании не анализировалось использование рекомбинантного ТТГ у пациентов с синдромом низкого Т3 в критическом состоянии.
С другой стороны, лечение гипоталамическими нейропептидами может принести положительные хорошие результаты. Введение ТРГ было ассоциировано с частичной нормализацией уровня гормонов щитовидной железы в крови и улучшением прогноза. Применение СТГ также приводит к улучшению показателей метаболических маркеров. Внутривенное введение комбинации ТРГ, соматотропин-рилизинг гормона и соматотропин-рилизинг-пептида-2 пациентам, длительно пребывающим в критическом состоянии, успешно восстанавливало уровни циркулирующих гормонов щитовидной железы и циркадный ритм секреции ТТГ. Ацилированный соматотропин-релизинг-пептид также известен как грелин. В целом синдром низкого Т3 связан с недостаточной гипоталамической стимуляцией ТТГ-секретирующих клеток гипофиза.
Это подтверждают данные патологоанатомических исследований, показывающие снижение мРНК ТРГ в паравентрикулярном ядре пациентов, умерших от критического заболевания. У тех же пациентов прижизненный уровень ТТГ и Т3 в плазме коррелировал с низким посмертным уровнем мРНК ТРГ (Fliers и соавт., 1997, 2015).
Исследования нейропептидов гипоталамуса показывают многообещающие результаты, но по-прежнему проводятся над небольшим количеством пациентов. Тем не менее по этическим причинам РКИ, сравнивающие лечение ТРГ и/или СТГ-РГ с плацебо, все еще отсутствуют (van den Berghe и соавт., 1999).
Таким образом, синдром низкого Т3 может иметь место при различных критических состояниях. С клинической точки зрения он характеризуется изменениями концентрации гормонов щитовидной железы в периферическиих тканях как вследствие нарушения регуляции системы гипоталамус-гипофиз-щитовидная железа, так и изменения их локального метаболизма на фоне воспаления. В зависимости от внешних факторов/особенностей питания (продолжительность голодания, парентеральное питание) и тяжести критических состояний, изменения при синдроме низкого Т3 могут влиять или не влиять на прогноз. Для окончательного определения наиболее успешного терапевтического подхода необходимы рандомизированные контрольные испытания; однако использование гипоталамических нейропептидов (например, ТРГ) кажется многообещающим с точки зрения результатов лечения.
- Вернуться в раздел "Эндокринология"
Редактор: Искандер Милевски. Дата публикации: 13.2.2023
- Психиатрические проявления заболеваний надпочечников
- Психиатрические проявления заболеваний щитовидной железы
- Психиатрические проявления заболеваний паращитовидных желез
- Психиатрические проявления синдрома поликистозных яичников (СПКЯ)
- Психиатрические проявления сахарного диабета
- Психиатрические проявления ожирения
- Психиатрические проявления лечения гормонами
- Психиатрические заболевания как причина эндокринной патологии
- Нарушение гликемии при критических состояниях
- Синдром низкого Т3 (синдром эутиреоидной патологии)
