Влияние половых гормонов на печень
Половые гормоны влияют на метаболические функции в печени посредством прямых (например, экспрессия рецепторов андрогенов и эстрогенов в тканях печени как мужчин, так и женщин) или косвенных эффектов. Половые гормоны могут способствовать развитию заболеваний печени (в частности, стеатоза печени, НАСГ, рака печени), которые имеют различную распространенность в зависимости от пола или уровня половых гормонов в крови (то есть в период пре- или постменопаузы).
Более того, одни и те же гормоны могут оказывать различное воздействие на мужчин и женщин. Как показали исследования на животных, андрогены препятствуют ожирению у самцов, но способны вызывать накопление жира в печени у самок животных (Grossmann и соавт., 2019).
Напротив, нарушение функции печени может влиять на концентрацию половых гормонов и на репродуктивную функцию. Механизмы включают нарушение метаболизма половых стероидов и изменения транспорта гормонов к органам-мишеням, вторичные по отношению к нарушению синтеза глобулина, связывающего половые гормоны (ГСПГ) (Grossmann и соавт., 2019).
Следует отметить, что у пациентов с хроническими заболеваниями печени и нарушенной репродуктивной функцией трансплантация печени может восстановить адекватный гормональный гомеостаз, улучшая эндокринную и половую функцию (Gariani и соавт., 2016).
а) Эстрогены. У мужчин эстрогены играют центральную роль в метаболизме липидов в печени и профилактике стеатоза печени. Эстрогены обладают множеством эффектов, они снижают доставку жирных кислот, уменьшают липогенез de novo, увеличивают липидный метаболизм за счет окисления жирных кислот, увеличивают синтез и экспорт триглицеридов липопротеинов очень низкой плотности и модулируют резистентность к инсулину, подавляя глюконеогенез в печени (Grossmann и соавт., 2019).
Эксперименты на животных моделях показывают, что у самок овариэктомия способствует развитию стеатоза печени и инсулинорезистентности и оба состояния могут быть обратимы при введении эстрадиола (D’Eon и соавт., 2005; Zhu и соавт., 2013) через его влияние на ERa (Wang и соавт., 2015).
Эпидемиологические исследования у женщин подтвердили защитную роль эстрогенов в отношении стеатоза печени. В большой когорте из 4338 женщин в возрасте 20—60 лет общая взвешенная распространенность НАЖБП была ниже в группе, получающей оральные контрацептивы (6,7%), по сравнению с группой, принимавшей их в прошлом (12%) или никогда их не использовавших; при этом, после поправки на вмешивающиеся факторы, текущий прием препаратов приводил к снижению шанса развития НАЖБП на 50% по сравнению с пациентками, никогда не принимавшими оральные контрацептивы (Liu и соавт., 2013).
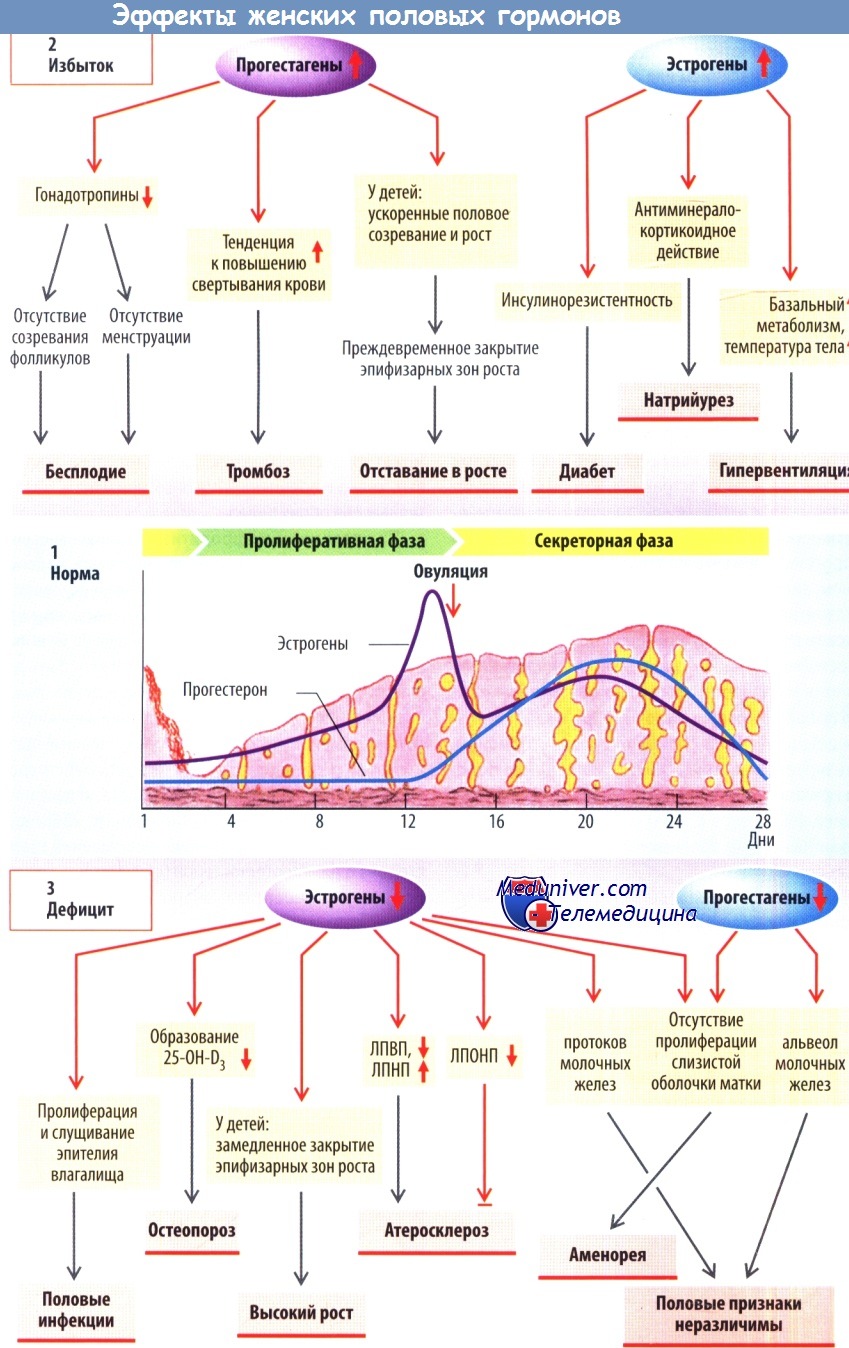
Риск развития НАЖБП у женщин в предменопаузе ниже, чем у мужчин (Pan и Fallon, 2014), но сообщалось о двукратном увеличении риска НАЖБП и стеатогепатита у молодых людей после хирургической или химически индуцированной менопаузы (Palmisano и соавт., 2017).
Таким образом, эстрогены играют важную роль в предотвращении метаболических изменений, ведущих к накоплению жира в печени, но только при условии функционирования яичников, так как во время менопаузы наблюдается растущий дефицит эстрогенов (Brady, 2015). Дефицит эстрогена также может усиливать воспалительные изменения в печени, приводящие к фиброзу, который может возникать у женщин в постменопаузе (Ballestri и соавт., 2017).
Однако эстрогены также могут влиять на экспортирующую помпу желчных кислот и ингибировать переносчики желчных кислот гепатоцитов, способствуя развитию холестаза. В частности, печень играет центральную роль в метаболизме эстрогенов, и, как показали исследования на животных, метаболиты эстрогена (в частности, эстрадиол-17β-глюкуронид) способствуют развитию холестаза посредством механизмов, включающих экспортирующую помпу желчных кислот и белок множественной лекарственной устойчивости 2 (Huang и соавт., 2000).
Следует отметить, что ингибирование экспортирующей помпы желчных кислот может развиваться не только на фоне терапии эстрогенами, но также и при физиологических состояниях, приводящих к повышению уровня эстрогена, таких как беременность (внутрипеченочный холестаз во время беременности) (Stieger, 2010).
Повышенный уровень эстрогена при беременности или приеме оральных контрацептивов может спровоцировать развитие синдрома Бадда—Киари у пациентов с тромбофилией (Peramau и Bacq, 2008).
Кроме того, сообщалось о повышении уровня эстрогена у мужчин с циррозом печени, в основном вторично из-за повышенной периферической ароматизации тестостерона в эстроген и нарушения метаболизма и выведения гормонов печенью (Sinclair и соавт., 2015).
Повышенный риск образования холестериновых желчных камней у женщин связан с метаболизмом эстрогенов в печени. В частности, эстроген способен увеличивать печеночную секрецию билиарного холестерина и, в свою очередь, увеличивать насыщение желчи холестерином, что предрасполагает к образованию желчных камней. Следует отметить, что, согласно исследованиям на животных, при применении высоких доз 17-β-эстрадиола только ЭР1 в печени, но не ЭР2, играет ключевую роль в повышении риска образования желчных камней.
В связи с этим недавно была подчеркнута роль нового рецептора эстрогена, G-белок-сопряженного рецептора 30, члена суперсемейства семи трансмембранных G-белок-сопряженных рецепторов (Wang и соавт., 2009).
б) Андрогены. У мужчин андрогены играют защитную роль в отношении развития жирового гепатоза, при этом дефицит андрогенов (то есть низкий уровень тестостерона) ассоциирован с метаболическим синдромом и НАЖБП.
Как показали исследования на животных, орхиэктомия способствует развитию инсулинорезистентности и накоплению жира в печени, с обратным развитием на фоне лечения тестостероном (Николаенко и соавт., 2014; Xia и соавт., 2013), в основном за счет снижения синтеза липидов de novo в печени, повышенному окислению жирных кислот и экспорту жира из печени (Jia и соавт., 2018; Senmaru и соавт., 2013), подавлению воспалительных процессов в печени (Schwinge и соавт., 2015) и эпигенетических механизмов (т.е. экспрессия генов участвует в метаболизме липидов и глюкозы) (Cai и соавт., 2015).
Также была выявлена связь между уровнями циркулирующего тестостерона и стеатозом печени у людей. В частности, у человека более низкие уровни тестостерона в крови ассоциированы с высокой частотой развития стеатоза независимо от возраста, потребления алкоголя и индекса массы тела (Jaruvongvanich и соавт., 2017; Kim и соавт., 2012; Volzke и соавт., 2010; Yim и соавт., 2018).
Риск развития НАЖБП также увеличивается после проведения андроген-депривационной терапии, как показано у мужчин, лечившихся от рака простаты (Gild и соавт., 2018), или из-за более низких уровней циркулирующего ГСПГ (Jaruvongvanich и соавт., 2017).
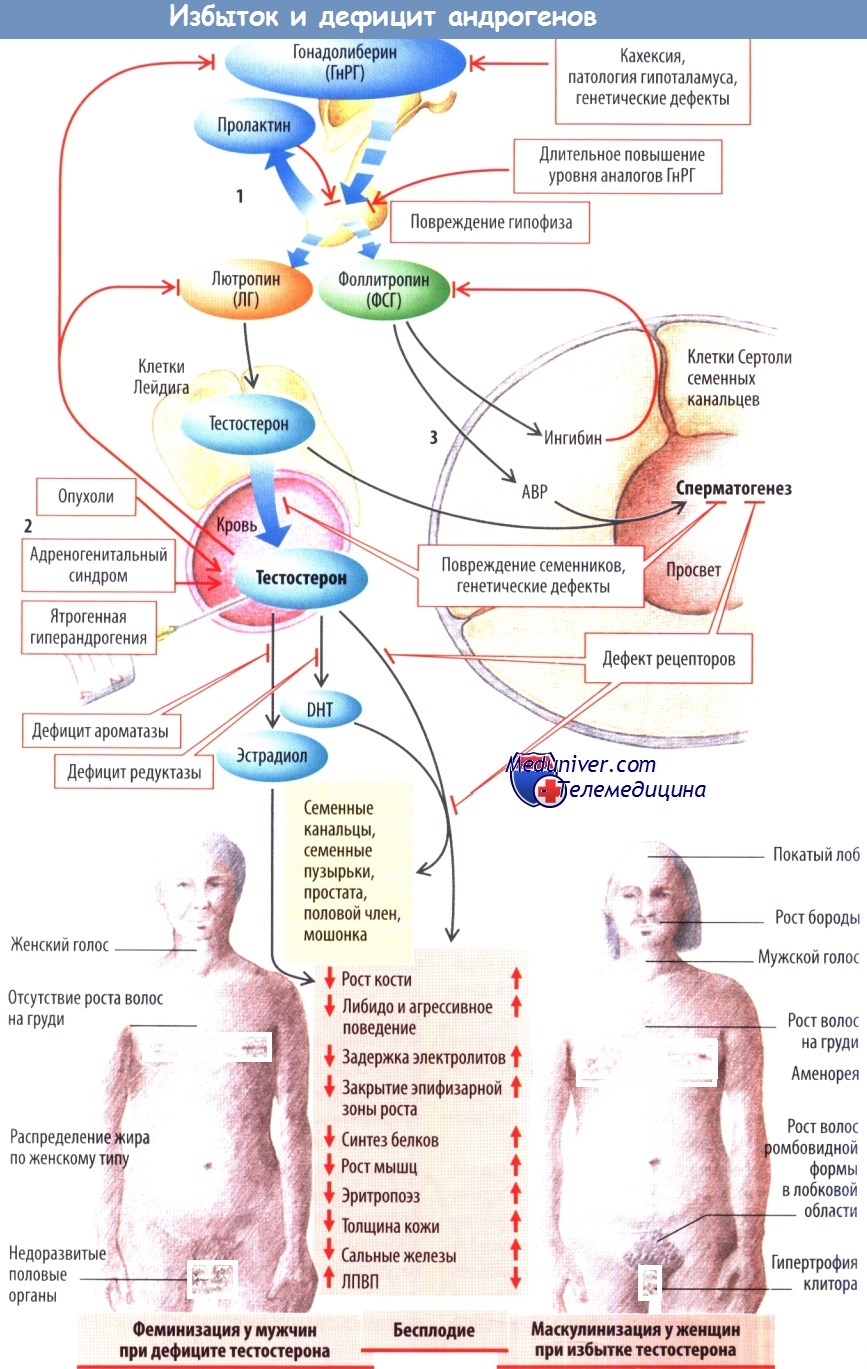
Исследования на самках животных показали, что как пренатальное, так и послеродовое воздействие андрогенов способствует ожирению печени и инсулинорезистентности, в основном вторично по отношению к измененному глюконеогенезу в печени и усилению регуляции провоспалительных белков (Grossmann и соавт., 2019).
Исследования на людях показали, что увеличение количества циркулирующих андрогенов у женщин в пред- или постменопаузальном периоде ассоциировано с наличием жировой ткани в печени (Jaruvongvanich и соавт., 2017; Sarkar и соавт., 2017). Также была показана обратная связь между уровнем циркулирующего ГСПГ и ожирением печени (Jaruvongvanich и соавт., 2017; Wang и соавт., 2016).
в) Нарушение работы половых желез и заболевания печени. У пациентов с циррозом печени нарушена работа осей гипоталамус-гипофиз-надпочечники и гипоталамус-гипофиз-половые железы, а также секреция пролактина. В частности, оценка по шкале Чайлда-Пью напрямую коррелирует с уровнем пролактина и отрицательно связана с уровнем свободного тестостерона (Zietz и соавт., 2003).
При циррозе печени низкий уровень тестостерона встречается часто (до 90%). Как следствие, у пациентов с запущенным циррозом печени проявляются системные эффекты, аналогичные тем, которые наблюдаются у мужчин с гипогонадизмом (например, гинекомастия, низкое либидо, атрофия яичек, саркопения, остеопороз) (Sinclair и соавт., 2015).
г) Синдром поликистозных яичников (СПКЯ). СПКЯ — одна из наиболее частых эндокринопатий у женщин репродуктивного возраста (Panidis и соавт., 2013). По пересмотренным критериям его распространенность составляет до 18% (Роттердам, 2004). СПКЯ традиционно связан с гиперандрогенией и некоторыми признаками метаболического синдрома и сердечно-сосудистых заболеваний. Как частое проявление метаболического синдрома, во всем мире НАЖБП ассоциируется с ожирением, сердечно-сосудистыми заболеваниями и сахарным диабетом 2-го типа (Molina-Molina и соавт., 2018, 2019; Schwimmer и соавт., 2008) и СПКЯ (Hossain и соавт., 2011).
Наличие инсулинорезистентности связано как с СПКЯ, так и с НАЖБП (Роттердам, 2004). Авторы сообщили, что неинвазивные маркеры стеатоза печени (например, оценка жировой ткани печени при НАЖБП, продукты накопления липидов и индекс стеатоза печени) были значительно выше при СПКЯ. Это особенно верно при наличии метаболического синдрома. Показатели фиброза печени, т.е. FIB-4, индекс соотношения аспартатаминотрансферазы и тромбоцитов, шкала ВААТ (ИМТ, возраст, АЛТ, триглицериды) и шкала BARD (соотношение аспартатаминотрансфераза/аланинаминотрансферазы к ИМТ при диабете) были более спорным (Polyzos и соавт., 2014).
Проспективное исследование пациенток с СПКЯ без текущего медикаментозного лечения показало наличие инсулинорезистентности в 63% случаев и НАЖБП у 41,5% включенных субъектов (Cerda и соавт., 2007).
Однако ожирение и инсулинорезистентность не являются единственными факторами, способствующими развитию НАЖБП у пациентов с СПКЯ, также была описана существенная роль повышения уровней свободного и общего тестостерона (Vassilatou и соавт., 2014). Сообщалось о более высокой частоте развития НАЖБП у пациентов с гиперандрогенией по сравнению с пациентами без нее (Jones и соавт., 2012). Таким образом, у пациенток с СПКЯ часто отмечается повышенный риск развития НАЖБП.
В частности, женщины с СПКЯ имеют повышенный риск развития НАЖБП, а НАЖБП у женщин может быть фактором риска СПКЯ (Баранова и соавт., 2011). В дополнительных исследованиях следует оценить отдаленные исходы показателей стеатоза и фиброза печени у женщин с СПКЯ.
д) Резюме. Печень участвует в регуляции нескольких системных гомеостатических механизмов, главным образом посредством своих метаболических функций, и, как вторичный эндокринный орган, является важной частью сложной системы, включающей первичные эндокринные органы и их органы-мишени, как с точки зрения метаболизма гормонов, так и с точки зрения передачи сигналов. Таким образом, нарушение функции печени приводит к изменению в работе почти всех гормональных систем.
С другой стороны, печень является основной мишенью для ряда эндокринных заболеваний, а нарушение уровней гормонов может способствовать повреждению печени, начиная от жирового гепатоза и заканчивая гепатитом, холестатической болезнью, фиброзом, циррозом и злокачественными новообразованиями. Некоторые из молекулярных механизмов, ответственных за сложное взаимодействие между гормональной системой и печенью, все еще находятся в стадии изучения.
В ближайшем будущем полное понимание этих взаимосвязей может позволить разработать новые стратегии лечения, полезные для первичной профилактики повреждения печени, вторичного по отношению к гормональной дисфункции, и, с другой стороны, для лечения измененных эндокринных функций, наблюдаемых у пациентов с хроническими заболеваниями печени.
- Читать "Влияние эндокринных заболеваний на желудочно-кишечный тракт"
Редактор: Искандер Милевски. Дата публикации: 16.1.2023
