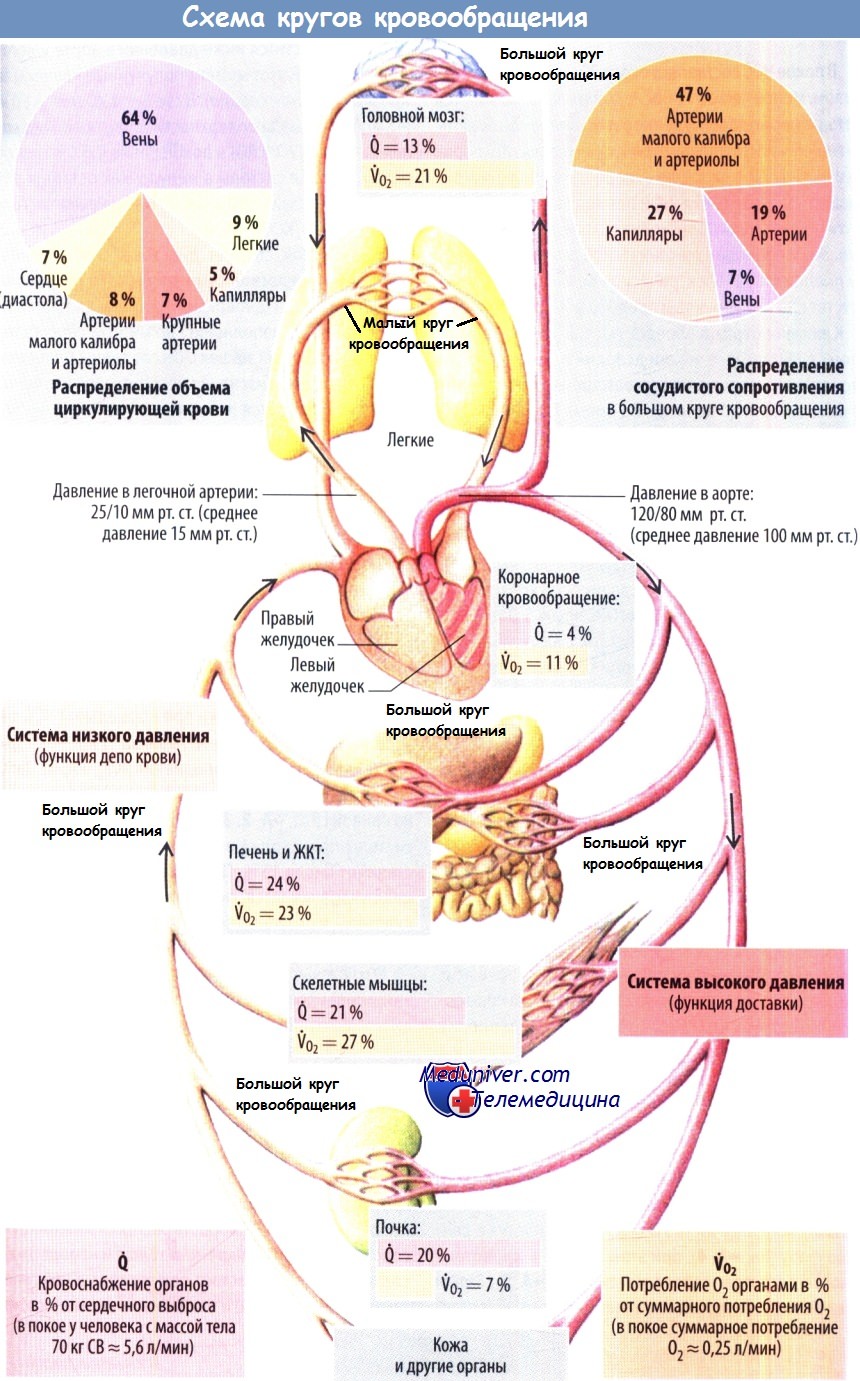
Физиология кровотока в легких - регуляция тонуса сосудов легкого
В норме сопротивление в легочном сосудистом русле составляет < 1/10 сопрот ивления системного кровотока. Сосудистое сопротивление обычно вычисляют (по аналогии с законом Ома) как отношение градиента давления (ДР, мм рт. ст.) к средней объемной скорости кровотока (Q, л/мин) и выражают в единицах Wood в честь английского кардиолога Paul Wood. Это отношение обычно умножают на 80, чтобы представить результаты в единицах дин x сек x см % В норме расчетное ЛСС у взрослых составляет 67 ± 23 SD дин х сек х см-5, или 1 единицу Wood.
а) Гипоксия. Воздействие кислорода на сосудистую сеть легких — это та основная характеристика, которая отличает сосуды малого круга кровообращения от сосудов большого круга. Легочная вазоконстрикция в ответ на гипоксию является важным адаптивным механизмом в физиологии человека. Вследствие альвеолярной гипоксии происходит локальная вазоконстрикция, что приводит к перемещению кровотока от участков гипоксии в вентилируемые части легких, тем самым улучшая вентиляционно-перфузиопный баланс.
Несмотря па то что в острых случаях этот адаптивный механизм работает во благо, хроническая гипоксемия может привести к постоянному повышению давления в ЛА, ремоделированию сосудов и развитию ЛГ. Один из механизмов развития гипоксической легочной вазоконстрикции заключается в подавлении калиевых потоков и деполяризации мембран гладкомышечных клеток легочных сосудов вследствие изменения сульфгидрильного окислительно-восстановительного статуса. Калиевые, кальциевые и хлорные каналы играют важную роль в формировании легочного сосудистого тонуса и меняются в результате местных изменений напряжения кислорода в легочном кровотоке. Увеличение потока ионов Са2+ в гладкомышечные клетки сосудов, по-видимому, участвует в развитии гипоксической легочной вазоконстрикции.
Концентрация Са2+ обусловлена равновесием между притоком и оттоком Са2+ через клеточную мембрану и внутриклеточным высвобождением и поглощением. Внутри клетки Са2+ может высвобождаться из саркоплазматического ретикулума и митохондриальных мембран или внутренней стороны клеточной мембраны. Несмотря на то что большинство фактов свидетельствуют о поступлении Са2+ из внеклеточной жидкости, вклад различных внутриклеточных источников остается неясным. Механизмы, ответственные за внутриклеточное высвобождение Са2+, также неизвестны. Острая гипоксия вызывает обратимые изменения сосудистого тонуса, а хроническая гипоксия приводит к структурной перестройке сосудов.
В ремоделировании сосудов легких, вызванном гипоксией, участвует также ряд факторов роста, включая эндотелии и серотонин. В экспериментальных моделях у крыс, перенесших гипоксию, повышается уровень PDGF А и В. При хронической гипоксии также повышается уровень сосудистого эндотелиального фактора роста (VEGF) — специфического митогена эндотелиальных клеток. VEGF, вероятно, причастен к повреждению легочных сосудов и пролиферации клеток эндотелия в условиях хронического гипоксического ремоделирования сосудов легких в силу высокой проникающей способности и способности стимулировать ангиогенез и воспаление, а также специфичности к эндотелиальным клеткам.
Гипоксия-индуцибельный фактор 1 — жизненно важное звено между чувствительностью к кислороду, генной транскрипцией и физиологической адаптацией к хронической гипоксии in vivo. Гипоксия-индуцибельный фактор 1 был распознан как ядерный фактор, который индуцируется в условиях гипоксии и связывается с эритропоэтин-чувствительными элементами. Экспрессия гипоксия-индуцибельного фактора 1 строго регулируется давлением кислорода в клетках. Классическим примером адаптации организма к хронической гипоксии является повышение уровня эритропоэза, опосредованного эритропоэтином — гликопротеиновым гормоном роста.
б) Альверлярная оксигенация. Изменения альвеолярной оксигенации влияют на мелкие ЛА и артериолы посредством прямой диффузии газов из альвеол, дыхательных бронхиол и альвеолярных протоков в легочных артериолах, несмотря на то что последние расположены «вверх по течению» по отношению к альвеолам. Этот факт, а также данные о снижении объема кровотока в ЛА при гипоксии свидетельствуют о том, что вазоконстрикция и повышенное сопротивление в легочном кровотоке наблюдаются в основном в мелких легочных артериях и артериолах. Хотя давление кислорода в альвеолах — главная физиологическая детерминанта сосудистого тонуса ЛА, снижение давления кислорода в смешанной венозной крови, протекающей по мелким легочным артериям и артериолам, также может способствовать вазоконстрикции ЛА.
Ацидоз увеличивает ЛСС и действует синергично с гипоксией. С другой стороны, повышение парциального давления углекислого газа в артериальной крови (РаCO2), похоже, не оказывает прямого воздействия на вазокон-стрикцию, но действует опосредованно путем повышения концентрации ионов Н+. Гипоксия и ацидемия часто сочетаются, их взаимодействие обусловливает предсказуемый исход, что клинически очень важно.
в) Адренергический контроль кровотока в легких. Сосудистая система легких снабжена α- и β-адренорецепторами, которые участвуют в регуляции сосудистого тонуса ЛА, обеспечивая, соответственно, вазокон-стрикцию и вазодилатацию. α1-Адренорецепторы в ЛА отличаются большими сродством и реактивностью в отношении своих агонистов, чем в других сосудах. При воздействии на α1-адренорецепторы в клетку начинают поступать ионы Са2+, оказывая прямое возбуждающее действие, активируется протеинкиназа, которая участвует в реализации сосудистой реакции — сократительной и пролиферативной. Повышенная чувствительность с α1-адренорецепторов в ЛА к норадреналину может способствовать местной регуляции сосудистого тонуса в ответ на острые изменения концентрации кислорода путем регулирования объема регионарной перфузии.
Возбуждение α1-адренорецепторов приводит к повышению уровня внутриклеточного свободного кальция: (1) путем связывания со специфическим G-белком на клеточной мембране; (2) путем блокады каналов ионов калия. Чрезмерное возбуждение α1-адренергических рецепторов приводит к сокращению гладких мышц, их пролиферации и росту. Факторы, увеличивающие синтез, плотность и активность гена α1-адренорецепторов, во многом способствуют усилению сократительных и пролиферативных реакций гладких мышц ЛА. К таким факторам относятся норадреналин, средства, подавляющие аппетит, и кокаин.
Блокаторы α1-адренергических рецепторов фентоламин и толазолин снижают ЛСС, как и стимуляторы β-aдренергических рецепторов, например изопротеренол. Однако блокада β-адренорецепторов, напротив, не влияет на ЛСС, что свидетельствует о том, что нет необходимости в стимуляция фадренергических рецепторов для поддержания нормального низкого уровня ЛСС. Ацетилхолин — мощный релаксант легочных артерий и артериол, приводящий к кратковременному снижению сосудистого сопротивления ЛА у пациентов с повышенным ЛСС с вазореактивным компонентом.
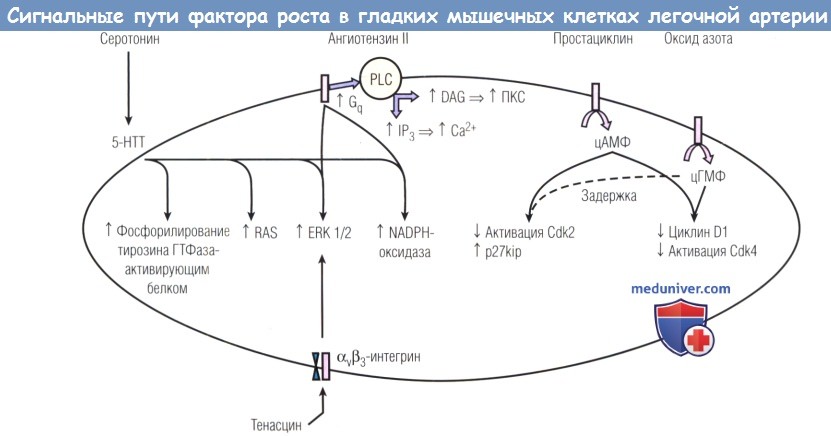
Веществами, участвующими в этом механизме, являются серотонин, ангиотензин II, простациклин, оксид азота, матричный белок тенасцин и αvβ3-интегрин.
Несмотря на активацию ими разных путей внутриклеточной передачи сигналов, все они влияют на рост ГМК.
5-НТТ — транспортер 5-гидрокситриптамина; DAG — диацилглицерол; ERK — внеклеточная сигнал-регулируемая киназа;
Gq — белок Gq; IР3 — инозитол-1,4,5-трифосфат; NADPH — восстановленный никотинамидадениндинуклеотидфосфат;
PLC — фосфолипаза С; RAS — ренин-ангиотензиновая система; ГТФаза — гуанозинтрифосфатаза; ПКС — протеинкиназа С; цАМФ — циклический аденозинмонофосфат; цГМФ — циклический гуанозинмонофосфат.
г) Сосудистые медиаторы регулирующие кровоток в легких. В процессе сосудистой медиации задействованы сигнальные пути фактора роста.
1. Простогландины. Легочная ткань принимает активное участие в синтезе, метаболизме и выделении ряда простагландинов, компонентов регуляции ЛСС. ПГ-I2 (простациклин) и ПГ-Е1 — активные легочные вазоди-лататоры, в то время как ПГ-F2α и ПГ-А2 являются вазоконстрикторами. Простациклину и тромбоксану приписывается контррегуляторная роль в легочном кровообращении. Простациклин действует через мембранные G-белок-сопряженные рецепторы и связанные с ними различные сигнальные пути.
В клетках легочного эндотелия накапливается простациклинсинтаза, в тромбоцитах — тромбоксансинтаза. Оба эти фермента превращают циклические прекурсоры эндопероксидов ПГ-G2 и ПГ-Н2 в специфические биоактивные эйкозаноиды. Простациклин — мощный вазодилататор и ингибитор агрегации тромбоцитов путем активации циклического аденозинмонофосфата (цАМФ). Время метаболического полураспада последнего в кровотоке меньше, чем время кровообращения, а образовавшийся метаболит 6-кетопростагландин F1α обладает небольшой биологической активностью.
Высвобождение простациклина эндотелиальными клетками приводит к расслаблению подлежащих гладких мышц сосудистой стенки и предупреждает агрегацию тромбоцитов в кровотоке. У тромбоксана, который синтезируется в тромбоцитах и макрофагах, также короткое время полураспада. Тромбоксан — мощный агонист агрегации тромбоцитов и вазоконстрикции, и он также через сигнальные пути, связанные с протеинкиназой С, может действовать как фактор роста для ГМК.
2. Оксид азота. Механизм биологического действия оксида азота (NO) сходен с действием простациклина в расслаблении гладких мышц сосудов. Разница в том, что эффект NO опосредован нарастающим количеством циклического гуанозинмонофосфата (цГМФ). В эндотелии здоровой сосудистой системы легких находится эндотелиальная синтаза оксида азота (eNOS), которая ответственна за образование NO и регуляцию сосудистого тонуса. Высвобождение NO происходит в ответ на множество физиологических раздражителей, таких как тромбин, брадикинин и напряжение сосудистой стенки. В дополнение к своему прямому гемодинамическому действию NO ингибирует активацию тромбоцитов, обеспечивая тем самым антитромботические свойства поверхности эндотелия. NO также ингибирует рост ГМК сосудов и, по всей вероятности, участвует в ремоделировании сосудов в ответ на поражение.
NO играет также важную роль в преобразовании сигнала при ангиогенезе, а активация VEGF-рецепторов приводит к увеличенной продукции NO.
3. Эндотелин. Эндотелин (ЭТ) — мощный митогенный и сосудосуживающий пептид, который также участвует в регуляции сосудистого тонуса. ЭТ-1 — наиболее активная изоформа эндотелина в сердечно-сосудистой системе, образующаяся в результате превращения предшественников эндотелина в «большой эндотелии», а потом — в ЭТ-1. ЭТ-1 выделяется эндотелиальными клетками и высвобождается на поверхность подлежащих ГМК, осуществляя паракринное действие на рецепторы гладких мышц сосудов. ЭТ-1 также выделяется ГМК и кардиомиоцитами. ЭТ-1 обладает вазоконстрикторным и митогенным эффектами, стимулирует выделение таких факторов роста, как VEGF и основной фактор роста фибробластов, а также потенцирует действие трансформирующего фактора роста бета (TGFβ) и PDGF. Биосинтез ЭТ-1 регулируется такими физиологическими и химическими факторами, как скорость кровотока, пульсовое растяжение, гипоксия и уровень тромбина. Эндогенные ингибиторы синтеза ЭТ-1 — оксид азота и простациклин.
Основное воздействие ЭТ-1 на сосуды осуществляется путем активации двух G-белок-сопряженных рецепторов — ЭТA и ЭТВ. ЭТA-рецепторы расположены в средних слоях гладких мышц кровеносных сосудов и миокарде предсердий и желудочков. При возбуждении ЭТA-рецепторов повышается уровень внутриклеточного кальция, что вызывает вазоконстрикцию и клеточную пролиферацию. ЭТВ-рецепторы расположены на эндотелиальных клетках и частично на ГМК и макрофагах. Активация ЭТВ-рецепторов стимулирует высвобождение эффективных вазодилататоров — NO и простациклина, которые обладают антипролиферативными свойствами и предотвращают апоптоз. В норме ЭТВ-рецепторы на эндотелиальных клетках опосредуют поддержание равновесия между продукцией и клиренсом циркулирующего эндотелина, поддерживая его низкий уровень.
4. Серотонин в регуляции легочного кровотока. Серотонин — главный компонент плотных тромбоцитарных гранул, который выделяется при их активации. Серотонин является вазоконстриктором, способствующим гипертрофии и гиперплазии ГМК. В норме эндотелиальные клетки реагируют на выделение серотонина повышенным выделением NO, что приводит к расслаблению гладких мышц сосудов и вазодилатации. При эндотелиальной дисфункции серотонин не в силах стимулировать высвобождение NO, что приводит к повышению тонуса гладких мышц сосудов и, следовательно, к вазоконстрикции. Кроме того, серотонин может действовать как фактор роста, участвуя в гипертрофии медиального слоя и способствуя ремоделированию сосудов.
5. Ангиотензин II. Ангиотензин II — это белок, который образуется в легких из ангиотензина I путем его ферментного преобразования и является мощным легочным вазоконстриктором. Ангиотензин II стимулирует пролиферацию клеток, синтез белков внеклеточного матрикса и миграцию ГМК. В эксперименте у крыс, находящихся в состоянии хронической гипоксии, развитие легочной гипоксии и ГПЖ связано со значительным повышением активности мембраносвязанного АПФ ПЖ. У крыс в ЛА с гипертрофией медиального слоя в условиях хронической гипоксии наблюдается очаговое повышение содержания белка АПФ и экспрессии матричной рибонуклеиновой кислоты (мРНК). У пациентов с ЛГ также отмечается повышение иммунореактивности АПФ в местах повышенной экспрессии матриксных генов в пораженных ЛА.
6. Кровообращение плода и новорожденного. В организме плода кровь, насыщенная кислородом, поступает в сердце через нижнюю полую вену и устремляется сквозь овальное окно в ЛП, ЛЖ, восходящую аорту и краниальные сосуды. После прохождения через ткани ненасыщенная кислородом кровь возвращается по верхней полой вене и проходит через трехстворчатый клапан в ПЖ и ЛА. Поскольку сопротивление в сосудистом русле спавшихся легких плода чрезвычайно высокое, только 10-30% общего потока крови из ПЖ проходит через легкие, оставшаяся часть попадает через артериальный проток в нисходящую аорту, а потом обратно в плаценту.
В момент рождения происходят резкие изменения в легочном кровообращении новорожденного. С первым вдохом легкие расправляются, и резкое повышение парциального давления кислорода (РO2) в крови приводит к исчезновению вазоконстрикции легочных артериол, а также к растяжению и расширению мышечных легочных артерий и артериол и заметному снижению сосудистого сопротивления. Такое снижение способствует увеличению легочного кровотока и повышению объема и давления в ЛП. Последнее приводит к захлопыванию клапана овального окна, а межпредсердный шунт справа налево обычно закрывается в течение первого часа жизни. В норме артериальный проток закрывается в течение последующих 10 час в результате сокращения толстых связок гладких мышц в толще сосудистых стенок в ответ на повышение напряжения кислорода в артериальной крови и изменения концентрации простагландинов.
Вслед за резким падением ЛСС в момент рождения происходит его снижение в течение первых нескольких месяцев жизни, связанное с истончением медии мышечных легочных артерий и артериол, до достижения значений, нормальных для взрослых людей.
Учебное видео анатомия кровообращения у плода
7. Старение легочного кровотока. У пожилых людей легочный ствол слегка расширяется, в эластических ЛА могут образоваться плоские атеромы. Также в мышечных ЛА могут наблюдаться невыраженное утолщение медии и местами фиброз интимы, капилляры слегка утолщены, а вены часто слегка сужены вследствие гиалинизации интимы. Давление в ЛА и ЛСС в пожилом возрасте нарастает, как нарастает системное сосудистое сопротивление. Изменениям в ЛА также способствует сниженная с возрастом наполняемость ЛЖ, что отражается на легочном сосудистом русле.
д) Физические нагрузки в регуляции легочного кровотока. Умеренная физическая нагрузка приводит к значительному росту легочного кровотока, что в норме сопровождается только небольшим увеличением давления в легочных артериях (ЛА). В результате физических упражнений повышается давление в ЛП, причем соответственно интенсивности нагрузок, и в основном им объясняется повышение давления в ЛА. Это заметное влияние нисходящего давления на восходящее — уникальное явление для легочного кровообращения, поскольку системное АД во время физических нагрузок не зависит от давления в ПП. Благодаря хорошей податливости сосудов при нормальной легочной микроциркуляции нарастание давления в ЛП вследствие усиленного кровотока приводит к расширению мелких сосудов, что способствует снижению сосудистого сопротивления во время нагрузки. Расширение микроцирку-ляторного русла приводит к увеличению диффузионной поверхности и замедлению прохождения эритроцитов сквозь легкие, что способствует транспорту кислорода.
е) Высота над уровнем моря. Проживание высоко над уровнем моря нередко ассоциируется с ЛГ различной тяжести в силу разной степени подверженности индивидуумов сосудосуживающему воздействию хронической гипоксии. Высота снижает PO2 из-за снижения атмосферного давления. РO2 на уровне моря составляет в среднем 150 мм рт. ст., на высотах 3000-5500 м РO2 снижается до 80-100 мм рт. ст., а на крайне высоких отметках (от 5500 до 8840 м) — падает до 40-80 мм рт. ст. Соответственно альвеолярное РO2 и артериальное РO2 зависят от изменений вентиляции в ответ на гипоксию и связанного с ними дыхательного алкалоза. У взрослых, живущих высоко над уровнем моря, в состоянии покоя возникает мягкая ЛГ, которая может значительно усиливаться при физических нагрузках. ЛГ не сразу устраняется путем ингаляции кислорода, но, по всей видимости, не ограничивает способность переносить физическую нагрузку и редко приводит к правожелудочковой недостаточности.
Тяжелая легочная гипертензия (ЛГ) может возникнуть в связи с высотным отеком легких, детской или взрослой формой подострой горной болезни и хронической горной болезнью. У лиц, предрасположенных к высотному отеку легких, часто наблюдаются небольшое нарастание ЛСС в покое и при нагрузках на уровне моря, а также повышенная легочная сосудистая реактивность в ответ на гипоксию. Также описаны случаи кратковременной дисфункции ПЖ, связанные с активной физической нагрузкой на больших высотах.
- Читать "Алгоритм обследования при легочной гипертензии"
Редактор: Искандер Милевски. Дата публикации: 7.11.2018
- Анатомия кровоснабжения легких
- Физиология кровотока в легких - регуляция тонуса сосудов легкого
- Алгоритм обследования при легочной гипертензии
- Классификация легочной гипертензии (ЛГ)
- Идиопатическая легочная артериальная гипертензия (ИЛАГ) - гистология, морфология
- Причины (этиология) идиопатической легочной артериальной гипертензии (ИЛАГ) и ее генетика
