Влияние гормонов щитовидной железы на миокард
Между сердцем и щитовидной железой существуют близкие связи, берущие начало в эмбриональном периоде развития организма. В онтогенезе зачатки щитовидной железы и сердца мигрируют вместе. Близкое физиологическое родство обусловливает предсказуемость изменений сердечно-сосудистой системы при нарушениях тиреоидного статуса. Клинические проявления этих изменений являются одними из самых частых и характерных симптомов тиреотоксикоза. Для того чтобы перейти к диагностике и лечению связанных с дисфункцией щитовидной железы поражений сердца, необходимо понять клеточные механизмы влияния ее гормонов на сердце и гладкомышечные клетки сосудов.
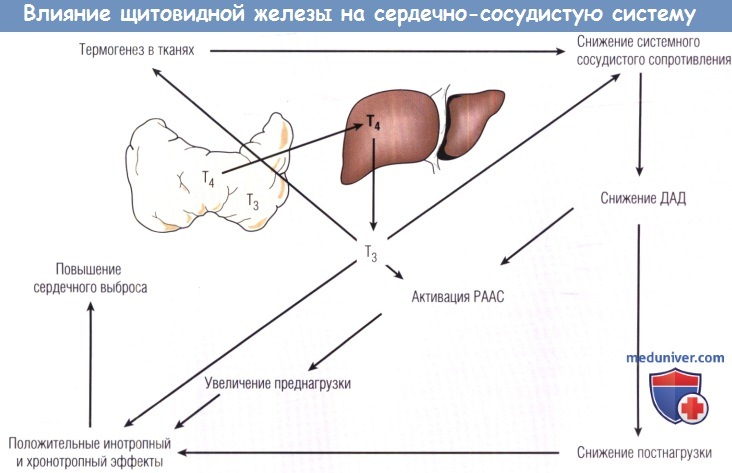
Т4 — тетрайодтиронин; ДАД — диастолическое артериальное давление; РААС — ренин-ангиотензин-альдостероновая система.
а) Клеточные механизмы влияния гормонов щитовидной железы на миокард. Регулируемая тиреотропным гормоном (ТТГ) щитовидная железа обладает уникальной способностью концентрировать йод в сыворотке и путем серии энзимных превращений синтезировать тетрайодтиронин (Т4) (85%) и трийодтиронин (Т3) (15%). Основной объем Т3 синтезируется путем конверсии через 5'-монодейодирование в печени и меньший — в почках. Большое количество исследований подтвердили, что Т3 — активная форма гормона щитовидной железы, отвечающая за широкий спектр биологических эффектов, в т.ч. термогенез, нарушение экспрессии различных клеточных белков, влияние на клетки сердца и гладкие мышцы сосудов.
Свободный Т3 в сыворотке проходит путем облегченной диффузии внутрь клетки, где, по-видимому, без дополнительного связывания с белками попадает в клеточное ядро. Большинство данных свидетельствуют о том, что кардиомиоциты не могут конвертировать Т4 в Т3, поэтому, несмотря на наличие необходимых ферментов, ядерные реакции и изменения экспрессии генов в кардиомиоцитах являются следствием изменений уровня Т3 в крови. Кардиомиоциты экспрессируют а- и β-изоформы рецептора тиреоидного гормона, происходящие из двух различных генов. Эти гены запускают сплайсинг подвидов данных рецепторов — TRα1 и TRα2, из которых только первый связывает тиреоидный гормон с той же аффинностью, что TRβ1, TRβ2 и TRβ3.
Как и стероидные рецепторы и рецепторы семейства ретиноевой кислоты, рецепторы тиреоидного гормона действуют путем связывания с гомо- или гетеродимерами реагирующих на тиреоидные гормоны элементов в промоторном регионе соответствующих генов. Связывание с данными областями может активировать или угнетать экспрессию генов.
Гормоны щитовидной железы регулируют транскрипцию генов многих сердечных белков, включая структурные и регуляторные белки, а также большого числа белков трансмембранных ионных каналов и поверхностных клеточных рецепторов, что объясняет многообразие и противоречивость воздействий данных гормонов на сердце. Первые исследования в этой области касались α- и β-изоформ тяжелых цепей миозина. Желудочки сердца первоначально экспрессируют β-миозин, и нарушения экспрессии этой изоформы при заболеваниях щитовидной железы встречаются очень редко. В предсердиях данные нарушения возникают при многих заболеваниях, включая ХСН, и до сих пор остается неясным, регулируются ли эти процессы гормонами щитовидной железы.
Кальций-зависимая АТФаза в саркоплазматическом ретикулуме — это ионный насос, регулирующий циркуляцию кальция в миоцитах. Повторное поступление кальция в саркоплазматический ретикулум в раннюю диастолу отчасти определяет степень расслабления ЛЖ (т.е. время изоволюмического расслабления). Активность SERCA2, в свою очередь, регулируется белковым полимером фосфоламбаном, обладающим способностью ингибировать активность SERCA, модифицируя уровень фосфорилирования отдельных мономеров фосфоламбана. Инотропные агенты, повышающие сократимость сердца путем увеличения уровня цАМФ в кардиомиоцитах, стимулируют фосфорилирование фосфоламбана. Тиреоидные гормоны ингибируют экспрессию фосфоламбана и также повышают его фосфорилирование.
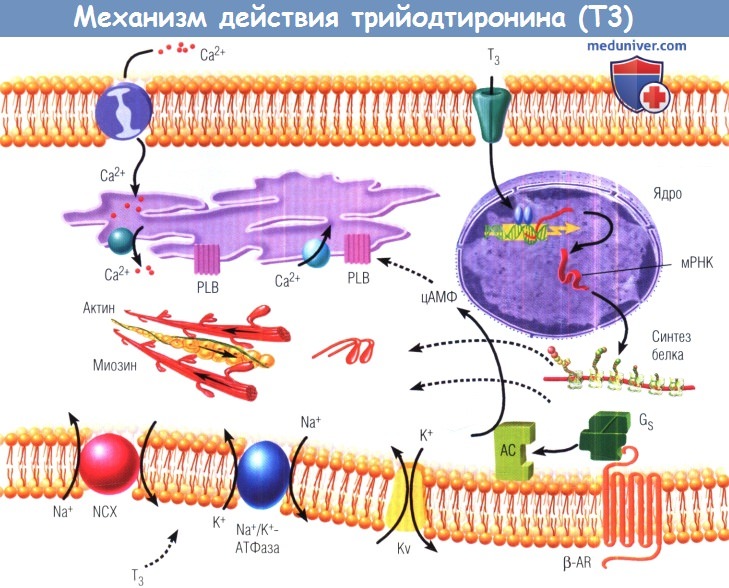
Далее этот комплекс связывает реагирующие на тиреоидные гормоны элементы и регулирует транскрипцию специфических генов.
На схеме также показаны неядерные эффекты Т3 на натриевые (Na+), калиевые (К+) и кальциевые (Са2+) ионные каналы.
β-AR — β-адренергический рецептор; АС — аденилатциклаза; Gs — гуаниннуклеотидсвязывающий белок Gs; Kv — вольтаж-зависимый калиевый канал;
NCX — натриевый канал; PLB — фосфоламбан; АТФаза — аденозинтрифосфатаза; мРНК — матричная рибонуклеиновая кислота; РТГ — рецептор тиреоидного гормона; цАМФ — циклический аденозинмонофосфат.
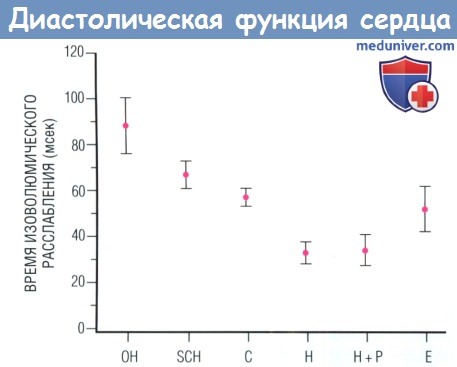
У животных, лишенных фосфоламбана методами генной инженерии, повышения сократимости миокарда после введения тиреоидных гормонов не происходит. Эти данные показывают, что тиреоидные гормоны оказывают большинство прямых эффектов на сократимость сердца, регулируя циркуляцию кальция через систему SERCA-фосфоламбан как транскрипционно, так и посттранскрипционно. Данные молекулярные механизмы объясняют, почему диастолическая функция сердца изменяется противоположным образом па фоне огромного спектра заболеваний щитовидной железы, включая даже мягкий, субклинический гипотиреоз. Помимо этого β-адреноблокагоры при тиреотоксикозе не снижают скорость быстрого диастолического расслабления, что позволяет отделить эффекты тиреоидных гормонов от адренергических проявлений тиреотоксикоза.
Изменения в других генах миоцитов, включая Na+/K+-АТФазу, ответственны за повышение базального потребления кислорода сердцем при экспериментальном тиреотоксикозе и объясняют снижение чувствительности к сердечным гликозидам у пациентов с тиреотоксикозом. В большом числе исследований было показано, что тиреоидные гормоны могут регулировать экспрессию генов собственных ядерных рецепторов в кардиомиоцитах.
В дополнение к подробной характеристике ядерных эффектов гормонов щитовидной железы необходимо сказать, что большая часть сердечных эффектов реализуется через негеномные механизмы. Это подтверждается достаточно быстрым влиянием тиреоидных гормонов на сердце (быстрее, чем нужно для изменения экспрессии генов и синтеза белка) и неспособностью оказывать данное воздействие путем ингибирования транскрипции генов. Эти противоречивые эффекты нуждаются вдальнейшем изучении, но могут объяснить нарушения гемодинамики при быстром введении Т3.
Тиреоидные гормоны могут нарушить функционирование мембранных ионных каналов и насосов, включая натриевые каналы и входящий выпрямляемый калиевый ток (Ik).

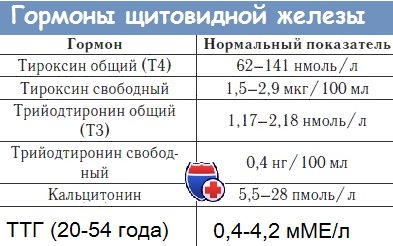
б) Оценка функции щитовидной железы. Для диагностики заболеваний щитовидной железы используют большое число чувствительных и специфичных тестов с высокой степенью точности. Уровень ТТГ в сыворотке является наиболее широко используемым показателем для диагностики и гипотиреоза, и тиреотоксикоза. У пациентов с первичным гипотиреозом уровень ТТГ повышен (> 5 мкМЕ/мл), а при тиреотоксикозе, напротив, снижен (< 0,04-0,01 мкМЕ/мл) вследствие влияния по механизму обратной связи повышенных уровней Т4 (и Т3) на синтез и секрецию ТТГ гипофизом. Измерение уровня свободного Т4 может быть полезно при сопутствующей патологии печени, нарушениях пищеварения или генетических аномалиях, изменяющих содержание тироксинсвязывающего глобулина. Аутоиммунные заболевания щитовидной железы (болезнь Hashimoto и болезнь Graves) диагностируют по наличию в сыворотке антитиреоидных антител, из которых более специфичными являются антитела к тиреоидной пероксидазе или антитела к тиреоглобулину.
в) Взаимодействие тиреоидных гормонов с катехоламинами. В ранних наблюдениях состояния сердца при тиреотоксикозе исследователи подчеркивали тот факт, что оно подобно гиперадреналовым состояниям, и сделали вывод о повышенной чувствительности к катехоламинам в данном состоянии. Этот постулат лег в основу описанного Goetsch в 1918 г. эксперимента, в котором тиреотоксикоз диагностировали по значительному ускорению сердечного ритма и реакции АД на небольшие дозы адреналина, вводимые подкожно. Больные тиреотоксикозом имеют сниженные концентрации катехоламинов, несмотря на явные признаки адренергической активации. Увеличение количества β1-адренергических рецепторов на кардиомиоцитах, наблюдаемое при экспериментальном тиреотоксикозе, обеспечивает повышенную чувствительность к катехоламинам.
Однако в недавних контролируемых исследованиях на нечеловекообразных обезьянах не было выявлено увеличения чувствительности сердца или сердечно-сосудистой системы к катехоламинам при тиреотоксикозе. Вместе с повышением количества β1-адренергических рецепторов и гуанозинтрифосфатсвязывающих белков тиреоидные гормоны снижают экспрессию кардиоспецифических изоформ (V, VI) аденилилциклазных каталитических субъединиц и таким образом обеспечивают клеточный ответ на p-адренергические стимулы в пределах их нормальных концентраций.
- Читать "Сердечно-сосудистые проявления тиреотоксикоза"
Редактор: Искандер Милевски. Дата публикации: 22.2.2019
- Влияние гормонов щитовидной железы на миокард
- Сердечно-сосудистые проявления тиреотоксикоза
- Сердечно-сосудистые проявления гипотиреоза
- Сердечно-сосудистые проявления субклинических болезней щитовидной железы
- Влияние амиодарона на функцию щитовидной железы
- Сердечно-сосудистые проявления феохромоцитомы
