Влияние сахарного диабета на почки
Патофизиология эндокринной системы и почек тесно взаимосвязана на базовом уровне, и врачи, работающие в обеих дисциплинах, должны тесно сотрудничать, чтобы оценить диагностические тонкости, которые могут существенно повлиять на тактику ведения пациентов.
Во всем мире диабет является ведущей причиной терминальной стадии почечной недостаточности. Диабетическая нефропатия (ДН) поражает одну треть пациентов с сахарным диабетом и ассоциируется со значительной сердечно-сосудистой заболеваемостью и смертностью. Однако на гистологическом уровне у больных диабетом наблюдается высокая распространенность недиабетических заболеваний почек или смешанных форм; таким образом, термин «диабетическая нефропатия» следует использовать только для подтвержденного биопсией заболевания почек, вызванного диабетом.
Поскольку тактика лечения может отличаться, а профиль риска сопоставим с общей популяцией, для постановки верного диагноза и определения прогноза следует проводить биопсию почек. С другой стороны, все большую обеспокоенность вызывает ожирение, что связано с ростом числа случаев ассоциированной с ожирением гломерулопатии. Это заболевание поражает почки, приводя к повреждению клубочков, хронической болезни почек, нефролитиазу и раку почки, и требует вмешательства в масштабах всего населения. В статьях на сайте проанализированы изменения уровня гормонов щитовидной железы, ренин-ангиотензин-альдостероновой системы, антидиуретического гормона, паратгормона и половых гормонов на фоне хронической болезни почек. Принимается во внимание также и взаимодействие между различными эндокринными осями в свете клинических изменений, вызванных нарушением почечной функции.
Почки выполняют множество функций, из которых особо выделяются те, которые находятся в тесном взаимодействиии с эндокринной системой. Способность почек секретировать эритропоэтин, кальцитриол (1,25-дигидроксихолекальциферол), ренин и простагландины делает их основным игроком в данных обстоятельствах; патофизиология почек в большой степени подвержена влиянию эндокринных органов. Фактически ренин взаимодействует с такими гормонами, как ангиотензин II, альдостерон, антидиуретический гормон и предсердный натрийуретический пептид, регулируя осмолярность и артериальное давление.
Нарушение физиологической деятельности может приводить как к непосредственному повреждению почки, так и служить непосредственной причиной нарушения ее функции. В этой главе освещаются эти сложные взаимодействия между почками и эндокринной системой, а также рассматриваются конкретные заболевания и их патофизиология. Однако наиболее значимое влияние эндокринных заболеваний на почки наблюдается у пациентов с СД. СД играет важную роль в нефрологии как с точки зрения эпидемиологии, так и с точки зрения клинического исхода, поскольку он, наряду с гипертонией, является ведущей причиной развития ХБП и терминальной стадии почечной недостаточности (ТПН) во всем мире. Более того, ожирение не только увеличивает риск СД и гипертонии, но также вызывает специфические патологические изменения почек и приводит к развитию ХБП, нефролитиаза и рака почек.
У трети пациентов, страдающих диабетом, развивается типичная ДН, которая клинически характеризуется альбуминурией, протеинурией и изменением расчетной скорости клубочковой фильтрации (СКФ), а гистологически — мезангиальной пролиферацией, потерей подоцитов, утолщением базальной мембраны клубочков и узелковым накоплением внеклеточного матрикса. Однако, поскольку эпидемиологические исследования показали, что на гистологическом уровне у пациентов, страдающих диабетом, могут обнаруживаться недиабетические заболевания почек или смешанные формы поражения почек, термин «ДН» следует использовать только для подтвержденного биопсией заболевания почек, вызванного диабетом, а термин «диабетическая болезнь почек» (ХБП) предпочтителен для более глобального описания поражения почек у пациентов с диабетом (Mazzucco и соавт., 2002; Fiorentino и соавт., 2017).
а) Эпидемиология. Рост заболеваемости диабетом наводит на мысль о том, что ДН в конечном итоге способна достичь масштабов пандемии. В настоящее время распространенность диабета составляет 6%, и, по прогнозам, в течение следующего десятилетия среди взрослого населения она увеличится до 10%. Возраст большинства пациентов с сахарным диабетом 2-го типа и ХБП превышает 75 лет. ДН является ведущей причиной ТПН во всем мире. В 2015 г. было выявлено, что СД был являлся основной причиной ТПН у более чем 50% пациентов в Сингапуре, Малайзии, регионе Халиско в Мексике и Чили.
В других странах, таких как Нидерланды, Индонезия, Швейцария, Италия, Норвегия, Россия, Латвия, Литва, Албания и Румыния, СД указывался как основная причина менее чем для 20% пациентов с ТПН. Наибольший рост заболеваемости ТПН, связанной с диабетом, с 2002/2003 по 2014/2015 гг. был зарегистрирован в России, на Филиппинах, в Малайзии и Республике Корея, где показатели за этот период увеличились более чем вдвое. Риск развития ДН не отличается у пациентов с СД 1-го и 2-го типа. Приблизительно у 20—30% пациентов с сахарным диабетом 1-го или 2-го типа развивается ДН, при этом ТПН у пациентов с сахарным диабетом 2-го типа развивается реже. Более половины пациентов с сахарным диабетом, находящихся на диализе, страдают диабетом 2-го типа, поскольку его распространенность намного выше, чем распространенность сахарного диабета 1-го типа.
Более того, коренные американцы, латиноамериканцы, особенно американцы мексиканского происхождения и афроамериканцы, имеют более высокий риск развития ТПН, чем европейцы, страдающие сахарным диабетом 2-го типа.
б) Патогенез. Этиопатогенез ДН, по-видимому, обусловлен как генетическими факторами, так и факторами окружающей среды.
При СД 1-го типа идиопатическая аутоиммунная деструкция β-клеток поджелудочной железы, а при СД 2-го типа генерализованная периферическая инсулинорезистентность вызывают хроническую или периодически возникающую гипергликемию, которая изменяет метаболический и гемодинамический гомеостаз, вызывая развитие серьезных осложнений, в основном характеризующихся сосудистой патологией. Поскольку почки особенно чувствительны как к гемодинамическим, так и к метаболическим изменениям, они являются одной из основных мишеней, поражаемых в течение естественного развития диабета.
Специфические поражения почек, возникающие при ДН, включая утолщение базальной мембраны клубочков, мезангиальная экспансия и наличие узелков Киммелстила—Уилсона вызываются индуцированным гипергликемией окислительным стрессом и накоплением конечных продуктов гликирования. Сопутствующие факторы включают активацию РААС и системную гипертензию, которые повышают внутриклубочковое давление и вызывают микрососудистые поражения. В частности, поскольку доступность глюкозы нарушена, происходит метаболический сдвиг от гликолиза к окислительному фосфорилированию с использованием большего количества жирных кислот.
Увеличивается продукция супероксида, а образование АФК может напрямую запускать различные чувствительные к стрессу пути и активировать различные нижестоящие элементы, при этом воспаление является основной реакцией, опосредованной окислительным стрессом; кроме того, гипергликемическое повреждение опосредуется активацией пути полиола, протеинкиназы С и образования конечных продуктов гликирования (Nishikawa и соавт., 2000).
Трансформирующий фактор роста-β1 является ключевым компонентом в измененной передаче сигналов, участвующих в патогенезе ДН. Фактически он активирует переносчик глюкозы ГЛЮТ-1, таким образом влияя на поступление глюкозы в клетки почек (Schena и Gesualdo, 2005). Трансформирующий фактор роста-β1 действует через свой классический SMAD-зависимый путь, а также альтернативные пути передачи сигналов. Он способствует накоплению внеклеточного матрикса и может участвовать в эпителиально-мезенхимальном переходе/трансдифференцировке (ЭМТ) и эндотелиально-мезенхимальном переходе/трансдифференцировке, уменьшая количество работоспособных клеток. Кроме того, трансформирующий фактор роста-β1 играет решающую роль в прогрессировании диабетической альбуминурии, и, что интересно, в этом процессе ослабленная канальцевая реабсорбция преобладает над усиленной клубочковой фильтрацией. Трансформирующий фактор роста-β1 также участвует в регуляции активности минералокортикоидов, подавляя как продукцию альдостерона в коре надпочечников, проявляя часть своего генерализованного подавляющего действия на стероидогенез, так и эффекты альдостерона в почках.
NO — еще один важный фактор, регулирующий почечную гемодинамику. В то время как гиперфильтрация на ранней стадии ДН опосредуется перепроизводством NO, на поздней стадии быстрое снижение уровня NO приводит к склерозу клубочков.
Также недавно была установлена связь между прогрессированием повреждения канальцев и интерстициальным фиброзом у пациентов с ДН с Lys63-связанным убиквитинированием, которое опосредуется UBE2vl, вариантом конъюгированного с убиквитином Е2-фермента. Постгеномные технологии и системная биология могут существенно улучшить понимание патофизиологии ДН. Многие из ключевых молекулярных драйверов, выявленных с помощью этих высокопроизводительных методов, могут использоваться в качестве неинвазивных биомаркеров, измеряемых в образце мочи (Pontrelli и соавт., 2017; Conserva и соавт., 2016).
в) Клинические особенности. Клинически ДН характеризуется прогрессирующим снижением функции почек, гипертонией и повышением уровня альбумина в моче, что обозначается как микроальбуминурия (30—300 мг/24 ч или 20—200 мкг/мин или соотношение альбумин/креатинин >3 мг/ммоль) и является известным негативным фактором риска нарушения почечной функции, сердечно-сосудистой заболеваемости и смертности. ДН развивается в два этапа: первый включает доклиническую стадию, которая характеризуется нормальным уровнем альбуминурии (степень альбуминурии А1, соотношение альбумин/креатинин <3 мг/ммоль), и стадию микроальбуминурии (степень альбуминурии А2, соотношение альбумин/креатинин 3—30 мг/ммоль); второй этап включает стадию клинических проявлений с макроальбуминурией (степень А3, соотношение альбумин/креатинин >30 мг/ммоль) и снижением функции почек.
До появления альбуминурии примерно у одной трети пациентов с сахарным диабетом 1-го типа и в меньшей степени у пациентов с сахарным диабетом 2-го типа развивается гиперфильтрация. Наблюдается увеличение СКФ на 20—50% от показателей здоровых людей того же возраста, могут также отмечаться полиурия и глюкозурия, а артериальное давление на этой стадии находится в пределах нормы. По результатам ультразвукого исследования может выявиться почечная гипертрофия. Продолжительность этой стадии варьируется и зависит от тщательного контроля гликемии. Начальная стадия нефропатии определяется стойкой микроальбуминурией, прогрессирующим снижением СКФ и появлением гипертонии. Эта стадия обычно развивается через десять лет после постановки диагноза и отражается наличием эндотелиального повреждения без специфических гистологических поражений почек (de Boer и соавт., 2011).
Мезангиальная экспансия и раннее повреждение клубочков являются причиной снижения СКФ. Когда возникает макроальбуминурия или стойкая протеинурия, ДН переходит в стадию клинических проявлений. Гипертензия присутствует у 75% пациентов, и этот процент увеличивается по мере прогрессирующего нарушения функции почек. У 5-10% этих пациентов протеинурия может достигать 2—3 г/сут или даже значений, характерных для нефротического синдрома. При СД 1-го типа эта стадия обычно развивается в течение нескольких лет, тогда как при СД 2-го типа она менее предсказуема и даже может выявляться на момент постановки диагноза. Процент пациентов, у которых развивается клиническая картина нефропатии, варьируется, но они подвержены более высокому риску развития ТПН. Основными факторами риска, связанными с развитием этой стадии, являются плохой гликемический контроль, курение, пожилой возраст и дислипидемия (Romero-Aroca и соавт., 2012). Введение ингибиторов ренин-ангиотензиновой системы снизило среднюю скорость падения СКФ с 10—20 мл/мин в год до 2—10 мл/мин в год.
Обычно СКФ начинает снижаться при появлении протеинурии, поэтому ранняя диагностика может помочь замедлить прогрессирование заболевания, при том, что клинические проявления повреждения почек развиваются через 10—20 лет. Микроальбуминурия — это самый ранний диагностический маркер поражения почек, связанный с СД как 1-го, так и 2-го типа.
Микро- и макроальбуминурия может быть вызвана хроническими неспецифическими поражениями, связанными с повреждением сосудов (артериальный и артериолярный склероз и ишемическое повреждение клубочков) или недиабетическими гломерулярными заболеваниями, которые также могут быть ассоциированы с ДН (Mazzucco и соавт., 2002). Хотя микроальбуминурия считается фактором риска развития макроальбуминурии, это не всегда так, поскольку только у 30—45% пациентов с микроальбуминурией развивается протеинурия в течение 10 лет наблюдения.
Также возможно нарушение функции почек без увеличения уровня альбумина в моче. Итальянское многоцентровое исследование RIACE (почечная недостаточность и сердечно-сосудистые события) показало, что 11% пациентов с СД2 имели ХБП 3—5-й стадии без альбуминурии, у 22% была микроальбуминурия с нормальной или сниженной СКФ, а у 5% наблюдалась макроальбуминурия с нормальной или сниженной СКФ. Более того, это исследование показало, что у 62% пациентов отсутствовала ХБП, при этом выявлялась нормальная альбуминурия и СКФ выше 60 мл/мин. Остается открытым вопрос, имеется ли у всех этих пациентов поражение почек. Национальный почечный фонд и Американская диабетическая ассоциация рекомендуют ежегодно проводить скрининг ДН у пациентов с СД. Этот скрининг включает в себя определение микроальбуминурии, креатинина сыворотки и измерение СКФ через 5 лет после постановки диагноза СД 1-го типа и сразу после постановки диагноза СД 2-го типа (KDOQI, 2012).
При СД 1-го типа и отсутствии надлежащего метаболического контроля более целесообразно проводить первый скрининг через 1 год после постановки диагноза, а при отсутствии микроальбуминурии повторять анализ ежегодно.
г) Данные гистологического исследования. При СД 1-го и 2-го типа возникают патофизиологические изменения, которые в долгосрочной перспективе влияют на функцию и структуру почек. Самый распространенный фенотип — диабетический гломерулосклероз. На поздней стадии заболевания гистологически обычно выявляются узелковые поражения Киммелстила—Уилсона. С другой стороны, СД может вызывать хроническое неспецифическое повреждение, при котором преобладают поражения сосудов. Сочетанное поражение почек диагностируется при обнаружении других гломерулопатий или когда они не связаны с типичным диабетическим гломерулосклерозом. Mazzucco и соавт. выполнили всестороннее исследование для описания спектра гистологических поражений почек, наблюдаемых у пациентов с диабетом. Авторы проанализировали 393 биоптата почек пациентов с СД 2-го типа и представили следующую классификацию на основе трех гистологических классов:
- Класс 1: типичный диабетический гломерулосклероз, характеризующийся гипертрофией клубочков, мезангиальной экспансией (узловой или диффузной) и утолщением стенок капилляров.
- Класс 2: распространенные и связанные с хроническим повреждением интерстициальных канальцев сосудистые (артериоартериолосклеротические) и ишемические гломерулярные изменения.
- Класс 3a: другие гломерулонефриты, сопровождающие диабетический гломерулосклероз.
- Класс 3b: гломерулонефриты без диабетического гломерулосклероза.
Трудно оценить точную распространенность каждого из этих трех классов в связи с сильным влиянием этнических факторов и метода проведения биопсии почек. Основываясь на конкретных гистологических особенностях (Tervaert и соавт., 2010), класс 1 можно дополнительно охарактеризовать следующим образом:
1. Утолщение базальной мембраны клубочков наблюдается при электронной микроскопии (>430 нм у мужчин и >395 нм у женщин старше 9 лет) (рис. 1). При световой микроскопии видны только незначительные и неспецифические изменения. Утолщение базальной мембраны клубочков прогрессирует по мере развития заболевания и вызвано повышенным отложением и уменьшением деградации компонентов внеклеточного матрикса, таких как коллаген IV и VI типов, ламинин и фибронектин.
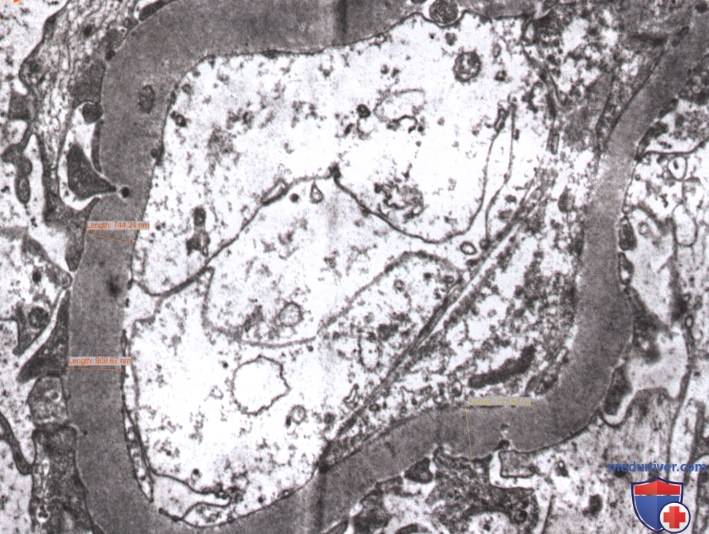
2. Обнаружено также, что мезангиальная экспансия при отсутствии узлового склероза может быть легкой или тяжелой в зависимости от площади вовлеченной мезангиальной области по сравнению с диаметром просвета капилляра. Если наблюдается умеренная мезангиальная экспансия >25% от общего мезангиума, биопсия классифицируется как 2а. Если наблюдается выраженная мезангиальная экспансия >25% от общего мезангиума, биопсия классифицируется как 2b. Вследствие этого процесса капилляры клубочков сужаются и фильтрация снижается.
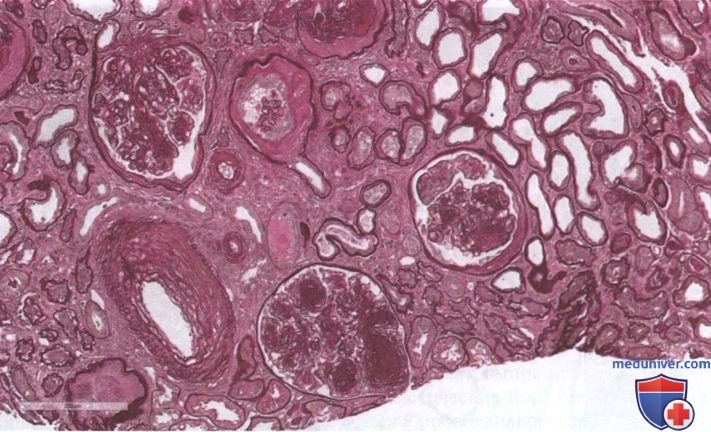
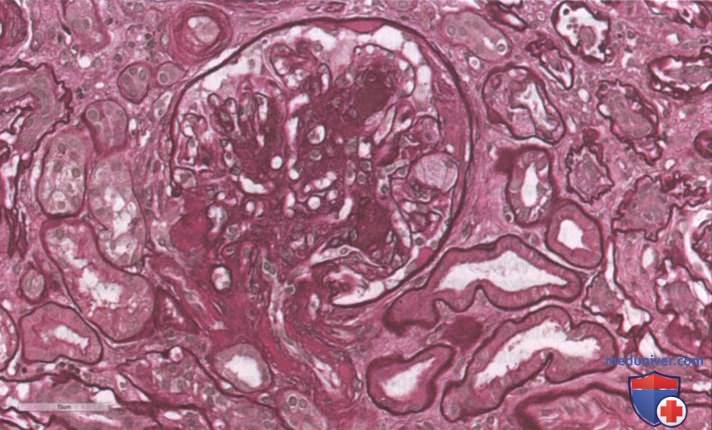
3. Нодулярный склероз (поражения Киммелстила—Уилсона) характеризуется наличием по крайней мере одного клубочка с узелковым разрастанием мезангиального матрикса без изменений, характерных для класса IV. Поражения Киммелстила—Уилсона являются фокальными, мезангиальными, круглыми или овальными, с неклеточным ядром из гиалинового матрикса, окруженным несколькими мезангиальными ядрами (рис. 2 и 3).
4. Прогрессирующий гломерулосклероз. Эта стадия характеризуется гломерулосклерозом более чем 50% почечной ткани с клиническими или гистологическими данными, характерными для диабетической нефропатии.
Хотя поражение Киммелстила—Уилсона на уровне клубочков типично для ДН, тубулоинтерстициальный компартмент также поражается. Фактически класс II, наряду с развитием поражений клубочков, характеризуется также утолщением базальной мембраны канальцев без атрофии, которое становится более выраженным в классах III и IV (Tervaert и соавт., 2010). Постепенно связанные с гломерулярным поражением интерстициальный фиброз и атрофия канальцев при ДН и приводят к развитию ТПН. Существует строгая корреляция между степенью гломерулярного и тубулоинтерстициального повреждения и клиническим исходом у пациентов (Ап и соавт., 2015). Другие гистологические особенности, обнаруженные при ДН, включают наличие инфильтрации интерстиция мононуклеарами (Т-клетки и макрофаги). Более того, относительно специфическим маркером ДН является гиалиноз артериол, вовлекающий как приносящие, так и выносящие артериолы, тогда как при некоторых других заболеваниях отмечается только гиалиноз приносящих артериол (рис. 3). Наконец, при биопсии может выявляться атеросклероз, хотя это неспецифический признак.
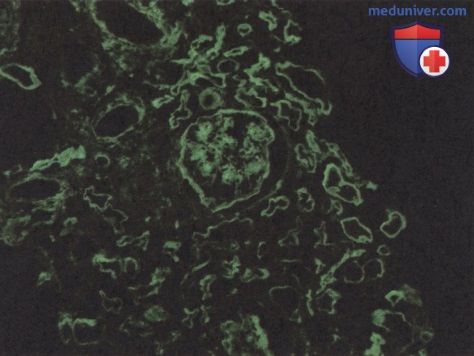
При иммунофлуоресцентных исследованиях выявляется диффузное линейное окрашивание базальных мембран клубочков и канальцев на IgG из-за неиммунологического отложения белков в утолщенных аномальных и базальных мембранах с положительным окрашиванием как х, так и X легких цепей, что исключает возможное заболевание с отложением легких цепей (рис. 4). В зоне гломерулярного склероза обнаруживаются также С3 и IgM.
д) Терапевтический подход. В настоящее время основными принципами лечения являются контроль гликемии и артериального давления.
Поскольку гипертония является частым сопутствующим заболеванием и модифицируемым фактором риска, связанным с прогрессированием микрои макрососудистых осложнений, пациентам с ДН необходим строгий контроль артериального давления. Однако ингибиторы РААС, такие как иАПФ и БРА, предпочтительнее других антигипертензивных средств, поскольку их нефропротективные эффекты также связаны с уменьшением протеинурии вследствие снижения внутриклубочкового давления. Каждый из возможных методов лечения СД, включая метформин, ингибиторы дипептидилпеп-тидазы-4, иНГЛТ-2 и агонисты рецептора глюкагоноподобного пептида-1 (ГПП-1), имеет свой профиль безопасности и влияние на почки.
1. Контроль гликемии. Несмотря на доказанный и устойчивый в долгосрочной перспективе нефропротективный эффект более низких целей гликемического контроля, эти преимущества всегда следует сопоставлять с повышенным риском тяжелой гипогликемии и общей смертности, связанной с сердечно-сосудистыми заболеваниями (Группа авторов по контролю за диабетом и исследованиям осложнений / Группа исследования эпидемиологии вмешательств и осложнений диабета, 2003; Ismail-Beigi и соавт., 2010; Duckworth и соавт., 2009).
Обнаруженный Fioretto и соавт. регресс гистологической картины ДН у пациентов через 10 лет после изолированной трансплантации поджелудочной железы был подтвержден в клинических испытаниях, в которых была показана эффективность оптимального гликемического контроля в отношении более позднего начала и замедления прогрессирования ДН (Fioretto и соавт., 1998). Пациентам с ХБП пероральные сахароснижающие препараты следует назначать с осторожностью. Хлорпропамид и глибенкламид являются производными сульфонилмочевины длительного действия, которые могут вызывать затяжной эпизод гипогликемии. Бигуанид метформин может вызывать тяжелый лактоацидоз и не должен применяться у пациентов с СКФ ниже 30 мл/ мин/1,73 м2. Его следует назначать только при СКФ >45 мл/мин/1,73 м2. Пациенты, уже получающие препарат, у которых выявлено снижение СКФ ниже 45 мл/мин/1,73 м2, могут продолжать лечение до тех пор, пока преимущества лечения, превышают риски. При наличии лихорадки или диареи настоятельно рекомендуется отмена терапии.
Целесообразно снижение дозы метформина примерно на 50% у пациентов с СКФ от 30 до 60 мл/мин/1,73 м2, хотя в настоящее время это не входит в рекомендации Управления по санитарному надзору за качеством пищевых продуктов и медикаментов (англ. Food and Drug Administration, FDA). Inzucchi и соавт. рекомендуют максимальную суточную дозу 2000 мг для пациентов с СКФ 45-60 мл/мин/1,73 м2 и 1000 мг для пациентов с СКФ 30—45 мл/мин/1,73 м2 (Inzucchi и соавт., 2014).
Ингибиторы дипептидилпептидазы-4 ситаглиптин, вилдаглиптин и саксаглиптин в основном выводятся почками и требуют коррекции дозы при СКФ <60 мл/мин/1,73 м2, тогда как линаглиптин, который метаболизируется в желудочно-кишечном тракте, не требует снижения дозы у пациентов с ХБП. Важно помнить о возможности развития панкреатита на фоне терапии этими препаратами.
иНГЛТ-2, используемые для лечения сахарного диабета 2-го типа, влияют на Na+/глюкозный котраспортер 2-го типа, транспортер глюкозы с низкой аффинностью и высокой емкостью, расположенный в проксимальных канальцах, который реабсорбирует около 90% отфильтрованной глюкозы. Ингибирование НГЛТ-2 приводит к глюкозурии и снижению уровня глюкозы в сыворотке крови и, кроме того, способствует нормализации поступления NaCl к плотному пятну, которое нарушено при ДН. Этот класс препаратов обладает положительным влиянием на снижение массы тела, а также низким гипогликемическим потенциалом, поскольку механизм его действия не зависит от секреции инсулина. Снижение гиперфильтрации в клубочках, а также угнетение воспалительного и фибротического ответа на гипергликемию, в конечном итоге замедляет прогрессирование ДН (van Bommel и соавт., 2017).
Канаглифлозин и эмпаглифлозин не следует применять при СКФ <45 мл/ мин/1,73 м2, а дапаглифлозин — у пациентов с ХБП и СКФ <60 мл/ мин/1,73 м2. Побочные эффекты иНГЛТ-2 включают инфекции половых органов и мочевыводящих путей.
Агонисты рецептора ГПП-1 являются миметиками инкретина, которые снижают уровень глюкозы, стимулируя β-клетки поджелудочной железы к секреции инсулина, снижая уровень глюкагона в плазме, замедляя эвакуацию содержимого желудка и подавляя аппетит. Лираглутид доказал свою эффективность в снижении частоты сердечно-сосудистых событий и снижении риска развития макроальбуминурии, но не оказал никакого влияния на почечные исходы. Побочные эффекты агонистов рецептора ГПП-1 включают острый панкреатит или ретинопатию (Marso и соавт., 2016).
Исследования, напрямую сравнивающие эффективность контроля гликемии и частоту смерти от всех причин при применении иНГЛТ-2, агонистов рецептора ГПП-1 и ингибиторов дипептидилпептидазы-4, не проводились. В недавнем метаанализе 236 исследований, в которых приняли участие более 170 000 пациентов с сахарным диабетом 2-го типа, эти три класса препаратов сравнивались по уровню смертности, сердечно-сосудистым событиям, профилю безопасности и нежелательным явлениям.
Применение иНГЛТ-2 и агонистов рецептора ГПП-1 (последний с умеренным ОР) ассоциировано со снижением общей смертности и смертности от сердечно-сосудистых заболеваний по сравнению с контрольными группами и группами применения ингибиторов дипептидилпептидазы-4; более того, иНГЛТ-2 оказывают положительное влияние при сердечной недостаточности и инфаркте миокарда, вероятно, благодаря их диуретическому и антигипертензивному действию, а также влиянию на снижение веса. Хотя применение всех классов препаратов несет риск гипогликемии, побочные эффекты при приеме иНГЛТ-2 менее выражены, однако при этом отмечается более высокая частота возникновения мочеполовых инфекций; агонисты рецептора ГПП-1 имеют самый высокий уровень побочных эффектов, большинство из которых связаны с желудочно-кишечным трактом; ингибиторы дипептидилпептидазы-4 повышают риск острого панкреатита. Следовательно, иНГЛТ-2, учитывая лучшие результаты и благоприятный профиль безопасности, являются предпочтительным методом лечения (Zheng и соавт., 2018).
2. Контроль артериального давления. Пациентам с ДН необходим контроль артериального давления. Снижение среднего систолического артериального давления на каждые 10 мм рт.ст. связано со снижением риска любых ассоциированных с СД осложнений на 12% и смерти на 15%. Аналогичным образом исследование RENAAL (снижение конечных точек при инсулиннезависимом сахарном диабете с помощью антагониста рецептора ангиотензина II лозартана) показало, что увеличение исходного систолического артериального давления на каждые 10 мм рт.ст. ассоциировано с повышением риска ТПН или смерти на 6,7%. У пациентов с СД 1-го типа без гипертонии, получавших иАПФ, было обнаружено снижение на 60% прогрессирования от микро- до макроальбуминурии. Фактически превосходство ингибиторов РААС над другими антигипертензивными средствами основано на их эффективности в снижении альбуминурии и эффективном замедлении прогрессирования ДН. Было обнаружено, что ирбесартан снижает риск удвоения уровня креатинина сыворотки крови и прогрессирования до ТПН на 33% и 23% соответственно.
Что касается выбора между иАПФ и БРА, нет убедительных доказательств в поддержку того или иного класса препаратов, и их можно использовать без каких-либо предпочтений (Barnett и соавт., 2004). В свою очередь, применение комбинации иАПФ и БРА вызывает споры и не рекомендовано, поскольку в разных исследованиях сообщалось о неблагоприятных эффектах такой терапии по сравнению с первым исследованием, данные которого не были подтверждены. Кроме того, не рекомендуется добавление прямого ингибитора ренина алискирена, так как его применение может вызывать такие побочные эффекты, как гиперкалиемия и гипотензия. В случае снижения скорости клубочковой фильтрации прием ингибиторов РААС следует прекратить перед операцией и при высоком риске острого повреждения почек (Ruggenenti и Remuzzi, 2009; Mann и соавт., 2008).
Видео этиология, патогенез сахарного диабета, гипергликемии, кетоацидоза
- Читать "Влияние ожирения на почки"
Редактор: Искандер Милевски. Дата публикации: 9.1.2023
- Влияние глюкокортикоидов на кровеносные сосуды
- Влияние гормона роста (соматотропного гормона) на кровеносные сосуды
- Влияние гиперпаратиреоза и недостаточности витамина D на кровеносные сосуды
- Влияние половых гормонов на кровеносные сосуды
- Влияние сахарного диабета на почки
- Влияние ожирения на почки
- Влияние паращитовидных желез на почки
- Влияние щитовидной железы на почки
- Влияние надпочечников на почки
- Влияние гипофиза на почки
