Влияние гиперпаратиреоза и недостаточности витамина D на кровеносные сосуды
ПТГ и витамин D являются двумя ведущими регуляторами минерального обмена. Они играют решающую роль в поддержании фосфорно-кальциевого гомеостаза, а также здоровья костей. Кроме того, ПТГ и витамин D образуют строго контролируемый механизм обратной связи. ПТГ действует как главный активатор витамина D, тогда как последний оказывает ингибирующее действие на секрецию ПТГ. Примечательно, что в настоящее время появляется все больше данных о влиянии ПТГ и витамина D на сердечно-сосудистую систему.
Оба гормона оказывают прямое воздействие на различные структуры сосудов, включая эндотелий. Гиперпаратиреоз и дефицит витамина D, таким образом, связаны с патологией сосудов, включая гипертонию, атеросклероз и кальциноз сосудов.
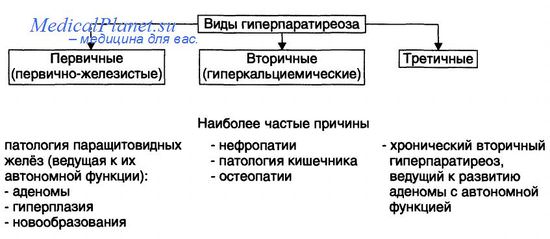
а) Паратиреоидный гормон и сосудистый гомеостаз. Ускоренное развитие сосудистых заболеваний (гипертония, атеросклероз) и кальциноз сосудов описываются как классические клинические проявления первичного гиперкальциемического и вторичного гиперпаратиреоза. Однако лежащий в основе патофизиологический механизм еще не полностью выяснен, поскольку повышение уровня ПТГ сосуществует с дефицитом витамина D, гиперкальциемией и, в конечном итоге, гиперфосфатемией (при вторичном гиперпаратиреозе). В настоящее время бессимптомный ПГП является наиболее частым проявлением, характеризующимся нормальным или умеренно повышенным уровнем кальция, дефицитом витамина D и нормальным уровнем фосфора в сыворотке крови.
Имеются противоречивые данные о связи бессимптомной формы ПГП с риском сердечно-сосудистых заболеваний. В некоторых небольших исследованиях уровень глюкозы в крови натощак был выше в группе пациентов с нормокальциемическим вариантом ПГП, но в пределах нормы. Также в других исследованиях было описано негативное влияние на липидный профиль, АД и индекс массы тела.
В других работах эти выводы не нашли подтверждения, а отсутствие консенсуса в определении бессимптомного ПГП не позволяет проводить объединенные анализы. Экспериментальные гипотезы предполагают двойную роль ПТГ по отношению к сосудистой системе. В ЭК ПТГ проявляет сосудорасширяющие свойства посредством зависимой от протеинкиназы А и протеинкиназы С регуляции eNOS. По тем же путям ПТГ способствует транскрипции фактора роста эндотелия сосудов, а затем поддерживает ангиогенный ответ ЭК. В других исследованиях было сделано предположение о наличии связи между уровнем ПТГ, эндотелиальной дисфункцией и кальцинозом сосудов. По-прежнему обсуждается влияние ПТГ на ГМКС. Хотя результаты экспериментов достаточно противоречивы, в клинических исследованиях была показана независимая связь уровня ПТГ с эндотелиальной недостаточностью и снижением резерва коронарного кровотока.
Сообщения о положительном влиянии паратиреоидэктомии на эндотелиальную функцию также вызывают интерес. Новые данные также связывают ПТГ с прогрессированием атеросклеротического поражения.
б) Влияние витамина D на сосуды. Витамин D оказывает большой спектр эффектов на сосудистое русло, где передача его сигналов регулируется аутокринно или паракринно на местном уровне. Некоторые типы клеток в сосудистой системе экспрессируют VDR, который, как считается, прямо/косвенно регулирует 3—5% генома человека, в дополнение к влиянию на некоторые другие негеномные ответы.
Точно так же в сосудистом русле, наряду с катаболическим ферментом 25-гидрокси-витамин D-24-гидроксилазой, существует местная экспрессия 25-гидроксивитамин D-lα-гидроксилазы. Примечателен тот факт, что локальная экспрессия витамина D не зависит от уровня ПТГ, а скорее регулируется сигналами окружающей среды, включая провоспалительные цитокины. В условиях стресса ЭК активируют VDR, тогда как активация передачи сигналов витамина D подавляет экспрессию молекул адгезии и защищает от накопления продуктов гликирования и окислительного стресса.
Согласно исследованиям in vitro, избирательная делеция VDR в эндотелиальных клетках у мышей была связана с подавлением продукции NO и нарушением ответа на повышение артериального давления. Точно так же местный обмен витамина D происходит в интиме сосудов, где он модулирует пролиферацию, миграцию, кальцификацию и тромбогенную активность ГМКС. Примечательно, что местное действие витамина D также влияет на воспалительный процесс, который вызывает прогрессирование атеросклеротического поражения и нестабильности бляшек (Carbone и Montecucco, 2013). В частности, передача сигналов витамина D может подавлять экспрессию toll-подобных рецепторов в провоспалительных макрофагах М1, что приводит к увеличению количества макрофагов противовоспалительного фенотипа М2 и способствует удалению холестерина из пенистых клеток.
Опираясь на эти данные, клинические исследования подтвердили сильную отрицательную связь между циркулирующим 25-ОН витамином D и функцией эндотелия.
Однако метаанализ клинических испытаний, посвященных применению витамина D, не продемонстрировал улучшения эндотелиальной функции. Кроме того, несколько исследований связали дефицит витамина D с развитием атеросклеротических бляшек (КИМ и кальциноз коронарных артерий) и их нестабильностью. Хотя в большом числе экспериментальных и клинических исследований указывалось на наличие связи между дефицитом витамина D и сосудистой дисфункцией, причинно-следственная связь до сих пор не установлена. Результаты интервенционных испытаний, посвященных применению витамина D, разочаровывают. Во-первых, следует учитывать смешанные эффекты, связанные с плохой стратификацией пациентов (по возрасту, полу, расе, географическому положению, физической активности, инсоляции и сопутствующим заболеваниям).
Во-вторых, нет единого мнения насчет того, что именно считать дефицитом витамина D. В настоящее время пороговые значения основаны на поражении костной ткани и не привязаны к сердечно-сосудистым заболеваниям. Наконец, как опубликованные, так и продолжающиеся испытания не учитывают потенциальный вклад системы локального синтеза витамина D, и это, безусловно, ограничивает их надежность.
в) Система «Фактор роста фибробластов 23/Клото»: новый игрок. Недавнее открытие системы ФРФ-23/Клото расширило понимание схемы регуляции гомеостаза кальция. Ген Клото необходим для передачи сигналов ФРФ-23 путем изменения низкоаффинного рецептора ФРФ (рФРФ-1) на высокоаффинный, который включает мембраносвязанный комплекс рФРФ-1/ Клото. ФРФ-23 действует как антагонист витамина D, подавляя 25-гидроксивитамин D-1α-гидроксилазу и активируя катаболический фермент 25-гидроксивитамин D-24-гидроксилазу. В целом гормональная система, связывающая 1,25(OH)2D и ФРФ-23, участвует в гомеостазе фосфора, но высказывалось предположение о ее возможном влиянии и на гомеостаз сосудов. Система ФРФ-23/Клото у человека синтезируется в сосудах (Donate-Correa и соавт., 2013), а баланс между двумя компонентами существенно влияет на на функцию эндотелия.
Негативное влияние ФРФ-23 проявляется в подавлении NO и активации синтеза АФК. Напротив, преобладание экспрессии гена Клото активирует синтез NO в дополнение к подавлению окислительного стресса и кальцификации сосудов. Согласно экспериментально полученным данным клинических исследований, уровень ФРФ-23 в значительной степени ассоциирован с эндотелиальной дисфункцией (Bargnoux и соавт., 2015; Desjardins и соавт., 2012; Houston и соавт., 2013; Inci и соавт., 2016; Mirza и соавт., 2009), атеросклерозом (Ashikaga и соавт., 2010; Biscetti и соавт., 2015; Brandenburg и соавт., 2014; Ни и соавт., 2015, 2016; Lutsey и соавт., 2016; Mirza и соавт., 2009b; Shah и соавт., 2015; Yamada и соавт., 2016) и смертностью от сердечно-сосудистых заболеваний (Qin и соавт., 2017).
- Читать "Влияние половых гормонов на кровеносные сосуды"
Редактор: Искандер Милевски. Дата публикации: 9.1.2023
- Влияние глюкокортикоидов на кровеносные сосуды
- Влияние гормона роста (соматотропного гормона) на кровеносные сосуды
- Влияние гиперпаратиреоза и недостаточности витамина D на кровеносные сосуды
- Влияние половых гормонов на кровеносные сосуды
- Влияние сахарного диабета на почки
- Влияние ожирения на почки
- Влияние паращитовидных желез на почки
- Влияние щитовидной железы на почки
- Влияние надпочечников на почки
- Влияние гипофиза на почки
