Влияние минералокортикоидов на кровеносные сосуды
Впервые связь между нарушением регуляции альдостерона и изменением сосудистой сети была четко установлена при эссенциальной и при вторичной гипертензии Conn в 1955 г. Надпочечники вырабатывают стероидные гормоны с МК эффектами в ответ на различные стимулы (например, повышение уровня ангиотензина II, гиперкалиемия, адренокортикотропный гормон), что вызывает увеличение реабсорбции воды и натрия в почках, влияющее на синтез протонной помпы на уровне канальцев.
Кроме этого классического проявления, альдостерон, основной минералокортикоид у человека, оказывает ряд других влияний, геномных или негеномных, на разные типы клеток. За последние несколько десятилетий был сделан большой шаг вперед в изучении воздействия альдостерона на сердце и сосудистое русло, с учетом того факта, что у пациентов с первичным гиперальдостеронизмом отмечается более высокая смертность от ССЗ по сравнению с пациентами с аналогичным АД, страдающими эссенциальной гипертензией (ЭГ).
Таким образом, в следующем абзаце суммирована патофизиологическая роль этого гормона в развитии эндотелиальной дисфункции, ремоделировании сосудов и развитии атеросклероза.
Также представлены клинические исследования, оценивающие взаимосвязь между риском развития сердечно-сосудистых заболеваний и избытком альдостерона у людей.
а) Влияние альдостерона на эндотелиальную дисфункцию, ремоделирование сосудов и повышение их ригидности. Эндотелиальная дисфункция — патологическое состояние, при котором нарушается баланс между вазоконстрикцией и вазодилатацией, играющий ключевую роль в развитии сердечно-сосудистых заболеваний. Способность альдостерона влиять на функцию эндотелия была продемонстрирована как на животных моделях, так и на когортах людей. Постоянное введение альдостерона вызывает значительное снижение эндотелий-зависимой вазорелаксации как у мышей, так и у крыс, в то время как в клиническом исследовании Nishizaka и коллег было продемонстрировано, что нарушение эндотелий-зависимой вазодилатации отмечалось у 36 пациентов, страдающих гиперальдостеронизмом, по сравнению с 44 пациентами с ЭГ.
Более того, после 3 мес терапии антагонистом альдостерона спиронолактоном в той же эндокринологической когорте было отмечено значительное улучшение эндотелиальной дисфункции.
Альдостерон принимает непосредственное участие в быстрой регуляции диаметра сосудов благодаря своему негеномному воздействию как на ГМКС, так и на ЭК. Эти эффекты могут быть зависимыми или независимыми от МКР и приводить к сокращению ГМКС за счет трансактивации нескольких рецепторных тирозинкиназ, таких как рецептор фактора роста эндотелия сосудов, рецептор инсулиноподобного фактора роста типа 1 (ИФР1) и рецептор тромбоциторного фактора роста. Более того, в ЭК альдостерон может приводить к быстрой продукции NO за счет активации eNOS, опосредованной путем фосфоинозитид-3-киназы. Этому сосудорасширяющему действию альдостерона противодействует его прооксидантная активность в сосудистой стенке.
В культуре ЭК и ГМКС альдостерон показал способность увеличивать активность никотинамидадениндинуклеотидфосфат-оксидазы и доступность АФК посредством как МКР-зависимых, так и МКР-независимых путей. Повышенная концентрация АФК в ЭК снижает доступность NO за счет образования пероксинитрита, а также ингибирования и разобщения eNOS. Это объясняет общий сосудосуживающий эффект альдостерона. Более того, альдостерон также может влиять на свойства ЭК через МКР, увеличивая их объем и, таким образом, приводя к повышению ригидности артерий и снижению высвобождения NO. Исходя из этих основных наблюдений, недавно Garg и соавт. показали более высокий резерв коронарного кровотока (маркер сосудистой функции) у пациентов с диабетом без признаков ишемии миокарда при лечении спиронолактоном по сравнению с терапией гидрохлоротиазидом, несмотря на то, что в обеих группах были аналогичные значения АД.
Вызывая фиброз сосудов и гипертрофическую модификацию, альдостерон также играет фундаментальную роль в ремоделировании и повышении ригидности артерий. У крыс со спонтанной гипертензией введение антагониста МКР предотвращало развитие опосредованного гипертензией сосудистого фиброза независимо от его влияния на АД. Последние данные свидетельствуют о том, что негативное влияние ангиотензина II на сосудистую сеть опосредовано его перекрестным взаимодействием с альдостероном на уровне ГМКС. Фактически альдостерон может индуцировать экспрессию рецептора ангиотензина in vitro и in vivo, а эффекты ангиотензина II на ремоделирование сосудов ослабляются за счет блокады МКР. Действуя через МКР-зависимые и независимые пути, альдостерон вместе с ангиотензином II способен вызывать пролиферацию, миграцию и старение ГМКС.
В недавно проведенном исследовании индуцированная избирательная делеция МКР в ГМКС показала способность снижать как сосудистый мышечный тонус, так и АД у пожилых мышей; кроме того, это также предотвращало ангиотензин II-зависимый окислительный стресс и вазоконстрикцию. Эти основополагающие открытия четко отражают клинические данные: у пациентов с артериальной гипертензией концентрация альдостерона в плазме показывает обратную связь с эластичностью крупных сосудов, которая остается статистически значимой даже с возрастом и при изменениях АД, в то время как различные исследования подтверждают положительное влияние блокаторов МКР на ригидность артерий, несмотря на их гипотензивный эффект, и свидетельствуют об их противовоспалительном действии.
б) Влияние альдостерона на прогрессирование атеросклеротического поражения. Несколько исследований на животных подтвердили, что при гиперальдостеронизме негативное влияние МК на функцию сосудов отражается в усилении атерогенеза. Альдостерон может усиливать как ранний, так и распространенный атеросклероз, что приводит к развитию богатых липидами бляшек с сильным воспалением, подобных нестабильным бляшкам у человека. Хотя конкретные механизмы, с помощью которых альдостерон влияет на атерогенез, полностью не выяснены, прямые независимые от АД провоспалительные эффекты, по-видимому, играют решающую роль.
Первыми эффектами, оказываемыми альдостероном на сосуды при его введении, являются окислительный стресс и усиление инфильтрации сосудов воспалительными клетками в зоне атеросклероза. В клетках эндотелия коронарных сосудов человека альдостерон индуцировал МКР-зависимую транскрипцию ICAM-1 (молекула клеточной адгезии-1 на мембранах лейкоцитов и эндотелиальных клеток), что приводило к адгезии и миграции лейкоцитов (Caprio и соавт., 2008).
Скопление лейкоцитов, кроме того, усиливается за счет высвобождения хемотаксических факторов коронарными ГМКС после стимуляции альдостероном через рецептор сосудистого эндотелиального фактора роста I типа. Действие альдостерона на пути передачи сигналов рецептора фактора роста эндотелия сосудов у человека было также подтверждено ex vivo на образцах аорты человека, при этом отмечалось ослабление его эффекта при использовании антагонистов МКР (Jaffe и соавт., 2010).
В настоящее время основное внимание уделяется модуляции функции лейкоцитов, связанной с МКР, показывающей, что антагонизм МКР предотвращает опосредованное альдостероном переключение макрофагов на провоспалительный фенотип M1 и способствует противовоспалительной (М2) активности, при этом баланс М1/М2 играет ведущую роль в атерогенезе. Наконец, альдостерон также может опосредовать привлечение Т-клеток в стенку сосуда. Эти полученные в эксперименте результаты были частично подтверждены в клинических условиях, при этом было показано наличие более высокого уровня провоспалительных цитокинов у пациентов с альдостерон-продуцирующей аденомой по сравнению с ЭГ или здоровыми людьми. Более того, терапия антагонистами МКР в течение 2 мес значительно снизила концентрацию цитокинов, вплоть до нормального уровня.
Итак, благодаря своему влиянию на оксидативный стресс, воспаление, ремоделирование и ригидность сосудов, альдостерон играет ключевую роль в регуляции атерогенеза, при этом применение антагонистов МКР потенциально способно снизить как начальное воспаление сосудов, так и разрыв зрелых бляшек.
в) Клинические проявления. Несколько когортных анализов за последние два десятилетия подтвердили негативный вклад гиперальдостеронизма в патогенез сердечно-сосудистых заболеваний (табл. 1).
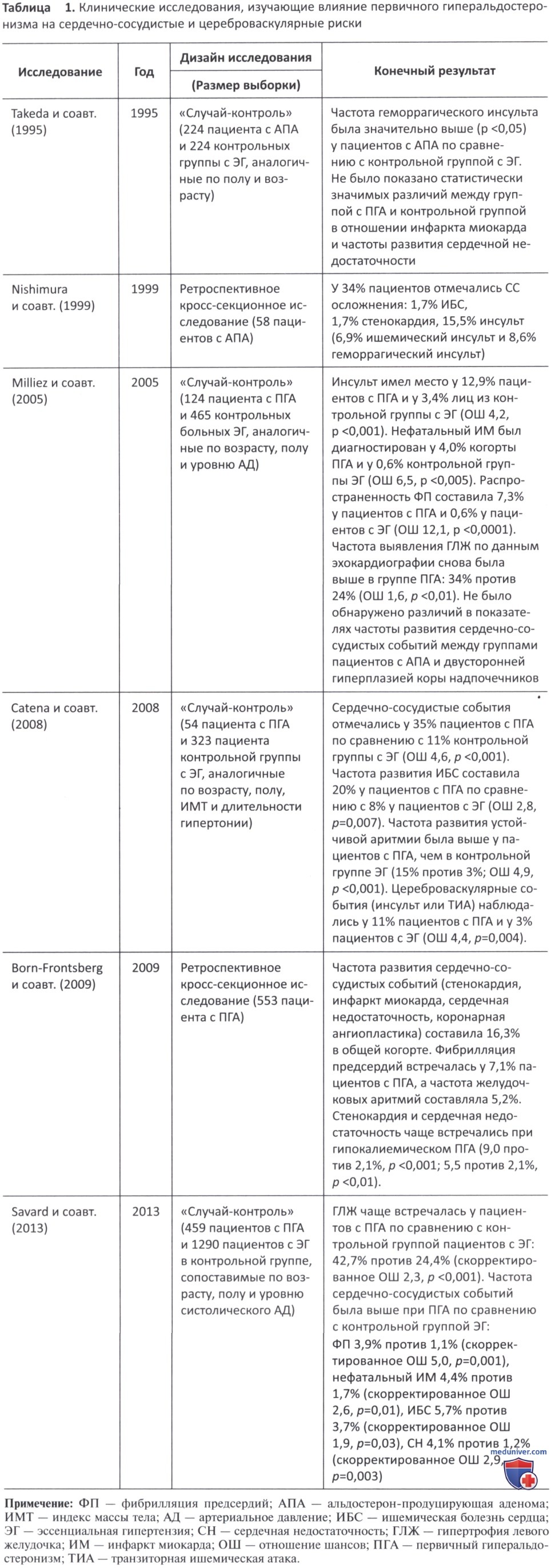
В 2005 г. Milliez и соавт. провели сравнение пациентов с ПГА с пациентами с ЭГ, при этом было обнаружено, что частота инсульта составила 12,9% для ПГАи 3,4% для ЭГ (отношение шансов 4,2). Точно так же риски инфаркта миокарда и возникновения фибрилляции предсердий были выше при ПГА по сравнению с ЭГ (отношение шансов 6,5 и 12,1 соответственно). Это исследование не показало каких-либо различий в сердечно-сосудистой заболеваемости между ПГА и двусторонней гиперплазией коры надпочечников (Milliez и соавт., 2005). Негативное влияние альдостерона на ремоделирование сердечно-сосудистой системы объясняет более высокую склонность пациентов с ПГА к развитию ГЛЖ и диастолической дисфункции по сравнению с ЭГ и другими формами гипертензии (например, синдромом Кушинга и феохромоцитомой).
Недавно более крупное контролируемое поперечное исследование, проведенное Savard и его коллегами, подтвердило, что отрицательные эффекты альдостерона на сердечно-сосудистую систему, по крайней мере частично, не зависят от изменений АД (Savard и соавт., 2013). Было показано, что 459 пациентов с ПА по сравнению с 1290 с ЭГ из контрольной группы, сопоставимые по возрасту, полу и систолическому АД, имели более высокую распространенность ГЛЖ и сердечной недостаточности (ОШ 2,0 и 2,9 соответственно), ишемической болезни сердца и нефатального инфаркта миокарда (ОШ 1,9 и 2,6 соответственно), а также фибрилляции предсердий (ОШ 5,0).
По данным недавнего интересного исследования, проведенного Rossi и соавт., в котором 180 пациентов с ПГА и 143 пациента с ЭГ были проспективно обследованы с помощью эхокардиографии, было выяснено, что эффекты альдостерона на ремоделирование сердечно-сосудистой системы частично обратимы (Rossi и соавт., 2013). В группе ПГА отмечалась большая исходная масса миокарда ЛЖ по сравнению с группой ГЭ, в то время как в результате 36-месячного наблюдения у пациентов после оперативного лечения АПА и пациентов, принимавших антагонисты минералокортикоидов, наблюдались значительный регресс ГЛЖ и снижение массы миокарда левого желудочка за счет процесса обратного ремоделирования левого желудочка.
Не так давно, на собрании Международного общества гипертензии в 2016 г., были представлены долгосрочные результаты исследования распространенности первичного гиперальдостеронизма у пациентов с гипертонией, что восполнило недостаток проспективных исследований, изучающих прогноз сердечно-сосудистых заболеваний у пациентов с ПГА (исследование PAPY с участием 1125 пациентов) (Maiolino и соавт., 2016). В этом исследовании ПГА имелся у 11,2% пациентов; из них 6,4% страдали идиопатическим гиперальдостеронизмом и получали медикаментозное лечение, в то время как 4,8% имели АПА и нуждались в адреналэктомии.
После наблюдения в течение 11,9 лет пациенты с идиопатическим гиперальдостеронизмом показали худшую выживаемость по сравнению с ЭГ (88,6% против 96,8% соответственно), в то время как результаты в группах АПА и ЭГ не отличались. Кроме того, при многомерном анализе идиопатического гиперальдостеронизма был независимый предиктор общей смертности (отношение рисков 3,02). Эти данные подчеркивают, что между подтипами ПГА существуют некоторые различия в отношении риска сердечно-сосудистых заболеваний, при этом пациенты с идиопатическим гиперальдостеронизмом, получавшие медикаментозное лечение, остаются в группе более высокого риска, чем пациенты с ЭГ при долгосрочном наблюдении, тогда как пациенты с адреналэктомией с АПА демонстрируют снижение риска сердечно-сосудистых заболеваний.
Семейный гиперальдостеронизм 1 -го типа также продемонстрировал некоторые особенности: даже у пациентов с нормальным АД наблюдалось повышенное концентрическое ремоделирование левого желудочка и толщина стенки вместе со снижением диастолической функции по сравнению со здоровыми добровольцами с сопоставимым уровнем АД.
Несмотря на то, что Conn и соавт. сообщили только о трех случаях цереброваскулярного заболевания в своей первой серии исследований гиперальдостеронизма (145 пациентов), в настоящее время хорошо известно негативное влияние МК не только на сосуды сердца, но и на сосуды головного мозга. Позднее на нескольких когортах пациентов с ПГА была показана более высокая распространенность цереброваскулярных заболеваний у этих пациентов (оценка от 12% до 15%), даже по сравнению с пациентами с ЭГ. Кроме того, особый синдром гиперпродукции альдостерона, а именно ГПГА, сопровождается высокой частотой геморрагического инсульта.
В целом эти результаты подчеркнули, что у пациентов с эндокринными нарушениями, влияющими на систему МК, повышается сосудистый риск; в крупных РКП, изучающих антагонизм МКР, также были получены доказательства негативного влияния альдостерона на риск сердечно-сосудистых заболеваний. Во-первых, рандомизированное оценочное исследование альдактона (RALES) в 1999 г. показало у пациентов с сердечной недостаточностью III класса по классификации Нью-Йоркской ассоциации здравоохранения и сниженной фракцией выброса огромное преимущество в отношении смертности и госпитализации (снижение на 30% и 35% соответственно) после добавления спиронолактона (25—50 мг/сут) к стандартному лечению диуретиками и ингибиторами АПФ (Pitt и соавт., 1999). Затем еще один более селективный антагонист МКР, эплеренон, был протестирован (50 мг/день) в РКИ с участием 6632 пациентов с постинфарктной сердечной недостаточностью в дополнение к стандартному лечению (включая бета-блокаторы и ингибиторы АПФ): было выявлено снижение смертности на 15% при приеме эплеренона в течение 16 мес (Pitt и соавт., 2003).
Еще лучшие результаты были получены позже в другом РКИ с применением той же дозировки эплеренона, но с участием пациентов с сердечной недостаточностью II класса по классификации Нью-Йоркской ассоциации здравоохранения и сердечной недостаточности с пониженной фракцией выброса, при этом в группе применения антагониста МКР было отмечено снижение смертности от сердечно-сосудистых заболеваний или госпитализации по поводу застойной сердечной недостаточности на 37%. Несмотря на эти убедительные данные, полученные у пациентов, страдающих сердечной недостаточностью со сниженной фракцией выброса, в двух недавних РКИ не удалось продемонстрировать положительный эффект в отношении сердечно-сосудистых исходов при применении этих препаратов при сердечной недостаточности с сохраненной фракцией выброса и у пациентов с ИБС без сердечной недостаточности. Таким образом, необходимы дальнейшие исследования для лучшего определения клинических условий, в которых блокаторы М К могут оказать положительный эффект.
- Вернуться в раздел "Эндокринология"
Редактор: Искандер Милевски. Дата публикации: 4.1.2023
- Гормоны щитовидной железы как причина болезни сердца
- Паращитовидные железы как причина сердечно-сосудистых заболеваний
- Карциноидная болезнь сердца
- Сахарный диабет как причина болезни сердца
- Феохромоцитома (ФХЦ) как причина сердечно-сосудистых заболеваний
- Спонтанная диссекция коронарной артерии (СДКА) и ее эндокринные причины
- Кардиомиопатия такоцубо и ее эндокринные причины
- Влияние сахарного диабета и метаболического синдрома на сосудистую систему
- Влияние заболеваний щитовидной железы на кровеносные сосуды
- Влияние минералокортикоидов на кровеносные сосуды
