Методы определения антимикотикограмм грибов рода Candida
Принципы CLSI (NCCLS) изложены в описании разработанных недавно методах диффузии препаратов в агар с использованием дисков, пропитанных антимикотиками. Применение этого метода значительно упрощает определение чувствительности к ним грибов рода Candida, делая его технически таким же несложным, как и при определении чувствительности бактерий к антибактериальным препаратам.
Рядом исследователей было показано соответствие метода E-test стандарту CLSI (NCCLS). Менее четкое соответствие было отмечено в отношении тестирования препаратов азоловой группы.
О степени чувствительности или устойчивости грибов рода Candida при использовании дисков с антимикотиками судят визуально по зоне наличия или отсутствия роста культуры вокруг дисков с препаратами, к которым определяется чувствительность.
Считаем необходимым представить более подробное описание определения чувствительности грибов рода Candida методом диффузии в агаре с использованием дисков с антимикотиками.
Определение чувствительности Candida к антимикотикам диско-диффузионным методом
а) Принцип и оценка результата. Состав среды Мюллера-Хинтона был первоначально разработан как простая, прозрачная агаризованная среда для культивирования патогенных культур. Для определения чувствительности к антимикотикам (по Стандарту CLSI) рекомендуется модифицированный агар Мюллера-Хинтона для диффузии антимикотических агентов, которыми пропитаны бумажные диски, в агаровый гель.
Kirby и Bauer рекомендовали агар Мюллера-Хинтона для тестов определения чувствительности с использованием одного диска с высокой концентрацией. Комитет ВОЗ по Стандартизации определения чувствительности рекомендует эту среду для определения чувствительности микроорганизмов в связи с воспроизводимостью результатов тестирования.
б) Приготовление инокулома. Взять суточную культуру (24 часа при 35±2°С), выращенную на агаре Сабуро с глюкозой. Снять со среды пять колоний диаметром около 1 мм и суспензировать в 5 мл 0,85 %-ого раствора NaCl.
Перемешать суспензию и довести ее плотность до 0,5 единиц McFarland (10-50 КОЕ).
в) Проведение исследования. Приготовить чашки со средой Мюллера-Хинтона (модифицированной для определения чувствительности к антимикотикам по Стандарту CLSI). Толщина слоя агара в чашках — 4 мм.
Стерильным, не токсичным хлопковым тампоном на деревянной палочке нанести суспензию микроорганизмов штрихами на поверхность агара в трех направлениях (поворачивая чашку на 60°).
Оставить чашку с закрытой крышкой на 5-15 минут для впитывания при комнатной температуре.
Разложить диски с антимикотиками на поверхность засеянного агара так, чтобы расстояние между центрами дисков было не менее 24 мм (не более 12 дисков на чашку диаметром 150 мм или не более 5 дисков на чашку диаметром 80-90 мм).
Перевернуть чашку вверх дном и поместить в термостат при 35±2°С не позднее чем через 15 мин после наложения дисков.
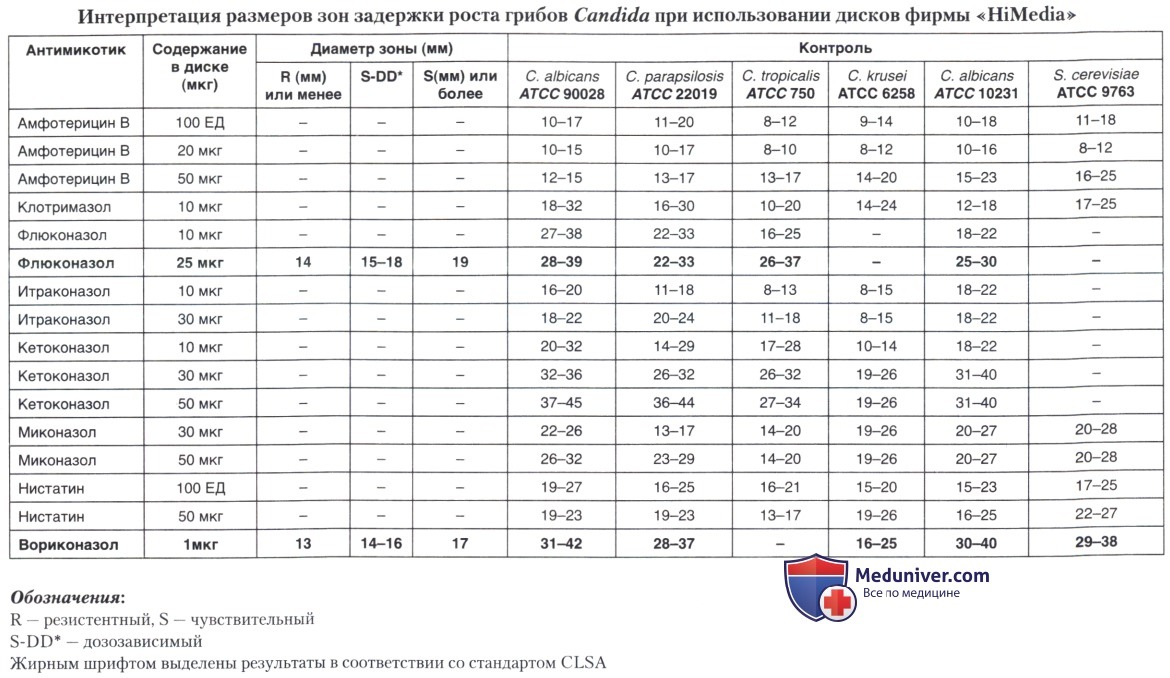
Достоверные результаты можно получить при образовании в чашках почти сливного роста культуры и равномерно круглых зон задержки роста. Если этого не наблюдается через 20-24 часа инкубации, то учитывать результаты нужно через 48 ч. Интерпретация результатов по размерам зон задержки роста (для дисков фирмы «HiMedia») представлены в таблице ниже.
- Читать далее "Возбудитель пневмоцистоза (Pneumocystis carinii (jiroveci hominis)): таксономия, морфология"
Редактор: Искандер Милевски. Дата публикации: 12.5.2020
- Противогрибковые препараты (антимикотические препараты)
- Методы определения чувствительности и устойчивости грибов рода Candida к противогрибковым (антимикотическим) препаратам
- Критерии чувствительности и устойчивости грибов рода Candida к противогрибковым (антимикотическим) препаратам
- Чувствительность основных возбудителей кандидоза к ряду противогрибковых препаратов
- Методы определения антимикотикограмм грибов рода Candida
