Лабораторная диагностика возбудителя сапа (Burkholderia mallei)
Основные методы исследования:
- микроскопический;
- бактериологический;
- биологический;
- иммунологический;
- генетический.
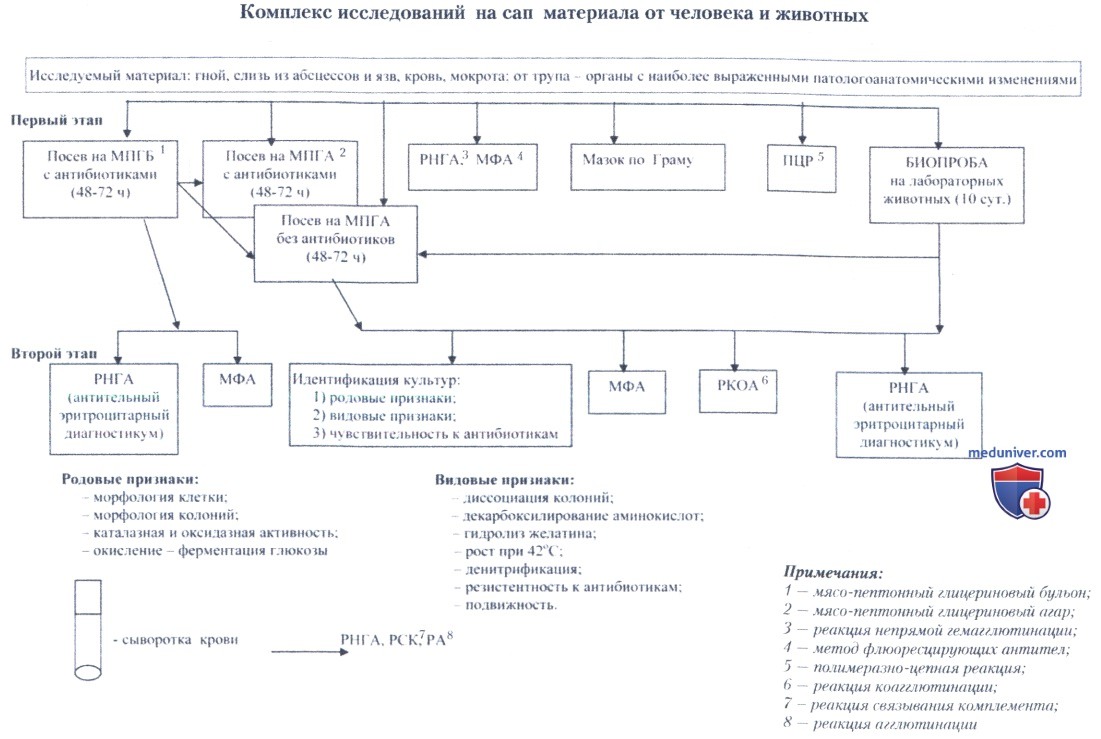
Предварительный ответ о наличии или отсутствии в исследуемом материале возбудителя сапа в первые 8-10 ч дается устно по результатам ускоренного и экспрессного исследования методом ПЦР и одной из иммунологических реакций (МФА, РА, РИГА, ИФА). Окончательная идентификация культуры возможна лишь после постановки комплекса тестов, включая биологическую пробу на лабораторных животных.
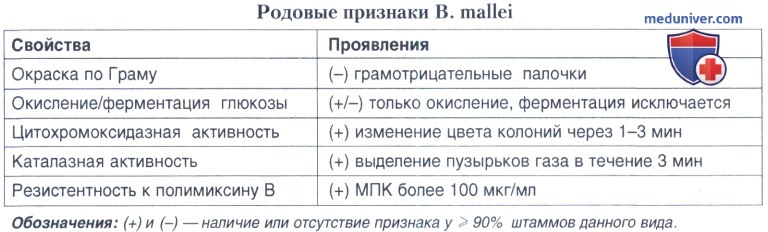
Микроскопическое изучение идентифицируемой культуры или материала из отделяемого язв, пунктатов из абсцессов, полостей, лимфоузлов, мокроты, крови и т.д. является обязательным предварительным этапом перед постановкой основных диагностических тестов. Окраска — по Граму, Романовскому-Гимзе и метиленовым синим.
У больных животных и человека возбудитель сапа может быть выделен из гнойного отделяемого язв, абсцессов, крови, мокроты или биоптата закрытых абсцессов. С целью подавления роста посторонней микрофлоры в пробы, отобранные для бактериологического исследования, добавляют генцианвиолет (3 мкг/л или 1:300 000), полимиксин В (50 ЕД/мл) или ампициллин (15 мкг/мл). До начала исследований материал следует хранить при комнатной температуре, так как выдерживание проб в холодильнике может способствовать отмиранию в них возбудителя.
Материал засевают в мясопептонный бульон с 5% глицерина (МПГБ), одновременно делая посев на мясопептонный агар с 5% глицерина (МПГА).
Посевы внутренних органов умерших людей и павших животных, в зависимости от степени загрязнения посторонней микрофлорой, осуществляют методом мазков-отпечатков и посевом петлей на три чашки с МПГА и в 3 пробирки с МПГБ, которые инкубируют в течение 48-72 ч при 37°С.
Учет производят ежедневно.
При посеве на МПГА возбудитель сапа через сутки формирует дисковидные слабовыпуклые полупрозрачные гладкие колонии. На плотных средах наблюдается морфологическая диссоциация колоний.
На чашках с МПГА могут формироваться R- и М- формы колоний возбудителя сапа. В жидких питательных средах через 24-48 ч наступает равномерное помутнение, образуется слизистый осадок, а на поверхности — тонкая пленка.
Идентификацию культур, подозрительных на принадлежность к виду В. mallei, проводят в два этапа, на которых последовательно определяют род и вид бактерий.
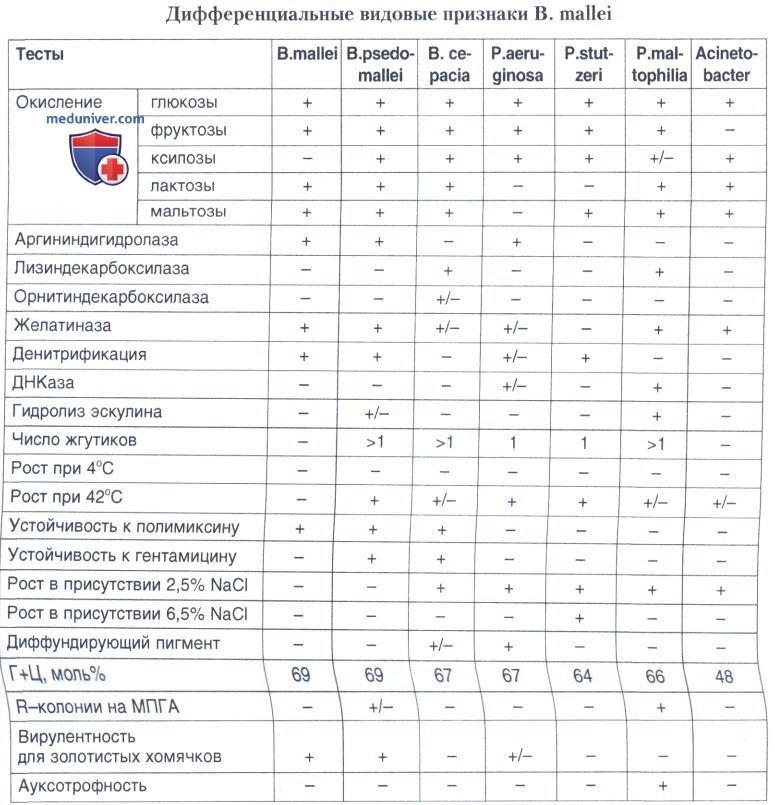
Принципиальными для дифференциации В. mallei и В. pseudomallei являются три теста: неподвижность возбудителя, отсутствие роста при 42°С, чувствительность к гентамицину. Идентификация В.mallei в лабораториях, располагающих автоматическими системами типа API, может проводиться целенаправленно для подтверждения предварительной идентификации, выполненной другими методами. Имеются факты случайного выделения этого возбудителя автоматическими системами идентификации при исследовании культур, выращенных из клинического материала. В то же время имеются многочисленные факты гиподиагностики при использовании практически любых типов автоматических систем, во многом объясняющиеся слабой ферментативной активностью этого микроба, что приводит к несовпадению результатов стандартных лабораторных тестов и их микромодификаций, используемых в тест-системах.
Для постановки биопробы при диагностике сапа используют золотистых хомячков и морских свинок. Материал из абсцессов, отделяемого ран, мокрота, измельченные кусочки внутренних органов (печень, селезенка, почки, легкие) суспендируют в 2-3 мл 0,85%-ного раствора NaCl и после отстаивания надосадочную жидкость вводят двум животным подкожно по 0,5-1,0 мл в область бедра. При исследовании чистой культуры животных можно заражать внутрибрюшинно в объеме 1,0 мл. Срок наблюдения до 10 сут. 11авших или забитых больных животных вскрывают и исследуют бактериологическим методом с целью выделения чистой культуры. Для этого их органы засевают на МПГА и параллельно на среду с ингибиторами.
Для интраперитонеального заражения желательно брать самцов, у которых при внутрибрюшинном заражении возникают перитонит и орхит (скротальный феномен Штрауса), а в перитонеальном экссудате обнаруживается возбудитель сапа. Однако следует иметь ввиду, что феномен Штрауса недостаточно специфичен и может быть вызван другими микроорганизмами. Биологический метод эффективен для диагностики острого сапа, выделить же возбудитель этим методом при хроническом течении сапа чаще не удается.
Наиболее распространенным методом при первичной дифференциации колоний, подозрительных на В. mallei, был и остается метод постановки ориентировочной РА с агглютинирующей сапной сывороткой в разведении 1:50.
Реакцию ко агглютинации на стекле (РКОА) ставят на этапе идентификации в момент исследования колоний, выросших на плотных питательных средах. Ее чувствительность колеблется в пределах 1x106— 1 х 109 микробных клеток/мл в зависимости от особенностей тестируемых штаммов возбудителя сапа.
Реакция непрямой гемагглютинации (РНГА) с антительным сапным эритроцитарным диагностикумом применяется для обнаружения антигенов возбудителя сапа в бактериальных взвесях и суспензиях органов биопробных животных. Тщательно измельченные ножницами кусочки органов суспендируют в 0,85%-ном растворе натрия хлорида в соотношении 1:5. Суспензию подвергают кипячению не менее 30 мин или обеззараживанию 4% формалином в течение 1 ч и при необходимости осветляют фильтрацией через ватный тампон при помощи шприца.
Метод флюоресцирующих антител (МФА) является одним из наиболее чувствительных, специфических и достоверных методов быстрого обнаружения возбудителя сапа в различных объектах исследования. Он позволяет получить предварительный ответ в течение 1-2 ч от момента начала исследования, идентифицировать возбудитель сапа на этапах ускоренного и классического лабораторного анализа биологически обогащенного материала.
Аллергическая внутрикожная проба с маллеином очень широко используется в ветеринарной практике, ее постановка в сочетании с серологическими исследованиями позволяет к тому же не только выявлять, но и дифференцировать различные формы сапа у лошадей и, следовательно, обеспечивать правильность проведения противоэпизоотических мероприятий. У больного человека положительная аллергическая реакция (ГЗТ) развивается на 2-3-й неделе заболевания. Однако, учитывая возможность обострения заболевания при введении больным специфического аллергена, в медицинской практике кожная аллергическая проба не ставится. Для оценки наличия у больных ГЗТ рекомендуют использовать постановку пробы in vitro (например, показатель повреждения нейтрофилов).
ДНК-ДНК-гибридизация в настоящее время считается основным таксономическим методом определения видовой принадлежности. При идентификации в лабораторных условиях чистых культур, подозрительных на принадлежность к виду В. mallei, исследования проводят на нитроцеллюлозных фильтрах, на которые наносят ДНК или лизат клеток изучаемых культур. В качестве ДНК-зондов используют фрагменты хромосомной ДНК референтного штамма В. mallei, несущие радиоактивную метку. Учет реакции проводят на следующий день, визуализация результатов происходит при помощи радиоавтографии на рентгеновской пленке. Этот метод позволяет отдифференцировать В. mallei от других видов буркхольдерий и гетерологичных аэробных грамотрицательных бактерий, но не от возбудителя мелиоидоза, что в принципе не столь существенно на первом этапе идентификации.
Определение генетической трансформации является своеобразным аналогом ДНК-ДНК-гибридизации в условиях жизнедеятельности микроорганизма, так как генетический обмен фрагментами хромосомы происходит или между штаммами одного вида, или между видами, таксономическое разделение которых базируется в основном на фенотипических, а не на генетических различиях. Для постановки теста используют хлороформный лизат изучаемого штамма, который смешивают с суспензией 109 микробных клеток/мл суточной культуры реципиента (ауксотрофный мутант, чаще всего авирулентный pur В. pseudomallei VPA) и высевают на минимальную среду. Появление через 24-72 ч колоний прототрофов при отсутствии их в контроле свидетельствует о принадлежности идентифицируемой культуры к В. mallei или В. pseudomallei.
Полимеразная цепная реакция (ПДР) признается в настоящее время принципиально значимым методом для экспресс-диагностики и индикации опасных инфекционных заболеваний. Стандартных коммерческих наборов тест-систем для видоспецифической идентификации возбудителя сапа не существует. В специализированных для работы с возбудителями ООИ лабораториях апробированы праймеры на основе участков генов 23S рибосомальной РНК, которые позволяют выявлять клетки В. mallei в концентрации 101-102 микробных клеток /мл в чистых культурах и в суспензиях из органов больных сапом животных. При определенной постановке теста (концентрация культур менее 101 микробных клеток/мл) возможна дифференциация штаммов В. mallei от В. pseudomallei.
Серологическая диагностика. РА. Следует отметить, что РА может выявлять в сыворотках здоровых людей, никогда не выезжавших в эндемичные по сапу районы, присутствие агглютининов в титрах 1:20-1:80; такие же титры могут быть определены и при исследовании сывороток здоровых или больных другими инфекциями людей и животных. Кроме того, РА при сапе недостаточно чувствительна, невысокие ее тигры (ниже диагностического уровня — 1:160) отмечаются не только при острой септической форме, но и при хроническом, рецидивирующем заболевании. Значение РА несколько повышается при исследовании динамики титра антител в парных сыворотках.
Реакция непрямой гемагглютинации (РНГА) с антигенным сапным эритроцитарным диагностикумом применяется для обнаружения в сыворотках людей и животных специфических сапных иммуноглобулинов. Сыворотки перед исследованием инактивируются добавлением мертиолата натрия и последующим прогреванием: пробы от человека — при 56°С в течение 30 мин, бычью и свиную сыворотки — при 58°С в течение 30 мин, лошадиную и собачью — при 53°С в течение 45 мин. Постановка РНГА и учет результатов проводится по общепринятой схеме. PHГА оценивается как положительная, если титр ее равен или превышает 1:200. Этот диагностикум не дифференцирует сап от мелиоидоза.
- Читать далее "Лечение и профилактика сапа"
Редактор: Искандер Милевски. Дата публикации: 3.2.2020
