Микробиологическая диагностика возбудителя газовой гангрены (клостридий, Clostridium)
У больного берут на исследование кусочки тканей из раны размером 0,5-1,0 см3; для исключения контаминации посторонней микрофлорой забор образцов производят из глубины раны, на границе здоровых и травмированных тканей («демаркационная линия»). Кроме того, берут пунктат из региональных лимфатических желез и жидкий экссудат, которые можно набрать иглой шприца, а также кровь из вены в объеме 3-5 мл при соблюдении асептики. В случаях постабортной инфекции следует взять на исследование содержимое матки.
Серологическая диагностика при газовой гангрене не имеет практического значения.
При патологоанатомическом исследовании берут кровь из сердца, кусочки паренхиматозных органов. Все пробы отбирают в стерильную посуду, плотно закрывающуюся пробками, и не позднее чем в течение 3 ч доставляют в лабораторию.
При невозможности соблюдения сроков доставки материалы помещают в жидкие питательные среды с тиогликолатом натрия или цистеином и доставляют в лабораторию в течение 12-18 ч. Помимо этого материал можно сохранить до исследования в замороженном состоянии в течение 24-48 ч.
Учитывая быстрое развитие клиники газовой гангрены (от нескольких часов до 1-2 сут.) и зависимость исхода заболевания от своевременности и целенаправленности специфического (иммунотерапия) и антимикробного лечения, крайне важно использовать экспресс-методы бактериологической диагностики.
Экспресс-анализ проводится с целью получения быстрого (через 1,5-2 ч) хотя бы ориентировочного ответа, к какому виду принадлежит ведущий возбудитель, что позволит начать наиболее оптимальное лечение.
Методы экспресс-анализа включают световую микроскопию и реакцию иммунофлюоресценции (РИФ). У постели больного делают мазки и мазки-отпечатки из патологических тканей, а также нативные мазки «висячая капля» для выявления подвижности микробов. Мазки окрашивают по Граму и Гипсу (для выявления капсул), а также обрабатывают иммунофлюоресцирующими сыворотками.
Одновременно производят высев патологических тканей и крови на лакмусовое молоко и среды обогащения, культивируют посевы при 43°С, что существенно ускоряет процесс роста возбудителей.
Наличие в мазках большого количества, преобладающего над другими формами (иногда практически однородная «чистая» культура), грамположительных с четкими обрубленными концами неподвижных и имеющих капсулу палочек свидетельствует в пользу С. perfringens. РИФ, обладающая контрастностью и иммуноспецифичностью, может подтвердить данные световой микроскопии.
При наличии С. perfringens в материале уже через 1-3 ч инкубирования при 43°С появляется характерное изменение лакмусового молока, вызываемое этим микробом.
Ускоренный анализ ведется параллельно с экспресс-анализом и включает кратковременное культивирование (подращивание) на средах обогащения и селективных средах с дальнейшим определением токсинов возбудителей газовой гангрены в культуральной жидкости посевов. Проведение ускоренного анализа не должно превышать 18-24 ч.
Определение вида возбудителя газовой гангрены предусматривает полный бактериологический анализ с выделением чистой культуры, ее видовой и типовой идентификацией. Этот анализ занимает не менее 72 ч. Чтобы уложиться в указанный срок, ход анализа должен быть четко распределен по времени и рассредоточен по ряду направлений, включающих одномоментное проведение экспресс- и ускоренных методов определения возбудителей, а также выделение и идентификацию чистых культур.
а) Первый день исследования:
1. Микроскопирование мазков и мазков-отпечатков. Из всех патологических материалов (жидких и плотных) делают мазки и мазки-отпечатки для световой и флюоресцентной микроскопии. Мазок из экссудата или из крови делают путем нанесения капли на предметное стекло и равномерного распределения ее по поверхности стекла. Мазки-отпечатки из тканей готовят следующим образом: раскаленным скальпелем прижигают ткань, затем на этом участке делают свежий разрез и поверхностью разреза ткани делают отпечаток на предметном стекле. Мазки подсушивают, фиксируют спиртовой смесью или на пламени, после чего окрашивают по Граму и по методу Гинса (для окраски капсул).
Для выявления подвижности микробов микроскопируют в нативном виде «висячую каплю» культуральной жидкости или суспензию микробов в физиологическом растворе. При микроскопировании отмечают морфологические формы микроорганизмов, их количественное соотношение, расположение клеток, отношение к окраске, подвижность, наличие и расположение спор, а также капсул.
Для РИФ мазки фиксируют одним из следующих методов: метиловым спиртом — 5 мин, этиловым спиртом — 15 мин или смесью Карнуа — 10 мин. В зависимости от того, какие сыворотки имеются в наличии, можно использовать прямую РИФ или непрямую реакцию иммунофлюоресценции (РНИФ).
Для РИФ необходимы люминесцирующие видоспецифические сыворотки возбудителей газовой гангрены (в наставлениях по применению этих сывороток должны быть указаны их рабочие разведения). На фиксированный мазок наносят каплю рабочего разведения люминесцирующей сыворотки, после чего мазок помещают во влажную камеру (чашка Петри с увлажненной фильтрованной бумагой на дне). Окраска мазков происходит в течение 15 мин при комнатной температуре, затем их промывают в камере с проточной водопроводной водой или в буферном растворе.
Для РНИФ необходимы видоспецифические сыворотки к возбудителям газовой гангрены, антикроличья люминесцирующая сыворотка, бычий альбумин, меченный радомином (для окраски мазков-отпечатков). Мазки окрашивают во влажной камере последовательно, сначала видоспецифической сывороткой, затем отмывают, обрабатывают антикроличьей люминесцирующей сывороткой и отмывают.
При обработке мазков-отпечатков предварительно люминесцирующую сыворотку и бычий альбумин, меченный радомином, взятые в разведении в 2 раза меньшим рабочего, смешивают в равных соотношениях и смесь используют для обработки мазков, после чего мазки промывают.
Мазки, обработанные указанными методами, заключают под покровное стекло в капле смеси, содержащей 9 частей нейтрального глицерина и 1 часть физиологического раствора, а затем просматривают под люминесцентным микроскопом. Степень ярко-зеленой флюоресценции определяют по четырехплюсовой системе. При микроскопировании мазков-отпечатков на кирпично-коричневом фоне отмечаются микробные клетки, флюоресцирующие желто-зеленым светом.
Обнаружение большого количества, преобладающего над остальными формами, грамположительных крупных с четкими «обрубленными» концами палочек, не обладающих подвижностью и имеющих капсулы, может свидетельствовать о наличии в материале С. perfringens. В совокупности с положительными результатами РИФ, а также с характерными клиническими симптомами заболевания это дает основание уже через 1,5-2 ч после поступления материала дать ориентировочный ответ о возбудителе заболевания.
2. Посев исследуемых материалов на жидкие и плотные питательные среды. В качестве жидких питательных сред обогащения применяют среды на мясном или печеночном бульоне с 0,08% цистеина или 0,03% тиогликолевой кислоты, а также лакмусовое молоко. В качестве селективных сред используют те же бульоны с добавлением 0,005% азида натрия или 0,01% неомицина (канамицина, полимиксина).
В целях выделения отдельных колоний и получения чистых культур делают посевы на плотные среды: сахарный кровяной агар по Цейсслеру, агар Вильсона—Блэра, среду Виллиса—Хоббса, а также на высокий столбик агаровых сред.
Посев жидких образцов. Все жидкие образцы патологических материалов в объеме 2 капель высевают на чашки Петри с плотными средами и растирают по поверхности всей чашки шпателем. Одновременно производят посев 5-10 капель каждого образца исследуемого материала на дно пробирок с жидкими питательными средами (среды обогащения, лакмусовое молоко). Каждый образец материала вносят в 3 пробирки с одной из указанной сред. Одну пробирку прогревают при 75°С 20 мин. В условиях прогревания погибает большая часть посторонней вегетативной микрофлоры. Один из непрогретых образцов инкубируют при 42-43°С, остальные 2 посева — при 37°С. Обычно в случае массивного обсеменения образца активное размножение клеток С. perfringens при температуре 42-43°С наблюдаются уже через 1,5-2 ч культивирования посевов.
Кровь высевают в количестве 10% к объему жидкой питательной среды без предварительного прогрева и инкубируют до 3 сут.
Посев плотных образцов. Каждый образец (мышцы, кусочки органов) измельчают стерильными ножницами или скальпелем, растирают в стерильной ступке со стеклянным порошком и разводят питательной средой в соотношении 1:2. По 2 капли суспензии наносят на плотную питательную среду и втирают в поверхность, в жидкие среды вносят по 5-10 капель суспензии.
Посев на высокий столбик агаровых сред производят следующим образом: агар в тонких пробирках расплавляют и охлаждают до 45-50°С; не отламывая конца пастеровской пипетки, погружают ее в исследуемый материал (исходный посев) и переносят его последовательно из пробирки в пробирку, тщательно перемешивая. На каждый посев следует брать 5-8 пробирок со столбиком агаровой среды. Охлажденные пробирки с посевом помещают в термостат при температуре 37°С.
3. Определение токсинов возбудителей газовой гангрены в отделяемом из раны, экссудатах серозных полостей и в средах обогащения. Учитывая, что газовая гангрена является токсинообусловленным процессом, на всех этапах бактериологического анализа определяют видоспецифические токсины, продуцируемые микроорганизмами.
Летальные токсины гангренозных микробов можно с достоверностью определить только по летальному эффекту и его нейтрализации на белых мышах в реакции биологической нейтрализации (РБН) с соответствующими антитоксическими гангренозными сыворотками. Тем не менее обнаружение токсинов является одним из экспрессных методов лабораторной диагностики газовой гангрены, так как часто в исходных патологических материалах без высева и культивирования можно быстро выявить, специфический токсин.
Для выявления гангренозных токсинов при помощи РБН используют жидкие патологические материалы и суспензии плотных образцов ткани после разведения в 2 раза физиологическим раствором и центрифугирования при 3-4 тыс. об/мин в течение 15 мин.
Принцип постановки РБН идентичен для выявления всех клостридиальных токсинов: в первую пробирку (опыт) вносят 1,5 мл испытуемого материала и 0,75 мл антитоксической гангренозной сыворотки активностью 5-10 МЕ/мл; во вторую пробирку (контроль) вносят 1,5 мл испытуемого материала и 0,75 мл физиологического раствора. После экспозиции при комнатной температуре в течение 30-40 мин каждую смесь вводят по 0,75 мл внутривенно (или внутрибрюшинно) двум белым мышам — сначала из контрольной, а затем из опытной пробирки. В случае гибели контрольных мышей и выживании опытных РБН считается положительной, а вид и тип сыворотки, использованной для нейтрализации токсина в опытной пробирке, указывает на вид и тип искомого токсина.
При наличии в лаборатории антигангренозных диагностических (или лечебных антитоксических) сывороток РБН прежде всего ставится с сывороткой С. perfringens. Следует отметить, что при наличии токсина С. perfringens в исследуемом материале, особенно при введении его внутривенно, уже через 30-40 мин у мышей появляется гематурия, что является диагностическим признаком и позволяет в течение 1 ч наблюдать положительную РБН на мышах.
Иммуносерологические реакции (РИГА, ИФА и др.), выявляющие антигенную специфичность токсинов, а не токсический эффект, при наличии высокоспецифичных иммуноглобулиновых тест-систем могут быть также использованы для идентификации вида гангренозных микробов.
б) Второй день исследования:
1. Микроскопирование мазков из культур, выросших на средах обогащения, пересев культур на плотные питательные среды. Просматривают посевы на жидких питательных средах начиная с 2 ч инкубирования. Отмечают характерные изменения лакмусового молока: образование оранжево-красного творожистого сгустка и просветление сыворотки с газообразованием. В жидких средах обогащения отмечается бурное газообразование, помутнение среды, что свидетельствует о росте возбудителей газовой гангрены. В таких случаях следует сразу проводить дальнейшие исследования посевов на наличие токсина и для выделения чистой культуры.
2. Изучение колоний, выросших на плотных питательных средах, пересев колоний на жидкие питательные среды. Просматривают все типы колоний, выросшие на плотных питательных средах, отмечают их форму, характер поверхности, цвет. На средах с кровью С. perfringens и С. oedematiens образуют колонии размером 1 -4 мм, окруженные зоной гемолиза, круглые с ровными или изрезанными краями. Колонии С. histolyticum и С. septicum образуют колонии с неровными краями в виде отростков, полупрозрачные, сероватого цвета, без зон гемолиза.
На среде с яичным желтком и лактозой (среда Виллиса—Хоббса) колонии С. perfringens окружены зоной белой опалесценции с изменением цвета индикатора на красный, а колонии С. oedematiens — зоной жемчужной опалесценции. Вокруг колоний С. histolyticum и С. septicum зоны опалесценции отсутствуют. На среде Вильсона—Блэра колонии всех указанных клостридий приобретают интенсивный черный цвет.
В последних пробирках с высоким столбиком агаровой среды чрез 1-2 сут. роста появляются отдельные колонии в виде комочков ваты, пушинок с уплотненным центром или же правильных дисков (чечевичек). Подозрительные колонии пересевают на жидкую питательную среду в пробирках.
Исследуют путем микроскопирования колонии, выросшие на плотных средах, и при наличии характерных по морфологии клеток делают пересевы на лакмусовое молоко и на жидкие питательные среды (среда Китт—Тароцци) для выделения чистой культуры.
3. Учет реакции нейтрализации токсинов возбудителей газовой гангрены в РБН — см. в статье "Определение токсинов возбудителей газовой гангрены.."
в) Третий день исследования:
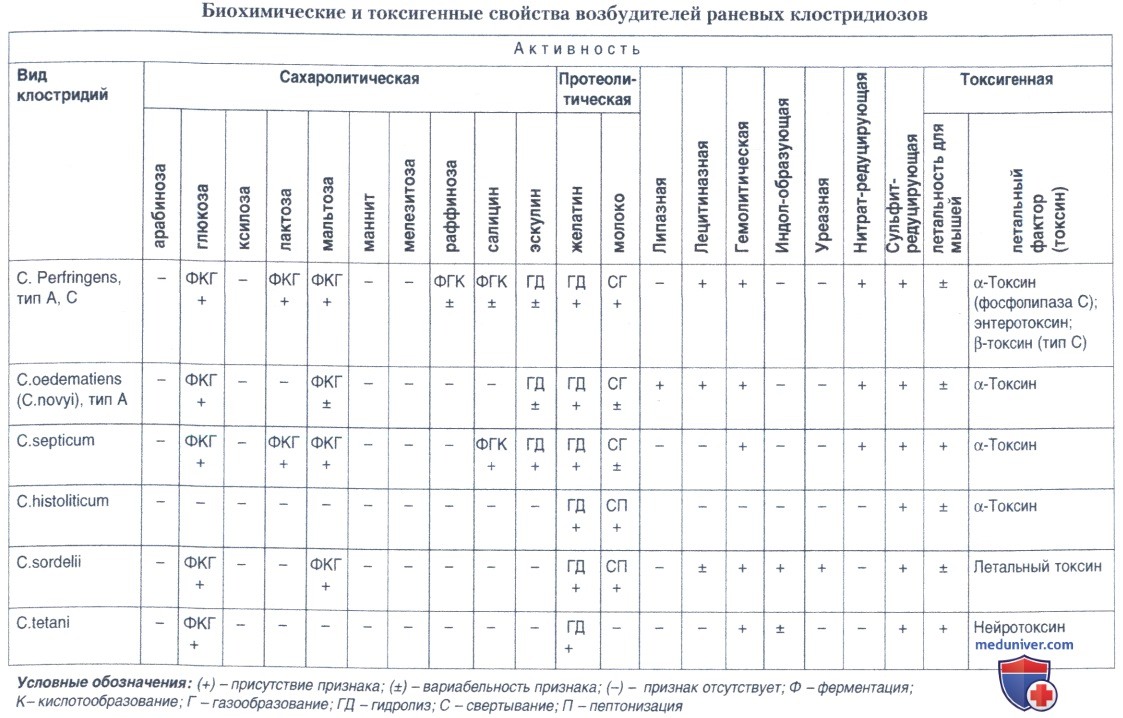
1. Изучение видовой принадлежности (идентификация) культур, выросших из отдельных колоний. Идентификацию выделенных культур проводят с учетом биохимических и токсигенных характеристик возбудителей газовой гангрены, согласно данным таблицы ниже. Весь процесс выделения и идентификации видов возбудителей газовой гангрены занимает, как уже говорилось выше, около 72 ч.
Хотя метод быстрого определения антибиотикочувствительности основного возбудителя газовой гангрены С. perfringens типа А разработан нами в 1982 г., до сего времени он не нашел применения в практике.
2. Критерии диагностики газовой гангрены. В каждом конкретном случае положительный ответ дается на основании совокупности клинических и лабораторных данных.
Предварительный ответ, позволяющий скорректировать методы лечения больного в первые 3 ч, выдают на основании данных экспресс-анализа: световая и имму-нофлюоресцентная микроскопия, посев на лакмусовое молоко.
Окончательный положительный ответ выдают по совокупности данных предварительного ответа и одного из следующих положительных результатов анализа:
— выявление токсинов возбудителей газовой гангрены в материалах от больного или трупа, а также в посевах на среды обогащения (в период 6-18 ч);
— обнаружение возбудителей газовой гангрены в посевах крови больного или в посевах крови из сердца, печени, селезенки трупа (в период 24-36 ч);
— установление вида возбудителя по его токсигенным и биохимическим свойствам (в течение 72 ч).
Видео строение, микробиология возбудителя газовой гангрены (Clostridium perfringens)
- Читать далее "Лечение и профилактика газовой гангрены"
Редактор: Искандер Милевски. Дата публикации: 16.12.2019
- Возбудители газовой гангрены (клостридии, Clostridium): морфологические и культуральные свойства
- Генетика и антигены возбудителя газовой гангрены (C. perfringens)
- Факторы патогенности возбудителя газовой гангрены (C. perfringens)
- Патогенез и иммунитет при газовой гангрене
- Эпидемиология газовой гангрены
- Микробиологическая диагностика возбудителя газовой гангрены (клостридий, Clostridium)
- Лечение и профилактика газовой гангрены
