Микробиологическая диагностика гонококка (N. gonorrhoeae)
Микробиологическая диагностика гонореи основана на полном бактериологическом исследовании, считающимся «золотым стандартом». Основным материалом для исследования при подозрении на гонорею является отделяемое уретры лиц обоего пола, секрет цервикального канала и других слизистых оболочек. Для повышения достоверности бактериологического исследования желательно брать одновременно два образца и более, например, из уретры и цервикального канала, или из уретры и прямой кишки (глаза, ротоглотки). Слизь из влагалища имеет смысл исследовать только у детей, беременных и пожилых, так как вагинальный эпителий молодых и зрелых женщин не колонизируется гонококком. У новорожденных берут гной из конъюнктивы, отделяемое при ринитах и вагинитах, гастральную жидкость.
Независимо от органа для взятия материала на бактериологическое исследование используют специальные тампоны промышленного производства или самостоятельно приготовленные из ваты, импрегнированные 1% взвесью активированного угля.
Гной из уретры берут через 3 ч после мочеиспускания путем надавливания на головку полового члена (у мужчин), используя бактериологическую петлю или тампон, либо ложечку Фолькмана (у женщин). Окружающие ткани перед этим протирают сухим марлевым тампоном. Из шеечного канала, глаза, ротоглотки, материал берут тампоном. Для взятия пробы из прямой кишки тампон вводят в анус на глубину 3 см и в течение 10 с круговыми движениями снимают содержимое слизистой оболочки. В случае загрязнения тампона фекалиями используют новый тампон. Для взятия соскоба со слизистой оболочки прямой кишки используют ложечку Фолькмана.
При наличии гноя или экссудата в материале из уретры, шейки матки, глаза гной предварительно микроскопируют. В этом случае материал берут дважды и для мазков используют первую порцию. Каплю гноя из уретры сразу после взятия наносят на предметное стекло и растирают другим стеклом или бактериологической петлей. Так же готовят мазки из отделяемого шеечного канала и глаза, используя тампон, которым брался материал. Из каждого образца готовят по два мазка. Высушенные на воздухе мазки фиксируют спиртом, окрашивают 1%-ным водным раствором метиленового синего и по Граму, после чего микроскопируют с иммерсией. В мазках из гноя гонококки расположены внутри и вне фагоцитов в виде кучек, пар и отдельных кокков.
В случае выявления типичных грамотрицательных виутриклеточно расположенных диплококков выдается ответ об обнаружении микроорганизмов, морфологически сходных с гонококком.
Независимо от результатов бактериоскопического исследования, обязательным является бактериологическое исследование — посев и изучение культуры гонококка. Для посева материала из уретры, шейки матки и глаза материал берут повторно, новыми тампонами. Материал из ротоглотки, прямой кишки, влагалища не микроскопируют, а сразу подвергают культуральному исследованию.
Питательные среды для посевов материала, содержащего гонококк, должны соответствовать его высоким требованиям к условиям культивирования. Приготовленные для посевов среды должны быть свежими (сделаны не ранее, чем за 24-48 ч до использования). Перед посевом их необходимо прогреть в термостате. Среды с посевами могут находиться при комнатной температуре в течение минимального срока, термостат должен быть четко отрегулирован на 36-37 °С.
При бактериологическом исследовании на гонококк следует помнить, что он обитает в открытых полостях человеческого тела, заселенных нормальной флорой. Среди ее представителей могут быть родственные гонококку нейссерии — комменсалы слизистых оболочек урогенитального тракта и даже менингококк. Что касается содержимого ротоглотки, то там обязательно имеются нейссерии, а в 5-10% случаев встречается менингококк. Учитывая морфологическое сходство многих видов нейссерий друг с другом, желательно доводить исследование до этапов выделения и изучения чистой культуры, а при экстрагенитальной гонорее -- обязательно.
Первый день. Взятый для посевов материал немедленно высевают на питательную среду. При невозможности сделать посев непосредственно после взятия материала тампоны погружают в пробирку с полужидкой транспортной средой, содержащей 0,1% тиогликолевой кислоты (среды Стюарта, Эймиса;). Погруженные в среду тампоны могут сохраняться в холодильнике, но должны быть доставлены в лабораторию не позднее, чем через 6 ч после взятия материала. От губительного действия холода гонококк защищен коллоидной средой; при этом подавляется размножение посторонней флоры.
В лаборатории материал засевают в 2 пробирки со скошенным агаром специального состава для гонококка. Засеянные среды помещают в термостат, желательно в контейнере, содержащем 5-7% CO2.
Второй день. Через 24 ч инкубации изучают появившийся бактериальный рост. Если роста подозрительных колоний нет, посевы сохраняют в термостате еще двое-трое суток. На скошенном агаре вырастает смешанная культура содержащая микрофлору слизистой оболочки уретры (или других открытых полостей) и, возможно, гонококк. На участок скопления колоний, подозрительных на гонококковые, наносят каплю реактива на оксидазу (1%-ный раствор парадиметилфенилендиамина) или ставят тест с коммерческой индикаторной бумажкой. Если происходит изменение цвета индикатора, сходные колонии захватывают петлей для приготовления препарата-мазка, окрашенного по Граму. Окраску по Граму лучше производить в модификации Калины, так как при этом грамотрицательные бактерии более четко дифференцируются. Метод особенно пригоден при окраске культур, а не мазков гноя. Обнаружение в смешанной культуре грамотрицательных оксидазоположительных кокков позволяет с большой долей вероятности констатировать присутствие гонококка. На этом этапе, при остром уретрите и цервиците, может быть выдан окончательный ответ об обнаружении микроорганизма, сходного с гонококком, или об отсутствии такового.
В сомнительных случаях, а также при экстрагенитальной гонорее, хронической гонорее и гонорее у детей обязательно выделение подозрительной на гонококк нейссерии в чистой культуре и ее идентификация. Для этого смешанную культуру рассевают в чашке Петри с агаровой средой, пригодной для выделения и культивирования гонококка. Посевы инкубируют в присутствии 5-7% СO2.
Третий день. Если на второй день исследования был сделан рассев смешанной культуры с целью выделения гонококка в чистой культуре, то исследование продолжается. Просматривают рассев в чашке Петри, отбирают подозрительные на гонококк колонии и несколько из них отсевают в пробирки со скошенной агаровой средой для гонококка.
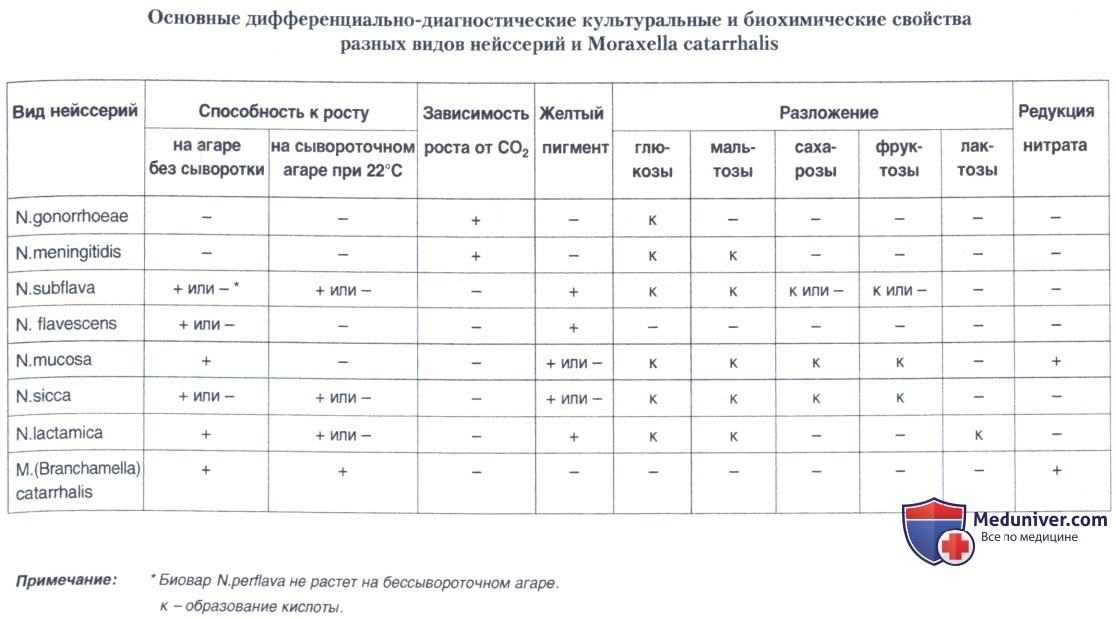
Четвертый день. Изучают посевы изолированных колоний, сделанные накануне. Делают мазки по Граму (в модификации Калины). Если при микроскопии обнаруживается чистая культура грамотрицательных кокков, ставится реакция на оксидазу. При положительной реакции культуру относят к роду нейссерий. Для ее дифференциации с непатогенными нейссериями (а также с возможным менингококком), обитающими на слизистых урогенитального и респираторного трактов, культуру изучают на наличие пигмента. Непигментированные культуры отсевают на среды «пестрого ряда» для гонококка, содержащие глюкозу, мальтозу, фруктозу, сахорозу и лактозу. Посевы на средах с углеводами инкубируют без СO2.
Пятый день. Учитывают результаты посева изучаемой культуры на средах с углеводами. Гонококк, в отличие от беспигментных нейссерий и сходной с ними Moraxella catarrhalis, разлагает только глюкозу с образованием кислот без газа.
Выделенная чистая культура, содержащая грамотрицательные, морфологически сходные с нейссериями кокки, не образующая пигмента, имеющая характерные признаки колоний, обладающая оксидазой, разлагающая только глюкозу без газа, может быть идентифицирована как гонококк.
Таким образом, описанный процесс выделения и идентификации гонококка занимает 5 сут. и более, так как на некоторых этапах не всегда удается получить хорошо выраженный рост через 24 ч; посевы держат в термостате по 2-3 сут.
Для выделения чистой культуры гонококка можно делать прямой посев материала непосредственно после взятия или с транспортной среды в чашки Петри с плотной селективной средой, минуя этап получения и изучения смешанной культуры. Для этого к специальной агаровой среде добавляют антибиотики, подавляющие сопутствующую флору (кроме нейссерий). Селективные среды с антибиотиками можно приготовить на любой питательной основе, пригодной для гонококка, — собственного приготовления или сухой коммерческой с последующими биодобавками, а также с антибиотиками. Отечественные авторы рекомендуют добавлять линкомицин — 2 мкг/мл (для подавления грамположительных кокков) и полимиксин М — 20 ЕД/мл (для подавления кишечной флоры), а при исследовании материала из ротоглотки — еще и 1% оротовой кислоты.
ВОЗ рекомендует в качестве образца селективной среды для выделения гонококка среду Тэйер-Мартина, содержащую в качестве ингибиторов роста грамиоложительных кокков и энтеробактерий соответственно ванкомицин и колистин, а для подавления роста грибов — нистатин. При посеве ректального материала для подавления роста протея к среде добавляют еще и триметоприм (5 мкг/мл). По рекомендации ВОЗ, любой материал при подозрении на гонорею засевается прямо в чашки Петри с селективной агаровой средой с обязательным выделением чистой культуры во всех случаях.
Для определения чувствительности к антибиотикам чистую культуру гонококка выделяют во всех случаях.
Хранение культур гонококка. Наиболее надежным способом сохранения гонококковой культуры является лиофильное высушивание. Допустимо хранение культур на полужидких средах с тиогликолевой кислотой для транспортировки и сохранения материала.
а) Определение чувствительности гонококка к антибактериальным препаратам. Чувствительность гонококка к антибактериальным препаратам рекомендуется определять в специализированных лабораториях в целях получения стандартных результатов.
Чувствительность гонококка определяют только на агаровых средах методом дисков или серийных разведений. Для получения стандартных и сравнимых результатов в качестве основы используют сухую коммерческую среду GG-агар (Difco). Вместо нестандартных биодобавок к расплавленному и остуженному до 50°С агару стерильно добавляют 1% (по объему) специального раствора, содержащего аминокислоты, глюкозу, витамины группы В и другие стимуляторы роста.
Среду разливают по чашкам Петри и испытывают чувствительность культуры общепринятым методом, используя для контроля референтный штамм гонококка (АТСС 4926). При применении метода дисков следует помнить, что диаметры зон задержки роста чувствительных штаммов гонококка для разных антибиотиков неодинаковы. Например, для бензилпенициллина зона подавления роста равна минимум 26-34 см, а для цефтриаксона — 39-51 см. Сходные различия в величинах МПК отмечены и при определении чувствительности методом серийных разведений. Поэтому при учете результатов необходимо пользоваться специальными таблицами с указанием зон ингибиции роста для всех современных препаратов.
б) Методы экспресс-диагностики. Перспективно применение ПЦР. Однако она дает ложноположительные результаты в течение первых 20 дней после излечения от гонореи.
Методы серологической диагностики не оправдали себя, что связано с высокой частотой изменчивости антигенов гонококка.
в) Лечение и профилактика. Для лечения гонореи используют антибиотики — цефалоспорины III поколения, фторхинолоны, спектиномицин.
Для профилактики бленнореи всем новорожденным вносят на конъюнктиву обоих глаз 1% раствор азотнокислого серебра (AgNO3). Вышеописанная антигенная пластичность гонококка и его сложные взаимоотношения с иммунной системой человека не позволяют надеяться на разработку полноценной вакцины против гонореи в ближайшие годы. Следовательно, воздействие на эпидемический процесс путем создания невосприимчивости населения к этой инфекции пока невозможно. Повлиять на механизм передачи (прямой половой контакт) органы здравоохранения также не в силах. Остается единственный реальный путь борьбы с распространением гонореи — воздействие на источники инфекции. Определенных успехов в снижении заболеваемости можно достичь путем максимально полного выявления больных (в том числе латентными формами) и обследования их половых партнеров с последующим лечением эффективными препаратами. Эта проблема может быть решена средствами современной микробиологической диагностики.
- Читать далее "Менингококк (Neisseria menengitidis): морфологические и культурально-биохимические свойства"
Редактор: Искандер Милевски. Дата публикации: 25.12.2019
