Лабораторная диагностика легионелл (L. pneumophila)
Существуют пять основных лабораторных методик, используемых в диагностике легионеллеза:
1. Выделение культуры возбудителя — золотой стандарт.
2. Определение уровня антител в сыворотке крови.
3. Определение растворимого антигена в моче.
4. Выявление возбудителя в клиническом материале методом иммунофлюоресценции.
5. Выявление возбудителя при помощи ПЦР.
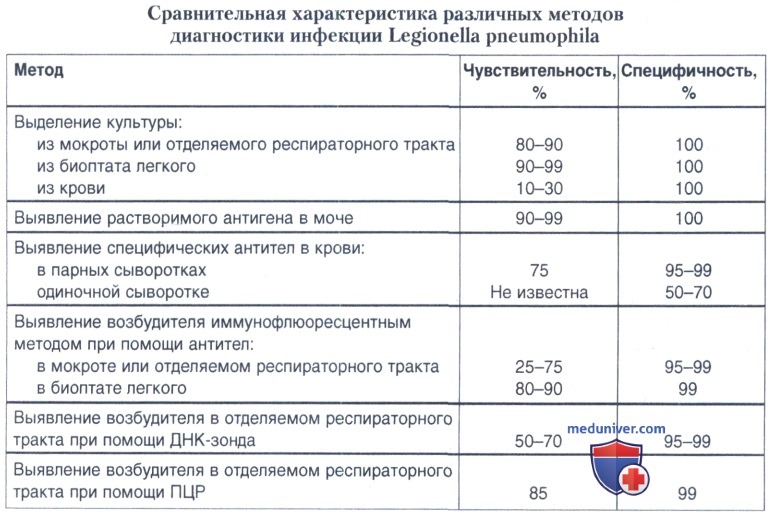
Опыт применения разных методов в последние годы, данные о чувствительности и специфичности различных методов (табл. 29.3), позволил ВОЗ рекомендовать для лабораторной диагностики болезни легионеров три группы методов. Диагноз легионеллеза в случае острой инфекции нижних дыхательных путей (клинически и рентгенологически подтвержденной пневмонии) считается установленным:
а) при выделении легионелл из отделяемого респираторного тракта или легочной ткани;
б) при 4-кратном или более нарастании титра специфических антител к L. pneumophila в реакции непрямой иммунофлюоресценции;
в) при определении специфического растворимого антигена легионелл в моче иммуноферементным или иммунохроматографическим методом.
При отсутствии первой сыворотки крови, взятой в ранние сроки болезни, выявление высокого уровня антител к L. pneumophila (1:128 и выше) в одиночной сыворотке методом непрямой иммунофлюоресценции позволяет считать диагноз легионеллеза предположительно установленным. Остальные методы используются как дополнительные и имеют вспомогательное значение.
Для выделения легионелл используют материал бронхоскопии, плевральный экссудат, материал биопсии или аутопсии легкого. Плевральный экссудат, материал бронхоскопии, полученный стерильно до 7-го дня болезни в количестве 1-2 мл помещают в стерильную пробирку, плотно закрытую резиновой пробкой, и хранят при +4°С не более суток. Материал биопсии или аутопсии помещают в стерильные флаконы, плотно закрытые пробками, и хранят или транспортируют при +4°С в течение суток (не дольше). Длительное хранение материала (до 1 года) возможно лишь при температуре -70°С.
Для выделения легионелл из клинического материала используют буферный угольно-дрожжевой агар с α-кетоглютаровой кислотой (среда BCYEα). Данная среда является стандартной средой для выделения и культивирования легионелл в соответствии со стандартом ISO 11731Е. Варианты среды BCYEα производит большое число фирм («ХайМедиа», «Биорад», «Оксоид», «БиоМерье», «Мерк» и др). Среду также можно приготовить непосредственно в лаборатории, используя компоненты, перечисленные в соответствующем разделе данного пособия.
Рост колоний на клиническом материале наблюдается не ранее, чем через 4-5 сут. Максимальное количество видимых колоний вырастает на 8-10-е сутки. При подозрении на рост Legionella колонии пересевают на ту же среду и на среду, не поддерживающую рост возбудителя — контрольную среду. В качестве контрольной среды обычно используют аналогичную среду BCYEα без добавления L-цисте-ина и пирофосфата железа или соответствующей ростовой добавки фирмы-производителя. Роста во втором пассаже на среде BCYEα при отсутствии роста на контрольной среде обычно достаточно для подтверждения выделения культуры рода Legionella. Если культура растет на контрольной среде, то это не Legionella.
Легочная ткань часто контаминирована микрофлорой, быстрый рост которой при высеве на питательные среды не позволяет выделить культуру легионелл. Для ингибирования роста посторонней микрофлоры в среду добавляют 4 мкг/мл цефамандола, 80ЕД/мл полимиксина В и 8 мкг/мл анизомицина. Цефамандол можно заменить ванкомицином (0,5мкг/мл). Следует отметить, что цефамандол, в отличие от ванкомицина, подавляет рост некоторых видов легионелл, не продуцирующих β-лактамазы, включая L.micdadei.
В отличие от стандартной ростовой добавки, обязательно содержащей L-цистеин и пирофосфат железа, антимикробная добавка, подавляющая рост посторонней микрофлоры, может различаться по составу у различных фирм-нроизводителей, а также в зависимости от степени контаминации исследуемого материала.
Существуют также два других метода подавления роста посторонней микрофлоры в клиническом материале при исследовании на легионеллез: прогревание в водяной бане в течение 30 мин при температуре 50°С или 5-минутная экспозиция HCl-KCl-буфером при pH 2,2 (используется для выделения легионелл из сильно контаминированных образцов).
Поскольку морфология легионелл типична для грамотрицательных бактерий, а методы окраски не являются специфичными, то окраска по Граму или Романовскому-Гимзе малоинформативна.
Возбудитель легионеллеза обладает окислительно-восстановительными ферментами — оксидазой и каталазой, разжижает желатину, вызывает гидролиз гиппурата натрия. Легионеллы не ферментируют углеводы, не вызывают редукцию нитратов в нитриты, не обладают уреазной активностью. На практике в последние годы для идентификации выросших колоний используют латекс-агглютинацию при помощи соответствующих наборов или реакцию иммунофлюоресценции. Для быстрой идентификации выросших колоний легионелл хорошо зарекомендовали себя наборы производства «Оксоид» и «Биорад».
Выпускается несколько вариантов наборов, позволяющих выявлять колонии L. pneumophila серогруппы 1; L. pneumophila серогруппы 2-14 — родоспецифический антиген, характерный для колоний других родов легионелл, позволяющий быстро идентифицировать возбудитель в лаборатории клинической микробиологии. Постановка реакции на стекле с суспензией предполагаемой колонии легионелл занимает не более 15 мин.
а) Серологическая диагностика. Помимо бактериологических методов для диагностики легионеллеза широко применяют серологические методы. Антигенная структура легионелл представляется достаточно сложной. Специфичность серо-групп обусловлена липополисахаридным антигеном. Разработанные в настоящее время методы иммунодиагностики основаны на определении в сыворотке крови больных специфических антител или обнаружении самого антигена в моче либо отделяемом респираторного тракта.
Наиболее распространенный и доступный практическим лабораториям метод лабораторной диагностики — выявление специфических антител в сыворотке крови больных методом непрямой иммунофлюоресценции. Сыворотку крови больных, подозреваемых на легионеллез, берут в первые дни и на 14-21-й день болезни. Кровь из вены в количестве 3-5 мл помещают в стерильную пробирку. После свертывания крови сгусток отслаивают от стекла пастеровской пипеткой и оставляют на 5-6 ч при комнатной температуре. Отделившуюся сыворотку отсасывают в стерильную пробирку и хранят при +4°С.
Для диагностики легионеллеза методом непрямой иммунофлюоресценции можно использовать тест-системы различных производителей: «Sigma», «Zeus Tech.», «Sanofi Diagnostics Pasteur» и др. Основным недостатком метода является ретроспективный характер диагностики, что неприемлемо в случае необходимости выбора тактики антибиотикотерапии тяжелой легионеллезной пневмонии.
Для постановки реакции каплю антигена наносят на предметное стекло, высушивают на воздухе в течение 30 мин, погружают в ацетон на 15 мин и вновь высушивают на воздухе. Сыворотку крови больного разводят в соотношении 1:16 0,15М фосфатным буфером (pH 7,2). Далее производят двукратные разведения от 1:32 до 1:512 в том же фосфатном буфере. На препараты с антигеном наносят разведения сыворотки, инкубируют в течение 30 мин при 37°С во влажной камере, промывают 5 мин фосфатным буфером и дистиллированной водой, высушивают на воздухе.
Далее на препараты наносят меченную флюоресцирующим изотиоционатом кроличью сыворотку против глобулинов человека, инкубируют в течение 30 мин при 37°С, промывают 5 мин, ополаскивают дистиллированной водой и высушивают. Препарат покрывают забуференной глицериновой средой и просматривают в люминисцентном микроскопе. Титры антител определяют по интенсивности свечения образующегося иммунного комплекса по 4-балльной шкале.
Результат считается положительным при не менее, чем 4-кратном нарастании титров антител в реконвалесцентных сыворотках по сравнению с первой, взятой в острый период заболевания. В случаях, когда проанализировать динамику изменения не представляется возможным, диагноз ставится по уровню специфических антител (1:128) в одиночной сыворотке (предварительный диагноз). При постановке реакции в качестве контроля используют положительную (титр не менее 1:256) и отрицательную (титр 1:16) сыворотки крови человека. Качество антигена может быть проверено в реакции непрямой иммунофлюоресценции с разведениями сыворотки крови кролика, иммунизированного антигеном L. pneumophila.
б) Методы экспресс-диагностики. Метод прямой иммунофлюоресценции -экспресс-метод, позволяющий обнаружить возбудитель в клиническом материале (материал, взятый при бронхоскопии и биопсии, плевральный экссудат) в острый период заболевания. Для диагностики используют легионеллезные диагностические люминисцирующие препараты производства фирм «Viramed», «Vircell» и др.
К сожалению, применение данного метода связано с необходимостью проведения инвазивных манипуляций для сбора материала, так как в мокроте возбудитель легионеллеза выявляют редко. Кроме того, моноклональные антитела к видоспецифическому антигену L. pneumophila дороги для рутинной диагностики, а тест-системы на основе поликлональных антител могут давать перекрестные реакции с Pseudomonas spp., Flavobacterium spp. и Bacteroides spp., и специфичность метода значительно понижается. Поэтому на практике в последние годы метод прямой иммунофлюоресценции используется, как правило, наряду с латекс-агглютинацией, для идентификации выросших на чашках колоний легионелл.
Для постановки реакции на предметное стекло наносят каплю исследуемого материала и делают тонкий мазок. Препарат подсушивают на воздухе при комнатной температуре и фиксируют в ацетоне 15 мин. На поверхность мазка, помещенного во влажную камеру, наносят каплю «рабочего разведения» легионеллезной люминесцирующей сыворотки. Препарат инкубируют при 37°С 20 мин, промывают 10 мин в фосфатном буфере (pH 7,2), дистиллированной водой, высушивают на воздухе, наносят глицериновую среду, покрывают покровным стеклом и просматривают в люминесцентном микроскопе.
Изумрудно-зеленое специфическое свечение не менее чем 3-5 клеток в поле зрения микроскопа свидетельствует о присутствии в исследуемом материале L. pneumophila.
С конца 90-х годов прошлого века для экспресс-диагностики легионеллеза стали использовать ИФА, позволяющий выявлять растворимый антиген легионелл в моче в острый период заболевания (первые 10 дней). Международные испытания, проводившиеся в 1998-1999 гг. под эгидой Европейской рабочей группы по легионеллезу показали высокую чувствительность и специфичность этого метода в обнаружении L. pneumophila серогруппы 1 в моче. В настоящее время во всем мире в 80% случаев первичный диагноз легионеллеза ставится на основе обнаружения легионеллезного антигена в моче.
При определении антигена других серогрупп L. pneumophila чувствительность и специфичность метода несколько ниже. Для других видов легионелл методика не отработана. ИФА проводят, используя диагностические тест-системы фирм «Biotest» (Германия) и «Вшах» (США).
Фирмой «Binax» разработан иммунохромато графический метод для быстрого определения антигена легионелл в моче. Метод практически не уступает по специфичности и чувствительности ИФА, не требует специального оборудования и широко используется клиническими микробиологами при диагностике тяжелых пневмоний. К достоинствам иммунохроматографического метода можно отнести и наличие аналогичной тест-системы «Binax» для быстрого выявления в моче растворимого антигена пневмококка, что позволяет быстро провести дифференциальную диагностику тяжелой пневмонии.
Тест-система «Binax» была с успехом применена при расследовании крупной эпидемической вспышки легионеллеза в г. Верхняя Пышма Свердловской области в 2007 г. Метод позволяет поставить окончательный диагноз легионеллезной пневмонии в течение 30 мин. Тест-система «Binax» зарегистрирована Росздравнадзором в 2008 г. и рекомендована для быстрой дифференциальной диагностики легионеллезной и пневмококковой пневмонии.
Для постановки ПЦР с целью диагностики легионеллеза обычно используют праймеры фрагмента гена mip или 16S rPHK L.pneumophila. В ряде работ указывают на возможность перекрестных реакций с бактериями рода Pseudomonas. Необходимость инвазивных процедур для получения клинического материала для исследований также ограничивает применение данного метода, поэтому в настоящее время ПЦР для диагностики легионеллеза используется лишь как дополнительный тест.
- Читать далее "Семейство Rickettsiaceae: таксономия"
Редактор: Искандер Милевски. Дата публикации: 14.2.2020
