Факторы патогенности возбудителя ботулизма (C. botulinum)
Ботулинический нейротоксин в составе сложных высокомолекулярных комплексов из желудочно-кишечного тракта или из раневой некротизированной ткани резорбируется в лимфатическую систему, откуда через общий лимфатический проток попадает в венозный кровоток. Циркулируя в крови, он поступает вначале в мышцы, а затем через двигательные мионевральные соединения — в аксоны мото-нейронов, к телам которых переносится системой ретроградного аксоплазматического транспорта. В результате развивается паралич, в основе которого лежит снижение возбудимости и расстройство интегративной деятельности альфа-мотонейронов, что в конечном итоге нарушает секреторный процесс в аксональных нервно-мышечных термнналях (окончаниях) — выброс передатчика ацетилхолина в мионевральные синапсы. Вслед за этим возникают симптомы нейропаралитического заболевания — ботулизма, в основе которых лежит повреждение нейромоторных единиц холинергических отделов вегетативной нервной системы.
Появляется мышечная слабость и типичные для ботулизма офтальмоплегические симптомы: диплопия, ослабление аккомодации и конвергенции глаз, ограничение подвижности глазных яблок, птоз, мидриаз, анизокория, стробизм, нистагм, вялость или отсутствие реакции зрачков на свет. Одновременно с этим возникают бульбарные расстройства: ограничение подвижности мягкого неба и языка, затруднение глотания, расстройства речи и глотания, характерная гнусавость голоса, снижение саливации. Мышечная слабость достигает наибольшей интенсивности в мышцах области носоглотки, шеи, проксимальных отделов рук, а затем ног. В случае смертельного заболевания паралитический синдром приобретает тотальный характер, развивается недостаточность внешнего дыхания фарингоспинального типа, и больные погибают от асфиксии.
а) Токсические комплексы. Основным отличием ботулинических токсинов от других токсинов бактериальной природы является то, что они представляют собой вполне определенные комплексы белков, включающие нейротоксин, нетоксичный неагглютинирующий белок и три типа гемагглютшшнов. Действующим началом этих комплексов является специфически активный белок нейротоксин. Строго говоря, термин «ботулинический токсин» определяет весь токсический комплекс, включая нейротоксин. При этом следует помнить, что заболевание вызывает ботулинический токсин, который способен проникать через желудочно-кишечный барьер и не разрушаться в организме. Однако нейротоксин отдельно, при отсутствии других белков комплекса, не может вызвать заболевания ввиду его крайней лабильности.
Идентифицированы три формы комплексов, величина которых охарактеризована по коэффициенту седиментации: 1) 12S, или форма М, размером около 300 кД; 2) 16S, или форма L, размером около 500 кД; 3) 19S, или форма LL, размером около 900 кД.
Состав этих комплексов у всех токсинотипов строго не установлен, однако принято считать, что форма 12S состоит из нейротоксина и нетоксичного неагглютинирущего белка NTNH, в то время как форма 16S представляет собой ассоциацию формы 12S с другими белками, имеющими свойства гемагглютшшнов (НА). У ботулинического токсина типа А идентифицировано три типа гемагглютшшнов: белок 15 кД (НА15), белок 35 кД (НА35) и белок 70 кД (НА70). Последний может быть протеолизирован и представлен в виде двух фрагментов 20 и 50 кД.
До настоящего времени остается неясным, какая же из форм ботулинических токсинов имеет отношение к ботулинической интоксикации в реальной жизни, так как имеет место большое несоответствие токсической летальной дозы при поступлении в организм токсина парентерально и per os. Имеются данные, что одна летальная доза очищенных нейротоксинов при введении их мышам per os составляет несколько миллионов внутри перитонеальных (в/п) DL50 для тех же животных и, по логике, не играет существенной роли при отравлении ботулиническим токсином. Одна летальная доза М-форм составляет от 95 000 до 3 600 000 в/п DL50, а для L-форм — от 1500 до 2 200 000 в/п DL50 в зависимости от типа ботулинического токсина. Наиболее высоко токсична кристаллическая форма ботулинического токсина типа А, для которого одна пероральная доза составляет 120 000 в/п DL50. Из сказанного можно сделать вывод, что чем больше размер токсического комплекса, тем выше его токсичность при пероральном поступлении.
Это объясняется тем, что токсин, находясь в желудке, подвергается воздействию жестких окружающих условий: во-первых, низких значений pH — 1,0-2,5, при которых нейротоксины необратимо денатурируются; во-вторых — протеолитических ферментов, в частности пепсина, вызывающего их деградацию. Экспериментально показано, что высокомолекулярные формы токсина более устойчивы к таким воздействиям, чем низкомолекулярные. И здесь проявляется та же закономерность — наиболее устойчивы к низким значениям pH кристаллические формы токсина (LL-формы), в меньшей степени — L-формы, в то время как М-формы и очищенные нейротоксины практически полностью инактивируются при pH 1,0-2,0. При pH 2,0 наиболее высокомолекулярные формы нейротоксинов инактивируются пепсином в меньшей степени, чем низкомолекулярные.
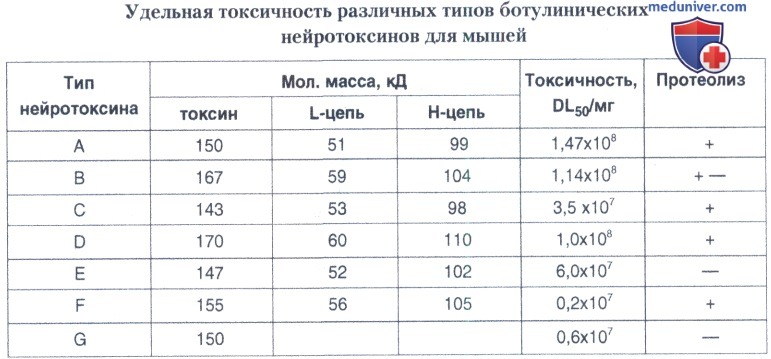
1. Нейротоксин. С. botulinum продуцируют семь серологически различных типов нейротоксинов, вызывающих сходный, если не идентичный, токсический эффект. Уникальная природа их биологической активности наводит на мысль, что молекулы всех типов нейротоксинов имеют общую конфигурацию.
Ботулинические нейротоксины не имеют сигнального пептида и, следовательно, не могут секретироваться бактериями в окружающую среду. В течение долгого времени считалось, что токсин выходит в окружающую среду в процессе аутолиза микробных клеток при длительном их культивировании. Однако результаты недавних исследований указывают на то, что токсин имеет фазу слияния с мембранами бактериальной клетки и затем выводится из нее посредством эксфолиации (отшелушивания) мембран.
Все ботулинические нейротоксины синтезируются как один полипептид с мол.массой около 150 кД. В результате действия эндогенных или экзогенных протеиназ происходит протеолиз молекул, в результате чего образуются два фрагмента, связанные дисульфидной связью, после восстановления которой фрагменты диссоциируют. Эти фрагменты названы легкой (L) и тяжелой (Н) цепью нейротоксина (N-концевой и N-концевой, соответственно).
L-цепь размером 50 кД включает энзиматический домен. Н-цепи нейротоксинов размером около 100 кД содержат два домена: транслокациоиный и рецепторсвязывающий (N-концевой и С-концевой, соответственно). НС-участки Н-цепей от 1150 до 1251-1315 остатков являются рецепторсвязывающими доменами. Рецепторсвязывающий домен, по-видимому, играет роль в распознавании клеток-мишеней и пути доставки токсической молекулы.
Нейротоксины типов A, D и Е синтезируются бактериальными клетками в виде предшественников и их активность увеличивается в процессе активации протеазами. Если токсинпродуцирующие культуры являются протеолитическими (все штаммы токсинотипа А и некоторые штаммы токсинотипа В), эндогенные протеазы активируют предшественник, переводя его в токсин. Если же культуры не являются протеолитическими, например, штаммы токсинотипа К, для активации нейротоксина необходима дополнительная обработка трипсином.
Нейротоксины типов А, В и F после триптического расщепления и последующего восстановления дисульфидных связей теряют биологическую активность на 99%. Таким образом, каждый фрагмент нейротоксинов не является токсичным.
Тип Е не является расщепленным (надтреснутым). После восстановления дисульфидных связей он также теряет токсичность, однако не в такой степени как нейротоксин, который перед восстановлением был протеолизирован. Восстановленные молекулы нейротоксинов не способны реагировать с антителами, полученными к нативному нейротоксину в виде его анаформы. Это свидетельствует о том, что в результате восстановления дисульфидных связей нарушается конформация белковой молекулы.
Предполагается, что действие ботулинических нейротоксинов (и столбнячного токсина) включает 3 фазы. Первая — связывание токсина с акцепторами, находящимися на поверхности нервных клеток-мишеней. Вторая — энергозависимое проникновение токсина или его части внутрь клетки. Третья — блокирование выделения нервной клеткой нейромедиаторов. При этом ботулинические нейротоксины преимущественно ингибируют выделение ацетилхолина в периферических нервах, а столбнячный токсин — выделение аминокислот в ЦНС.
2. Рецепция. Нейротоксин адсорбируется на специфических рецепторах в мембране нервных терминалей. Роль рецепторных структур выполняет неидентифицированный белок, возможно, в ассоциации с другими молекулярными структурами, например, с ганглиозидом GT1. За связывание с рецепторами ответствен фрагмент С нейротоксина.
3. Транслокация (перенос). За транслокацию молекулы токсина внутрь нейрона ответствена N-концевая половина полипептида Н-цепи.
Внутриклеточная инактивация мишеней. Ботулинический токсин блокирует процесс экзоцитоза (выхода биомолекул наружу — см. ниже) нейронов, посредством которого осуществляется вывод медиатора ацетилхолина в синаптическую щель. Молекулярный механизм нарушения этого процесса сводится к тому, что энзиматический фрагмент токсина (L-цепь; Zn-эндопептидаза) специфически гидролизует белки, участвующие в процессе экзоцитоза. Последние входят в комплекс 20S, который участвует в процессе слияния везикул с мембранами. Гидролиз токсином специфических белков приводит к инактивации этого звена экзоцитоза.
Энзиматический гидролиз внутриклеточных мишеней различными типами ботулинических токсинов осуществляется следующим образом. Токсины типа В, F, D и G, а также столбнячный токсин гидролизуют белок VAMP (Vesicle Associated Membrane Protein, англ. — мембранный белок, ассоциированный с везикулой) или синаптобревин, в то время как токсины типа А гидролизует SNAP25 (Synaptosomal Associated Protein, англ. — белок, ассоциируемый с синаптосомой), а токсин типа С — белок синтаксин. Субстратная специфичность ботулинических и столбнячного токсина обнаруживается не только по отношению к различным белкам, но и по их способности гидролизовать лишь определенные аминокислотные последовательности в белковой молекуле.
4. Нетоксичный негемагглютинирующий белок (NTNH). Белок NTNH с мол. массой 139 кД является продуктом гена ntnh. Этот ген имеют все токсинотипы, а белки этих генов являются наиболее консервативными и обнаруживают от 57 до 99% идентичности.
Белок NTNH/А может протеолизироваться, что ведет к появлению двух фрагментов с мол. массой 106 и 13 кД. Предполагается, что непротеолизированная форма NTNH/А ассоциирована с формами L и LL токсических комплексов, в то время как протеолизированный белок — только с формами М.
Функциональная роль в токсическом комплексе этих белков неизвестна, но предполагается, что они играют важную роль в формировании комплексов различных размеров.
5. Гемагглютинины. У ботулинических токсинов идентифицировано три типа гемагглютининов: белок 15-17 кД (НА17), белок 34-35 кД (НА35) и белок 70 кД (НА70). Белки НA17 идентифицированы у токсинов типов А, В, С и I). Уровень идентичности их колеблется от 58 до 66; они не имеют сходства с другими известными белками. Функция их неизвестна. Белки НА35 присутствуют у всех токсинотипов, за исключением С. argentiense. Эти белки также не обнаруживают сходства с другими известными белками и функция их тоже неизвестна. Белки НA70 идентифицированы во всех токсинотипах, за исключением А2, Е и F. Этот белок в типе А подвергается протеолизу, в результате чего образуются два пептида: N-концевой размером около 20 кД и С-концевой размером около 50 кД. Белок 50 кД обнаруживает значительное сходство с энтеротоксином С. perfringens. Имеются сведения, что энтеротоксин после связывания с клеточными рецепторами погружается в мембрану, образуя комплекс с другими белками (размер комплекса около 160 кД), что ведет к образованию пор в мембране.
Возможно, белок 50 кД может также выполнять сходную функцию. В токсинотипах С. botulinum А2 (не имеющих гемагглютинина), Е и F имеется ген, кодирующий белок размером 47 кД. Гены этих токсинотипов обнаруживают высокую степень родства. Функциональная роль белка 47 кД неизвестна.
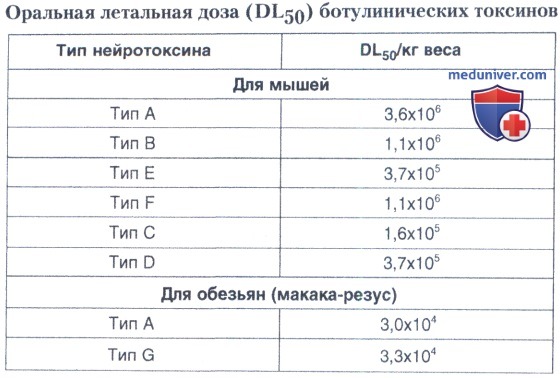
б) Токсические дозы. Активность токсинов А и В от бактерий, выращенных на искусственных питательных средах и развивающихся в различных консервированных пищевых продуктах, может составлять от 10 тыс. до 1-3 млн смертельных доз в 1 мл для белой мыши. Получены сухие и кристаллические ботулинические токсины, которые содержат в 1 мг до 100 млн. смертельных доз для мыши. Возбудители ботулизма токсинотипа Е, а также непротеолитические штаммы токсинотипа В и некоторые штаммы токсинотипа Е образуют на питательных средах и, возможно, в пищевых продуктах недостаточно активный предшественник токсина — протоксин, биологическая активность которого значительно усиливается при попадании его в желудочно-кишечный тракт человека и животных в результате воздействия протеолитических ферментов. При добавлении трипсина, панкреатина in vitro также происходит активация протоксина, который переходит в токсин. В таблицах ниже представлены удельная токсичность и оральная летальная доза ботулинических токсинов для лабораторных животных.
В отношении токсических доз ботулинических нейротоксинов для человека точных данных нет. При экстраполяции на людей данных, полученных на приматах, предполагается, что летальная доза для человека составляет:
— при оральном введении — 30 000 мышиных DL50/кг веса или для человека весом 100 кг — 3 000 000 мышиных DL50;
— при парентеральном введении — 40 мышиных DL50/кг веса или для человека весом 100 кг — 4000 мышиных DL50;
— при аэрозольном введении — сведений нет, однако высказывается предположение, что летальная доза токсина при этом пути введения приблизительно в 10 раз меньше, чем при парентеральном введении.
По другим данным, для человека весом 70 кг летальная доза богулинического токсина типа А может составлять около 0,09-0,15 мкг внутривенно или внутримышечно, 0,70-0,90 мкг ингаляционно и 70 мкг перорально.
Терапевтический препарат ботулинического токсина (применяется для лечения миастений) не представляет практического интереса как высокотоксичное для человека вещество (например, для биотеррористов), так как один флакон его (100 ЕД) содержит только 0,3% ингаляционной летальной дозы и 0,005% оральной летальной дозы для человека.
- Читать далее "Нейротоксины и экзоцитоз возбудителя ботулизма (C. botulinum)"
Редактор: Искандер Милевски. Дата публикации: 18.12.2019
- Возбудитель ботулизма (Clostridium botulinum): таксономия
- Морфологические и тинкториальные свойства возбудителя ботулизма (C. botulinum)
- Устойчивость возбудителя ботулизма (C. botulinum) к факторам внешней среды
- Культурально-биохимические группы возбудителя ботулизма (C. botulinum)
- Факторы патогенности возбудителя ботулизма (C. botulinum)
- Нейротоксины и экзоцитоз возбудителя ботулизма (C. botulinum)
- Генетическая характеристика нейротоксинов возбудителя ботулизма (C. botulinum)
- Патогенез и клиника ботулизма
- Иммунитет к ботулизму
- Эпидемиология ботулизма
- Лабораторная диагностика ботулизма
- Лечение и профилактика ботулизма
