Методы определения стафилококковых энтеротоксинов
Для выявления СЭ существует целый ряд биологических, молекулярно-генетических, иммунологических и физико-химических методов, отличающихся между собой как но чувствительности, так и по времени получения результатов и по сложности определения.
Материалом для исследования при пищевом отравлении является пищевой продукт, вызвавший пищевое отравление, рвотные массы, промывные воды, выделенные штаммы стафилококков.
а) Подготовка проб для определения СЭ в пищевых продуктах. Концентрация СЭ в пище обычно мала для того, чтобы ее можно было обнаружить при помощи большинства методов, поэтому возникает необходимость использования биохимических методов извлечения СЭ из исследуемого продукта и его концентрации.
Для определения СЭ в пищевых продуктах необходимо провести их экстракцию и очистку. Желательно, чтобы конечная концентрация экстракта составляла не менее 0,2 см3 из 100 г.
Для извлечения СЭ используют натриево-фосфатный буфер (0,05 М фосфат в 0,15 М NaCl, содержащий 0,05% азида натрия, pH 7,6) для набора RIDASCREEN и 0,25 М Трис-буфер (pH 8,0) для набора TECRA. Для проведения экстракции СЭ твердые продукты измельчают, гомогенизируют, осадок удаляют центрифугированием при охлаждении, а в опыт берут надосадочную жидкость. Экстракты пищи помещают в мешочек для диализа и проводят концентрирование экстракта до объема 15-20 мл путем помещения мешочка с препаратом в 30 % раствор полиэтиленгликоля (Carbowax 20 000).
Затем доводят pH до 7,5 с помощью 0,005 М фосфорной кислоты H3PO4 и проводят центрифугирование в течение 10 мин при 16300 об/мин. Далее надосадочную жидкость смешивают с равным объемом хлороформа и встряхивают 10 раз в делительной воронке. Смесь экстракта с хлороформом центрифугируют в течение 10 мин при 16 300 об/мин. Экстракт помещают в делительную воронку для удаления хлороформа. Затем полученный водный слой разбавляют 40 объемами буферного раствора фосфата натрия 0,005 М pH 5,7. Разбавленный таким образом экстракт пропускают через колонку с карбоксилметилцеллюлозой со скоростью 1-2 мл/мин. После прохождения всего экстракта через колонку ее промывают 100 мл 0,005 М фосфатом натрия со скоростью 1-2 мл в мин. Элюцию СЭ проводят 0,05 М фосфатным буфером, содержащим 0,05 М раствор хлористого натрия, pH 6,5, со скоростью 1-2 мл/мин.
Элюированный энтеротоксин с колонки помещают в диализный мешочек и концентрируют полиэтиленгликолем. Затем препарат лиофилизируют и после лиофилизации препарат энтеротоксина растворяют в 0,2 мл физиологического раствора.
б) Молоко и порошок молока. Для извлечения СЭ используют натриево-фосфатный буфер (0,05 М фосфат в 0,15 М NaCl, содержащий 0,05% азида натрия, pH 7,6) для набора RIDASCREEN и 0,25 М Трис-буфер (pH 8,0) для набора TECRA. Порошок молока (25,0 г) смешивают с 125 мл 0,25М Трис, pH 8,0. Образец молока испытывают в объеме 50 мл, доводят pH до 7-8; после этого добавляют 50 мл типовых добавок (из TECRA комплекта). Для более полной экстракции СЭ, pH доводят до 4,0 концентрированной HCl. Образцы центрифугируют в течение 10 минут при 16300 об/мин. Далее надосадочную жидкость фильтруют и 5,0 мл надосадочной жидкости пропускают через шприц, содержащий гигроскопическую вату в пробирку из полипропилена. Доводят pH до 7,0-8,0, после чего добавляют 50 мл добавок (в комплекте).
в) Сыры. Берут 25 г сыра, добавляют 50 мл воды и гомогенизируют в течение 3 мин на высокой скорости в смесителе. Доводят pH до 4,0 концентрированной НС1. Образец центрифугируют в течение 10 минут при 16300 об/мин. Осадок удаляют, а жидкость (элюат) пропускают через шприц с гигроскопической ватой. Берут 5 мл элюата, и доводят pH до 7,0-8,0 с помощью NaOH и затем добавляют 50 мл типовой добавки TECRA.
г) Для более полной очистки от балластных компонентов используют очистку энтеротоксина на колонках с амберлитом, или применяют метод иммуноаффинной очистки с использованием колонок с антителами к СЭ (например, колонок фирмы TRANSIA ® МАК SE), основанный на связывании непосредственно энтеротоксинов А, В, С, D и Е с последующей элюцией и определением. Использование иммуноаф-финных колонок TRANSIA В ® SET повышает чувствительность метода и снижает риск ложно-положительных реакций. При получении отрицательных результатов колонка может быть вновь использована для определения СЭ. Этим методом возможно обнаружить до 0,1 нг СЭ в грамме образца.
д) Для определения наличия СЭ у штаммов стафилококков их выращивание проводят при 37°С, в течение 48 часов на плотной питательной среде Gasman с добавлением сердечно-мозговой вытяжки. Также возможно культивирование на жидкой питательной среде Casman в модификации Флуера с ферментативным гидролизатом казеина и добавлением 1% сердечно-мозговой вытяжки. Культивирование осуществляют в течение 20-24 ч при встряхивании на шуттель-аппарате при 280 об/мин и температуре 37°С. Микробные клетки после окончания культивирования удаляют центрифугированием при 10 000 об/мин в течение 10 мин. СЭ определяют в надосадочной жидкости, предварительно пропустив ее через мембранный фильтр для стерилизации. Возможно применение и других жидких питательных сред (бульоны на казеиновом гидролизате, бульон на сердечно-мозговом настое Дифко.
е) Биологические методы. До недавнего времени для обнаружения СЭ использовались приматы, а также кошки и котята. Однако указанные животные модели малочувствительны к СЭ, поскольку позволяют определять его в количестве более чем 200 нг. Они используются в основном для открытия новых энеротоксинов, но эти методы не подходят для дифференциации различных типов СЭ. Котята и кошки относительно нечувствительны к пероральному введению энтеротоксина, но достаточно чувствительны к парентеральному. При внутривенном введении 0,1-0,5 мкг СЭ на 1 кг веса тела кошки СЭ вызывают рвоту. Следует иметь в виду, что культуральные супернатанты содержат а- и (3-гемолизины стафилококка, которые при парентеральном введении также обладают способностью вызывать рвоту.
Для того чтобы исключить ложно-положительные результаты, образцы перед введением обрабатывают прогреванием при 100°С в течение 30 мин или трипсином, панкреатином или антисывороткой против токсических компонентов неэнтеротоксигенных штаммов, а также формалином в течение нескольких дней. После денатурации фильтраты (10-15 мл) смешивают с равным количеством теплого молока и скармливают котятам в возрасте 1-2 мес. При наличии СЭ через 30-60 мин у котят возникает рвота, через 2-3 ч появляется понос. Фильтраты можно вводить внутривенно кошкам в бедренную вену в объеме 1 -2 мл. Рвота у кошек наступает через 1 ч после введения препарата. После проведения исследования кошки выздоравливают и становятся пригодными для исследования новых проб.
ж) Иммунологические методы. Основное значение при определении СЭ в пищевых продуктах отводится иммунологическим методам. Они получили широкое распространение ввиду их высокой чувствительности и специфичности. Индикация СЭ в пищевых продуктах иммунологическими методами основана на обнаружении антигенных различий между энтеротоксинами. Для этой цели могут быть применены следующие методы: реакция двойной гель диффузии в геле, электрофорез, электроиммунодиффузия и обратный иммуноосмофорез, непрямая гемагглютинация, задержка гемагглютинации, реакция латекс-агглютинации, тесты с флуоресцирующими антителами, радиоиммунологические, микрослайдовый метод, иммуноферментные методы.
з) Определение стафилококковых энтеротоксинов в реакции непрямой гемагглютинации (РНГА). Для сенсибилизации бараньих танизированных, акроилинизированных эритроцитов используются иммуноглобулины к СЭ, полученные методом аффинной хроматографии. Чувствительность метода составляет 7 нг/мл. Время получения результатов — 3-4 ч.
и) Метод иммуноферментного анализа (ИФА). Определение происходит за счет специфического взаимодействия стафилококковых иммуноглобулинов к СЭ, адсорбированных на планшете, с СЭ, содержащимся в исследуемом материале. Образовавшийся комплекс антиген-антитело выявляют при помощи конъюгатов — стафилококковых иммуноглобулинов к СЭ, меченных пероксидазой. Образовавщийся комплекс антиген-антитело с конъюгатом на поверхности ячеек планшета и проявляющийся ферментацией субстрата ортофенилендиамина изменением его окраски измеряется по регистрируемому значению оптической плотности.
В настоящее время для индикации СЭ в пищевых продуктах используют поликлональные или моноклональные антитела. Метод ИФА с использованием моноклональных антител позволяет выявлять СЭ в концентрации 0,1 нг на 1 г продукта. Чувствительность иммуноферментного метода составляет от 0,1-1,0 нг/мл.
Для определения СЭ существуют коммерческие тест-системы.
RIDASCREEN SET моновалентный кит А, В, С, D, Е с микроплатами с чувствительностью 0,2-0,7 нг/мл, время определения 2,5 часа, производства R-Biopharm, (Германия).
Набор для ИФА из Швейцарии, называемый набор Bromelli или также набор Swiss Ball, включающий моновалентную иммобилизованную систему антител против энтеротоксинов типов А-Е.
Визуальный набор для ИФА (TECRA) из Австралии, включающий поливалентную иммобилизованную систему антител против энтеротоксинов типов А-Е. Фирма TECRA также выпускает иммуноферментные тест-системы для визуального обнаружения отдельных СЭ. Комплекты TECRA дают ложно-положительные результаты при индикации СЭ в морепродуктах и с Serratia marcesccns.
Кроме того, имеется два иммуноферментных набора для определения СЭ: один с использованием трубочек, а другой с использованием планшетов фирмы Transia Tube и Transia Plate Staphylococcal Enterotoxins А, В, C, D, E ИФА с чувствительностью 0,1 нг/мл, время определения 1-2 часа, Diffchamb (Франция).
Существует Vidas Staph enterotoxin (SET) Automated Sandwich-ELFA с использованием трубочек, которая содержат моновалентную иммобилизованную систему антител против энтеротоксинов типов А-Е; с чувствительностью 1 нг/мл, время получения результатов 80 минут (BioMerieux, Франция).
В присутствии природной пероксидазы тест-системы и RIDASCREEN, и TECRA дают ложно-положительные результаты. Для удаления эндогенных пероксидаз к пробам добавляют раствор азида натрия из расчета 0,06 г на мл пробы. При этом повреждается на 20-30 % исходное количество СЭ.
Существуют и выпускаются отечественные тест-системы для определения СЭ типов А и В.
к) Радиоиммунологические методы, несмотря на высокую чувствительность (1 пикограмм/грамм продукта), не используются ввиду необходимости применения радионуклеотидов — I125.
л) Одним из признанных международных методов для определения СЭ является микрослайдовый метод. Он является полуколичественным методом, позволяющим выявлять до 30-60 нг/г.
Ход подготовки предметных стекол с агаром для этой реакции. 5 мл горячего 1,2%-ного раствора агара Dit'co, приготовленного на физиологическом растворе, наслаивают на предметное стекло и после затвердевания агара пробойником прорезают в нем лунки диаметром 0,3-0,4 см. Одну лунку делают в центре, другие должны быть расположены на расстоянии 0,4-0,5 см вокруг центральной лунки. Частичка агара из лунки отсасывается пастеровской пипеткой. Перед заполнением лунок надо зафиксировать слой агара на стекле: провести стекло агаром вверх через пламя горелки 2-3 раза.
Постановка реакции преципитации микрослайдовым методом. Центральную лунку заполняют антисывороткой, а расположенные по периферии лунки — раствором антигена. В качестве антигена используют супернатант культур стафилококка, в качестве контроля — коммерческие образцы СЭ разных серотипов, выпускаемые фирмой Serva (Германия) и Институтом вакцин и сывороток (Санкт-Петербург). Так как реагенты диффундируют в направлении друг к другу, линии преципитации образуются между центральной и периферической лункой.
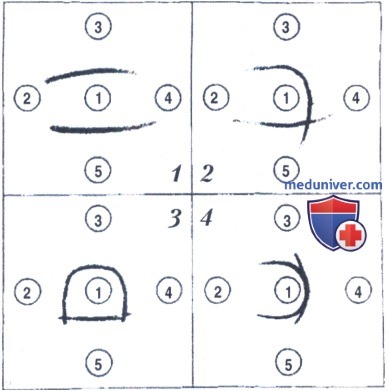
Квадрат 1. Лунка 1 содержит антитела к SEA и SEB, лунки 2 и 4 — исследуемые образцы, лунка 3 — референс SEA, лунка 5 — референс SEB; результаты опыта: образцы в лунках 2 и 4 не содержат SEA и SEB.
Квадрат 2. Лунка 1 содержит антитела к SEA и SEB, лунки 2 и 4 — исследуемые образцы, лунка 3 — референс SEA, лунка 5 — референс SEB; результаты опыта: образец, который находится в лунке 4, содержит SEA.
Квадрат 3. Лунка 1 содержит антитела к SEA и SEB, лунки 3-4 — исследуемые образцы, лунка 3 — референс SEA, лунка 5 — референс SEB; результаты опыта: образцы, которые находятся в лунках 2 и 4, содержат SEA.
Квадрат 4. Лунка 1 содержит антитела к SEA и SEB, лунки 2-4 — исследуемые образцы, лунка 3 — референс SEA, лупка 5 — референс SEB; результаты опыта: образец в лунке 4 содержит SEA и SEB
Учет реакции. Этим методом легко провести идентификацию неизвестного энтеротоксина, сравнивая его с известным стандартом. Линии преципитации, образованные СЭ одного типа, сливаются, а линии, образованные разными типами СЭ в виду их иммунологической неидентичности перекрещиваются. Это чрезвычайно важно для диагностики пищевого отравления неизвестной этиологии.
м) Метод латексной агглютинации также является международно признанным методом для определения СЭ. Он позволяет выявлять менее чем 1 нг/мл. Однако этот метод дает ложно-положительные результаты при определении СЭ в продуктах, изготовленных с использованием муки. Из коммерческих тест-систем рекомендуется RPLA с чувствительностью 0,5 нг/г (Denka-Seiken) Япония.
н) Молекулярно-генетические методы, такие, как полимеразная цепная реакция (ПЦР), позволяют выявлять наличие или отсутствие генов для продукции СЭ. Метод можно использовать для выявления СЭ в культурах стафилококков, выделенных при пищевых отравлениях. Для пищевых продуктов ПЦР оказалась недостаточно информативной.
- Читать далее "Эпидемиология пищевых отравлений вызванных стафилококковыми энтеротоксинами"
Редактор: Искандер Милевски. Дата публикации: 11.11.2019
- Стафилококковые энтеротоксины: свойства, образование
- Механизм действия стафилококковых энтеротоксинов
- Токсичность стафилококковых энтеротоксинов и их болезни
- Микробиологическая диагностика отравлений стафилококковыми энтеротоксинами
- Методы определения стафилококковых энтеротоксинов
- Эпидемиология пищевых отравлений вызванных стафилококковыми энтеротоксинами
