Патогенез дизентерии (шигеллеза)
Как известно, развитие инфекционного процесса слагается из начального этапа — преодоления возбудителем естественных барьеров организма хозяина (механического, химического и экологического) и фазы адгезии, которая у шигелл сопровождается пенетрацией в эпителий с последующим внутриклеточным размножением и межклеточным распространением. Шигеллы активно проникают в эпителиоциты кишечника, оказываясь в первичной фагосоме, окруженной однослойной мембраной. После лизиса первичной фагосомы бактерии поступают в цитоплазму эпителиоцита, вызывая полимеризацию актина с образованием актинового хвоста, обеспечивающего интенсивное «ракетообразное» передвижение бактерий по цитоплазме. Проникновение в соседнюю клетку происходит путем продавливания боковой клеточной мембраны и инвагинации в прилегающую клетку. Деление шигелл в цитоплазме сопровождается цитотоксическим действием и последующим слущиванием пораженных клеток.
Этапы проникновения и последующего внутриклеточного размножения шигелл представлены на электронограммах биопсийных эксплантатов слизистой кишечника человека, зараженного S. flexneri 2а.
Продукция цитотоксического шига-токсина детерминируется хромосомным геном, входящим в состав острова патогенности SHI-1, который дополнительно несет гены, контролирующие синтез IgA-протеазы. В процессе пенетрации шигелл в эпителиоциты принимают участие продукты плазмидных генов ipaBCD (invasion plasmid antigen) и icsAB (intra/intercellular spreading). Гены ipaBCD и icsAB входят в состав острова патогенности, обозначенного как Entry region и локализованного на плазмиде вирулентности. Последний включает гены системы секреции III типа, ответственной за одноэтапный транспорт эффекторных молекул (белков инвазинов) из бактериальной клетки шигелл в цитоплазму эпителиоцита с последующей модификацией цитоплазматических белков поражаемой эукариотической клетки. Система секреции III типа включает ряд генов, в том числе, ipgDF (invasion plasmid gene), mxiAD (membrane expression invasin) и spa (surface presentation antigen).
Важными для проявления патогенности являются регуляторные гены, контролирующие экспрессию плазмидных ipaBCD-генов инвазии: envZ (ompR) — индукция генов инвазии в ответ на высокое осмотическое давление в толстой кишке, virR — репрессия генов инвазии при переходе бактерий к температуре ниже 37°С. Гены vacCB (virulence associated chromosome) и ompT имеют значение при размножении шигелл в ткани.
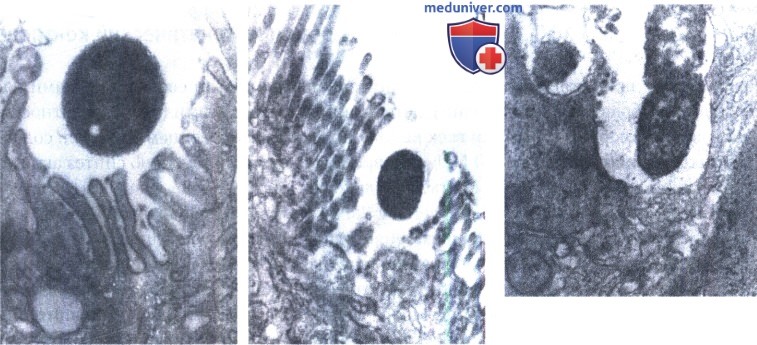
б - Разрушение микроворсинок энтероцитов с инвагинацией плазмолеммы при взаимодействии с шигеллами. Ув.х10 000.
в - Внутриклеточное расположение шигелл: плотный контакт шигелл с апикальной мембраной энтероцита; разделившиеся клетки шигелл. Ув. х10 000.
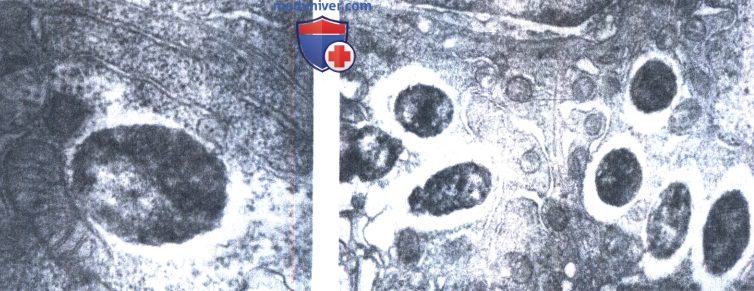
б - Проявление цитотоксического действия при внутриклеточном размножении шигелл. Ув. х10 000.
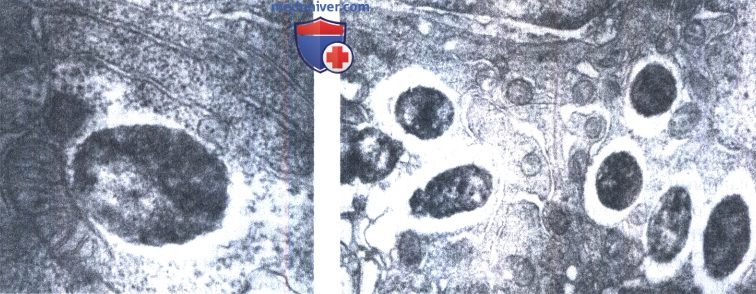
б - Проявление цитотоксического действия при внутриклеточном размножении шигелл. Ув. х10 000.
На хромосоме шигелл обнаружен еще один геномный остров патогенности, обозначенный как SHI-2, детерминирующий синтез аэробактина, необходимого для усвоения бактериями ионов железа. Этапы проникновения и последующего внутриклеточного размножения шигелл представлены на электронограммах биопсийных эксплантатов слизистой кишечника человека, зараженного S. flexneri 2а.
Продукция цитотоксического шига-токсина детерминируется хромосомным геном, входящим в состав острова патогенности SHI-1, который дополнительно несет гены, контролирующие синтез IgA-нротеазы. В процессе иенетрации шигелл в эпителиоциты принимают участие продукты плазмидных генов ipaBCD (invasion plasmid antigen) и icsAB (intra/intercellular spreading). Гены ipaBCD и icsAB входят в состав острова патогенности, обозначенного как Entry region и локализованного на плазмиде вирулентности. Последний включает гены системы секреции III типа, ответственной за одноэтапный транспорт эффекторных молекул (белков инвазинов) из бактериальной клетки шигелл в цитоплазму эпителиоцита с последующей модификацией цитоплазматических белков поражаемой эукариотической клетки. Система секреции III типа включает ряд генов, в том числе, ipgDF (invasion plasmid gene), mxiAD (membrane expression invasin) и spa (surface presentation antigen).
Важными для проявления патогенности являются регуляторные гены, контролирующие экспрессию плазмидных ipaBCD-генов инвазии: envZ (ompR) — индукция генов инвазии в ответ на высокое осмотическое давление в толстой кишке, virR — репрессия генов инвазии при переходе бактерий к температуре ниже 37°С. Гены vacCB (virulence associated chromosome) и ompT имеют значение при размножении шигелл в ткани.
На хромосоме шигелл обнаружен еще один геномный остров патогенности, обозначенный как SHI-2, детерминирующий синтез аэробактина, необходимого для усвоения бактериями ионов железа.
Для полного выражения вирулентности важен синтез полноценной структуры ЛПС О-антигена шигелл. У S. flexneri компоненты ЛПС их О-антигена контролируются кластерами хромосомных генов — rfa, rfb, rfc, rol и генами профагов, интегрированных в районе lac-pro оперонов на хромосоме S. flexneri. Описаны также гены cld (chain lenght regulator, англ.), локализованные в геноме плазмиды pHS-2, которые контролируют полимеризацию S-специфических боковых цепей ЛПС О-антигена. У штаммов S. sonnei синтез антигена фазы I контролируется генами, локализованными на плазмиде инвазивности 120 МД.
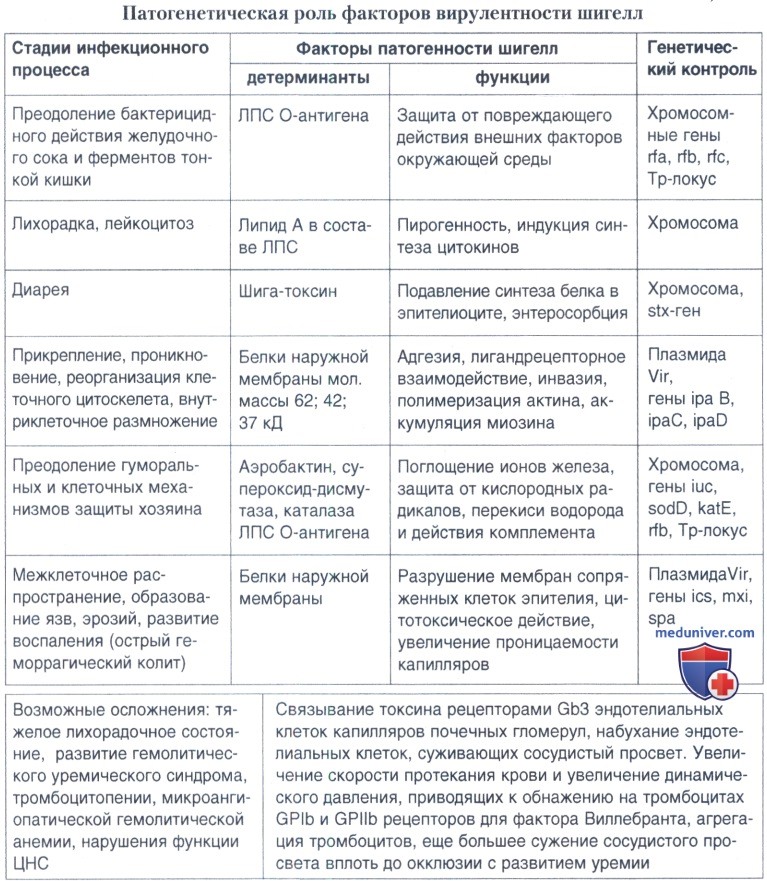
Роль различных факторов вирулентности шигелл в патогенезе бактериальной дизентерии приведена в таблице ниже.
Следует отметить, что у шигелл наблюдается своеобразное разделение функций, связанных с патогенностью, между их хромосомой и плазмидами. Гены, расположенные на плазмиде инвазивности, обеспечивают взаимодействие возбудителя с эпителием, а хромосомные — существование и размножение бактерий вне эпителия, в просвете кишки и тканях.
Касаясь патогенеза развития заболевания, следует отметить, что некоторыми исследователями при морфологических исследованиях еюнобиоптатов обнаружено частичное размножение шигелл в эпителии тонкой кишки. О возможном разрушении шигелл полиморфноядерными лейкоцитами и поступлении ЛПС (эндотоксина) шигелл из тонкой кишки в системный кровоток свидетельствует лихорадочное состояние больных шигеллезом, наблюдаемое с первых дней болезни. Температурная реакция является следствием пирогенного действия эндотоксина. Повышение температуры тела обусловлено индукцией синтеза эндогенных пирогенов астроцитарными клетками головного мозга при действии на них пирогена полиморфноядерных лейкоцитов, высвобождаемого в кровоток.
Лейкоцитарная реакция связана в основном с воздействием поступающего в кровоток эндотоксина шигелл, способствующего развитию лихорадки и воспаления. Процесс взаимодействия шигелл с эпителиоцитами имеет некоторое сходство с таковым у энтеропатогенных кишечных палочек. Его особенность при шигеллезной инфекции заключается в том, что после адгезии бактерии вследствие аккумуляции цитоскелетных элементов под адгезированной бактериальной клеткой на плазмолемме эпителиоцита в месте прикрепления под мембраной образуется «пьедестал» — приподнятая структура. «Пьедестал» возникает в результате полимеризации актина и аккумуляции миозина, своеобразно приподнимающих мембрану эпителиоцита в месте прикрепления микробной клетки. Процесс «вхождения» шигелл в эпителиоцит связан с функцией генов ipaBCD. Белок IpaB вызывает полярную полимеризацию актина, обеспечивающую кометообразное, внутриклеточное и межклеточное передвижение бактерий.
Интенсивное кометообразное движение шигелл при столкновении с мембраной соседнего энтероцита обеспечивает ее инвагинацию с поступлением в пограничную клетку. Возможен также лизис мембраны с переходом шигелл из одной клетки в другую.
Шигеллы, высвобождающиеся из слущенных или разрушенных на месте энтероцитов, поглощаются и разрушаются нейтрофилами быстро развивающегося воспалительного инфильтрата. Мелкоочаговые поражения в тонкой кишке, вызываемые инвазией шигелл, трудно уловимы и быстро проходят. Причины этого в том, что микробы в просвете кишки подвергаются действию трипсина и хемотрипсина, а внутриэпителиальное распространение возбудителя быстро обрывается в тонкой кишке, вероятно, из-за более массивного, чем в толстой кишке, «киллерного» действия инте-рэпителиальных больших гранулярных лимфоцитов. Определенное значение имеет и более быстрое, чем в толстой кишке, обновление эпителия тонкой кишки. При размножении шигелл внури эпителиоцитов синтезируемый ими энтеротоксин вызывает, по-видимому, не только местную гиперсекрецию жидкости и диарею, но и резорбтивные диффузные цитопатические изменения поражаемых токсином тканей.
В толстой кишке инфекционный процесс возникает несколько позже, но выражен в значительно большей степени из-за прекращения подавления инвазии панкреатическими ферментами, прогрессирующего межэпителиального поражения шигеллами колоноцитов и увеличения дефектов эпителиального покрова, снижения защитной функции макрофагов и апоптоза. При шигеллезном колите резорбтивное действие цитоэнтеротоксина и эндотоксина шигелл значительно сильнее в связи с более интенсивным и длительным внутриэпителиальным размножением и межклеточным распространением возбудителя. Шига-токсин угнетает синтез белковых макромолекул не только в колоноцитах, но и в других клетках. В некоторых случаях при шигеллезах наблюдается развитие гемолитико-уремического синдрома (ГУС), сходного с таковым при инфекции, вызванной энтерогеморрагической кишечной палочкой (ЭГКП): повышение температуры, преходящие нарушения ЦНС, явления микроангиопатической гемолитической анемии, тромбоцитопения с развивающейся почечной недостаточностью.
Важную роль в развитии гемолитико-уремического синдрома играют шига-токсин и шигаподобные энтеротоксины. Пока не совсем ясно, как шига- и шигаподобные токсины попадают в цитозоль поражаемой клетки. Возможно, туда проникает лишь А1-фрагмент токсина. Полагают, что в этом процессе участвуют ионы Са2+. -фрагмент обладает N-гликозидазной активностью и специфически отщепляет остаток аденина-4324 от 28S-PHK, входящей в состав 60S субъединицы рибосомы. Это препятствует удлинению полипептидной цепи и тем самым приводит к нарушению синтеза белка поражаемой клетки. Шигаподобные токсины (Stx 1 и 2) неодинаковы по степени своего цитотоксического воздействия на клетки. Stx 2 оказывает в 1000 раз более сильное действие на клетки эндотелия микрососудов почек человека, хотя эти клетки связывают в 10 раз больше Stx 1, чем Stx 2. Stx 1 способен вызывать гибель клеток не только путем ингибирования синтеза белка, но и при помощи другого механизма индукции апоптоза.
Полагают, что из просвета кишечника шига-токсины проникают в системный кровоток. Каким образом они проходят сквозь слизистую кишечника и стенку сосудов и как затем преодолевают печеночный барьер, остается неясным. Возможно, проникновению токсинов в кровь способствуют повреждение кишечной стенки в результате инфекции или ишемии. Интересен в этой связи тот факт, что свободный шига-токсин никогда не удавалось обнаружить в крови больных гемолитико-уремическим синдромом, что объясняют интенсивным связыванием его с клетками-мишенями. Так или иначе, ведущую роль в патогенезе гемолитико-уремического синдрома играет повреждение токсинами эндотелия микрососудов, в особенности капилляров клубочков и почечных артериол.
В повреждении эндотелия при гемолитико-уремическом синдроме принимают участие провоспалительные цитокины. Участие цитокинов в патогенезе синдрома подтверждают следующие наблюдения. Действительно, у больных имеет место повышение в плазме крови IL-6, TNF-α, IL-1β, IL-8. Уровень IL-6 коррелирует с наличием внепочечных проявлений гемолитико-уремического синдрома (неврологические нарушения, панкреонекроз). IL-6, TNF-a, IL-8 обнаруживались и в моче, причем в более высокой концентрации, чем в крови, что свидетельствует об их локальном образовании в почках.
Эндотелий человека не способен продуцировать цитокины под действием шигатоксина. Значит, в патогенезе синдрома участвуют дополнительные клетки, вероятно, клетки моноцитарно-макрофагальной системы. Исходя из вышесказанного, механизм повреждения эндотелия при гемолитико-уремическом синдроме можно в общих чертах представить следующим образом. ЛПС способствуют появлению Gb3 на моноцитах и клетках эндотелия, что усиливает действие токсинов на эти клетки. Моноциты под действием ЛПС и токсинов начинают выделять цитокины (по-видимому, это происходит в ночках), действие которых на эндотелий также способствует увеличению Gb3, что делает их еще более чувствительными к токсинам. Токсины вызывают гибель эндотелия путем ингибирования синтеза белка. Действие цитокинов при ГУС не ограничивается только стимуляцией образования Gb3. Под действием цитокинов повышаются адгезивные свойства эндотелия, увеличивается число рецепторов лейкоцитов на их поверхности. Stx 1 также значительно усиливает адгезию лейкоцитов к клеткам эндотелия.
Активированные цитокинами нейтрофилы выделяют токсические метаболиты кислорода и лизосомальные ферменты, такие, как эластаза. Выделяемые нейтрофилами супероксид-анионы O2 при реакции с оксидом азота (NO) эндотелиального происхождения образуют высокотоксичные гидроксильные радикалы. Необходимо отметить, что TNF-a, концентрация которого повышена при гемолитико-уремическом синдроме, — сильный стимулятор NO-синтетазы, а гидроксильные радикалы и перекись водорода — основные виновники повреждения эндотелия. Избыточное образование свободных радикалов ведет к насыщению защитных антиоксидантных систем и перекисному окислению мембранных липидов, что приводит к повреждению эндотелия и эритроцитов.
ЛПС (эндотоксин) шигелл относится к бактериальным модулинам, обладающим широчайшим спектром биологической активности. Биологическая активность ЛПС привлекает внимание исследователей своими многочисленными проявлениями; в зависимости от дозы ЛПС возможны следующие эффекты:
- активация лейкоцитов, макрофагов, клеток эндотелия и гладких мышц;
- стимуляция продукции эндогенного пирогена, интерферона, интер-лейкинов, фактора некроза опухоли и других медиаторов воспаления;
- активация синтеза белков острой фазы, в том числе амилоидного белка;
- активация миелопоэза, поликлональная активация В-клеток; индукция развития провирусов;
- подавление тканевого дыхания;
- развитие гиперлипидемии;
- активация системы комплемента;
- активация тромбоцитов и факторов свертывания крови;
- местный и генерализованный феномены Швартцмана;
- диссеминированное внутрисосудистое свертывание крови;
- эндотоксиновый шок и развитие острой полиорганной недостаточности.
Следует отметить, что реализация токсического потенциала эндотоксина шигелл, как и других представителей семейства Enterobacteriaceae, осуществляется при помощи последовательного взаимодействия с различными рецепторами организма хозяина. Первым звеном этой цепи является специфический липополисахаридсвязывающий белок (LPB) сыворотки крови. Далее активный комплекс ЛПС-LPB реагирует с рецептором CD-14, который обеспечивает эффективное представление ЛПС toll-like рецепторам, в частности TLR-4, на поверхности фагоцитов. «Узнавание» молекулы ЛПС toll-like рецептором запускает активацию ядерного фактора транскрипции (NFkappaB), индуцирующих синтез провоспалительных цитокинов, действие которых направлено на повышение защитных сил организма, определяющих элиминацию возбудителя. Однако при достижении пороговой концентрации эндотоксин способен вызывать губительную для макроорганизма секрецию провоспалительных цитокинов.
Недавно установлено, что иммуносупрессивная активность шигелл тесным образом связана с наличием собственной плазмиды вирулентности и синтезом определенной фракции ЛПС О-антигена. При инфекционном процессе, вызванном S. flexneri, выявлено усиление апоптоза — программированной гибели активируемой иммунокомпетентной клетки. Представляет интерес и патогенез хронизации шигеллезного процесса, сопровождающийся аллергическими состояниями, вовлечением в процесс синовиальных полостей и развитием артритов. Установлена связь между развитием реактивных постшигеллезных артритов и наличием у штаммов S. flexneri 2а плазмиды размером 2 МД, детерминирующей синтез пептидов, вызывающих реактивный артрит.
а) Клинические формы проявления болезни. Заболевание, как правило, начинается остро. Инкубационный период обычно 2-3 дня. При шигеллезе Флекснера наблюдаются симптомы поражения не только толстой кишки (колит), но иногда и тонкой (энтероколит).
Повышается температура, появляются боли в животе, частый жидкий стул, который затем приобретает бескаловый характер со слизью, становится скудным. Наиболее тяжело протекает заболевание, вызванное S. dysenteriae 1. Связано это со способностью возбудителя продуцировать цитоэнтеротоксин, обладающий цитотоксической, энтеротоксической и нейротоксической активностью. При этом у больных наблюдаются выраженные проявления интоксикации, возможны осложнения в виде гемолитико-уремического синдрома. При дизентерии, вызванной S. sonnei, заболевание часто протекает в легкой форме, нередко по типу пищевой токсикоинфекции.
Преобладает гастроэнтеритический синдром: тошнота, повторная рвота, боли в животе. Легко протекает и заболевание, вызванное S. boydii. Последнее встречается не часто.
б) Иммунитет к дизентерии. Продолжительность постинфекционной невосприимчивости при шигеллезе колеблется от 2 до 12 мес. и зависит от вида, биологических особенностей возбудителя и исходного природного иммунитета. Существуют местный и общий иммунитет. Местный иммунитет формируется лимфоидным аппаратом и слизистой кишечника, более наряжен и длителен, хотя и менее специфичен, чем общий. По мнению большинства исследователей, ведущая роль в постинфекционном иммунитете принадлежит защитным факторам слизистой оболочки, лимфоциты, колоноциты и в меньшей степени энтероциты и дендритные клетки которой являются местом формирования основного иммунологического барьера.
- Читать далее "Эпидемиология дизентерии (шигеллеза)"
Редактор: Искандер Милевски. Дата публикации: 30.12.2019
