Сборка и выход тогавирусов из клетки. Метаболизм пораженной тогавирусами клетки и флавивирусы
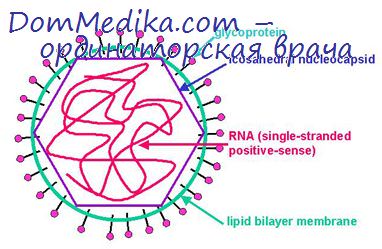
В электронно-микроскопических исследованиях четко показано, что альфавирусы приобретают внешнюю липопротеидную оболочку в процессе почкования от цитоплазматических мембран. Первый этап сборки — это ассоциация вРНК с белком, в результате которой образуется нуклеокапсид (Фридман, 1968). Затем нуклеокапсиды мигрируют к плазматической мембране и почкуются практически с постоянной скоростью (200— 1000 БОЕ в 1 ч) через те участки мембраны, в состав которых включены вирусные пепломеры (Ачесон и Тамм, 1967).
Путем почкования в цитоплазматические вакуоли образуется сравнительно немного вирионов; избыточные нуклеокапсиды агрегируют вокруг таких пузырьков или образуют паракристаллические скопления (Морган и др., 1961), причем это происходит только на очень поздних стадиях цикла, когда выход вирионов в среду почти полностью завершается (Ачесон и Тамм, 1967). Обширная пролиферация цитоплазматических вакуолей, которую также можно видеть на тонких срезах, связана скорее с определенной функцией мембран в процессе вирусной репликации и синтеза белка, чем с процессом почкования, поскольку она столь же заметна в клетках, зараженных полиовирусом.
Уэйт и Пфефферкорн (1970) обнаружили, что почкование полностью останавливается при понижении ионной силы окружающей среды. При обращении этого процесса накапливающийся внутри клетки вирус быстро освобождается по типу синхронного «взрыва».
Метаболизм пораженной тогавирусами клетки и флавивирусы
Тогавирусы вызывают лишь незначительные повреждения в культурах клеток беспозвоночных (см. Вайс, 1971) и умеренный цитопатический эффект в культурах клеток позвоночных. Не удивительно поэтому, что в последнем (но не первом) случае они приводят к некоторому угнетению клеточных макромолекулярных синтезов.
В клетках позвоночных, зараженных вирусами Синдбис или леса Семлики, угнетение синтеза белка клетки-хозяина выявляется через 3 ч и постепенно усиливается до тех пор, пока в конце цикла более 90% синтезирующихся белков и гликопротеидов не будут вирус-специфическими (Фридман, 1968; Штраус и др., 1969; Бёрдж и Штраус, 1970). Синтез клеточной РНК не снижается сколько-нибудь существенно до самых поздних стадий цикла (Тейлор, 1965).
Флавивирусы размножаются гораздо медленнее, чем альфавирусы (Столлар и др., 1967), и в отличие от последних имеют тенденцию почковаться в цитоплазматические вакуоли, а не через плазматическую мембрану, но по остальным свойствам они в основном сходны. Например, синтез РНК вируса денге типа 2, наиболее изученного представителя рода, может быть обнаружен через 6 ч после заражения; образующиеся РНК трех главных видов седиментируют приблизительно с той же скоростью, что и аналогичные компоненты альфавирусов (Столлар и др.. 1967).
На электронных микрофотографиях обнаружено резкое возрастание числа цитоплазматических вакуолей, в которые главным образом и почкуются нуклеокапсиды.
На поздних стадиях инфекции в клетках Vero внутри вакуолей накапливаются кристаллические агрегаты вирионов, однако это не характерно для клеток ВНК21 или клеток KB, несмотря на то что в последних получают высокий урожай вирусов. Во всех этих трех клеточных линиях латентный период составляет 12 ч. С увеличением концентрации Mg2+ в среде выход вируса из клетки повышается.
При изучении синтеза РНК вируса энцефалита Сан-Луи Трент и др. (1969) обнаружили молекулы трех главных видов: вРНК (43S), РФ (20S) и устойчивую к РНКазе фракцию 26S, возможно РП. Уэстэувэй и Ридмен (1969) представили экспериментальные данные, свидетельствующие о том, что белки вируса Куньин образуются в результате посттрансляционного расщепления.
- Читать далее "Размножение вируса краснухи в клеточных культурах. Цикл размножения ортомиксовирусов"
Оглавление темы "Характеристика тогавирусов и ортомиксовирусов":1. Метаболизм клеток пораженных пикорнавирусами. Синтез белков пораженными пикорнавирусами клетками
2. Подавление синтеза клеточных РНК пикорнавирусами. Подавление синтеза ДНК пикорнавирусами
3. Дефектные частицы пикорнавирусов. Цикл размножения вируса ящура и тогавирусов
4. Трансляция тогавирусов. Этапы трансляции тогавирусов
5. Репликация РНК тогавирусов. Транскрипция РНК тогавирусов
6. Сборка и выход тогавирусов из клетки. Метаболизм пораженной тогавирусами клетки и флавивирусы
7. Размножение вируса краснухи в клеточных культурах. Цикл размножения ортомиксовирусов
8. Начало ортомиксовирусной инфекции. Транскрипция ортомиксовирусов
9. Трансляция ортомиксовирусов. Репликация РНК ортомиксовирусов
10. Сборка ортомиксовирусов. Выход ортомиксовирусов из клетки
