Взаимосвязь микробиоты кишечника и эндокринной системы
Пищеварительный тракт является границей раздела сред между внешней средой и организмом. Микробиота — это обширное сообщество (несколько триллионов) микробов, включающее комбинированный геном, который имеет в 100 раз больше генов, чем геном человека.
Микробиота постоянно взаимодействует с организмом хозяина. Взаимодействие происходит на протяжении всей жизни человека, оказывая большое влияние как на здоровье, так и развитие болезни, и считается важным компонентом взаимоотношений кишечник—мозг. Микробиота кишечника является частью сложной системы двунаправленной биохимической передачи сигналов, происходящей между центральной нервной системой и желудочно-кишечным трактом через неврологические (парасимпатические и симпатические участки вегетативной нервной системы, модуляцию нейротрансмиттеров в виде у-аминомасляной кислоты, серотонина, ацетилхолина, мелатонина, гистамина), гормональные и иммунные пути.
В этом контексте ряд пептидов синтезируется клетками кишечника (т.е. кишечными нейронами, интерстициальными клетками Кахаля, энтерохромафиновыми клетками, иммунными клетками), в то время как некоторые метаболиты продуцируются непосредственно кишечной микробиотой. В частности, короткоцепочечные жирные кислоты, вторичные желчные кислоты (например, дезоксихолевая кислота, литохолевая кислота) и третичная желчная кислота (урсодезоксихолевая кислота), а также метаболиты триптофана, признаны в качестве основных сигнальных молекул как местного, так и системного уровня.
Система взаимодействия кишечник—мозг способствует поддержанию гомеостаза желудочно-кишечного тракта (включая кишечную проницаемость и целостность плотных контактов, перистальтику кишечника, кишечные рефлексы и иммунологические пути), а также способна управлять адаптивными ответами на стрессовые факторы за счет активации гипоталамо-гипофизарно-надпочечниковой системы и механизмов, в основном включающих провоспалительные цитокины и гипоталамическую секрецию кортикотропин-рилизинг-гормона.
Эти сложные пути обеспечивают реципрокную связь между кишечником и мозгом, что играет роль в развитии заболеваний желудочно-кишечного тракта (например, синдрома раздраженного кишечника и функциональных желудочно-кишечных расстройств). Кроме того, механизмы способствуют регулированию приема пищи и энергетического гомеостаза, метаболических нарушений и изменения психического здоровья и функции мозга (то есть расстройств настроения, поведенческой реакции на стресс, беспокойства и депрессии, обучения в зависимости от опыта).
Предварительные данные также предполагают возможную роль измененных путей коммуникации между мозгом, кишечником, нейроэндокринной системой и микробиомом при хронических неврологических и психических расстройствах, таких как болезнь Паркинсона, рассеянный склероз, расстройства аутистического спектра и шизофрения.
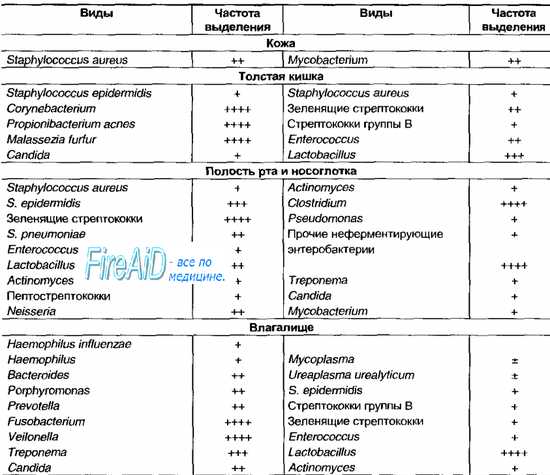

В настоящее время изучается, в том числе и на животных моделях, важная роль микробиоты и возможное ее значение для выбора правильной терапевтической тактики с использованием таких методов, как исследование временного изменения состава микробиоты после лечения антибиотиками или изменения диеты, колонизация кишечника человеческой или специально выведенной микробиотой, трансплантация фекальной микробиоты кишечника, система кишечника in vitro, стерильных животных моделей и введение пробиотиков. Этот последний подход, в частности, кажется особенно многообещающим, хотя необходимы дополнительные доказательства, в основном из-за нехватки адекватных и контролируемых исследований на людях (Arneth, 2018; Bliss и Whiteside, 2018; Martin и соавт., 2018).
Изменения микробиоты кишечника возникают при эндокринных заболеваниях, таких как тиреоидит Хашимото или синдром поликистозных яичников.
У пациентов с тиреоидитом Хашимото увеличивается численность родов Biautia, Roseburia, Ruminococcus torques, Romboutsia, Dorea, Fusicatenibacter и Eubacterium hallii. Кроме того, по сравнению со здоровыми лицами из группы контроля наблюдается снижение численности родов Fecalibacterium, Bacteroides, Prevotella 9 и Lachnoclostridium. У этих пациентов характеристики микробиоты кишечника также коррелировали с клиническими параметрами (Zhao и соавт., 2018).
При кросс-секционном исследовании женщин с синдромом поликистозных яичников были описаны специфические изменения микробиоты кишечника с повышенной численностью родов Catenibacterium и Kandleria (Insenser и соавт., 2018).
Как структурные, так и функциональные изменения здоровой микробиоты кишечника участвуют в патогенезе ожирения, диабета и НАЖБП через механизмы, в основном включающие продукцию кишечных метаболитов (т.е. короткоцепочечных жирных кислот), систему кишечник—мозг, энергетический гомеостаз, поведение хозяина, чувство сытости и изменение метаболизма желчных кислот в толстой кишке. В частности, короткоцепочечные жирные кислоты представляют собой метаболиты, продуцируемые кишечной микробиотой в дистальном отделе толстой кишки в результате ферментации и гидролиза полисахаридов.
Эти молекулы (в основном бутират, пропионат и ацетат) представляют собой главный источник энергии для клеток толстой кишки (бутират), достигают печени (где пропионат используется для глюконеогенеза) посредством энтерогепатической циркуляции и действуют на периферические ткани (ацетат).
Количество Firmicutes и Bacteroidetes имеет значение для синтеза бутирата и пропионата соответственно, и несбалансированный состав микробиоты может привести к возникновению выраженных клинических проявлений из-за несбалансированного уровня короткоцепочечных жирных кислот. В некоторых исследованиях описано повышение содержания короткоцепочечных жирных кислот (в частности, пропионата) в кале при ожирении. Тип Firmicutes имеет более широкое распространение по сравнению с типом Bacteroidetes. Короткоцепочечные жирные кислоты также являются хорошо известными сигнальными молекулами, увеличивающими синтез гормонов кишечника и модулирующими иммунные, метаболические и нейроэндокринные пути (Bliss и Whiteside, 2018; Di Ciaula и соавт., 2017а).
Эти механизмы также показывают способность взаимодействия микробиоты кишечника с окружающей средой и влияния на метаболизм хозяина, что потенциально может способствовать развитию метаболических заболеваний. Сценарий может включать эпигенетические механизмы, модулирующие экспрессию генов. С этой точки зрения воздействие токсичных химических веществ, попадающих с пищей (например, пестицидов), может вызывать негативные метаболические эффекты, включая ожирение, путями, в которых также участвует микробиота кишечника. Например, воздействие широко распространенных хлорорганических пестицидов, как было показано на животных моделях, может изменять микробиоту кишечника, вызывая дисбактериоз и пролиферацию определенных подгрупп, таких как метанобактерии, которые, в свою очередь, связаны с увеличением массы тела (Di Ciaula и Portincasa, 2017).

Вызванное микробами нарушение щелевых контактов между клетками кишечника, а также бактериальный рост в тонком кишечнике могут вызывать повышение кишечной проницаемости. Бактериальные продукты кишечного происхождения, такие как липополисахарид, пептидогликан, бактериальная ДНК и эндогенный этанол, могут попадать в портальный тракт. Это приводит к активации Toll-подобных рецепторов 4 и 9 в клетках Купфера и запускает иммунные реакции и воспалительные процессы в печени, где в итоге синтезируются несколько цитокинов и хемокинов, инициирующих развитие НАЖБП/НАСГ , наличие которого может рассматриваться как маркер выраженных метаболических нарушений (Wong и соавт., 2016).
У животных с ожирением (ob/ob) наблюдается 50% снижение численности представителей Bacteroidetes и пропорциональное увеличение типа Firmicutes по сравнению с мышами с нормальной массой тела. Таким образом, ожирение, по-видимому, влияет на разнообразие микробиоты кишечника (Ley и соавт., 2005). Различный состав микробиоты кишечника был зарегистрирован как у пациентов с диабетом 2-го типа, так и у контрольной группы, со значительно более высоким уровнем лактобацилл у пациентов с диабетом и бифидобактерий у здоровых людей. В группе лиц с ишемической болезнью сердца различный состав микробиоты кишечника встречается в зависимости от сопутствующего сахарного диабета 2-го типа или без него с более низким содержанием представителей типа Bacteroidetes и более высоким содержанием представителей типов Firmicutes и Proteobacteria у пациентов с диабетом.
Этот паттерн был связан с нарушением регуляции иммунной системы, что частично опосредовано составом и функциональным состоянием кишечной микробиоты (Sanchez-Alcoholado и соавт., 2017). Подобная микробная организация встречается у лиц с ожирением; в частности, при низкокалорийной диете с ограничением жиров или углеводов относительное количество Bacteroidetes увеличивалось, а количество Firmicutes уменьшалось, независимо от типа диеты и в соответствии со степенью снижения веса (Ley и соавт., 2006). Противодиабетический препарат метформин может влиять на микробиоту кишечника человека, в основном за счет воздействия на синтез короткоцепочечных жирных кислот. Следует отметить, что пересадка образцов кала от доноров, получавших метформин, стерильным мышам улучшила толерантность к глюкозе (Wu и соавт., 2017). Микробиота кишечника способна эффективно перерабатывать поступающие с пищей полисахариды.
Примечательно, что когда взрослых стерильных мышей C57BL6 подвергали традиционной обработке с использованием нормальной микробиоты, собранной из слепой кишки традиционно выращиваемых животных, содержание жира в организме и инсулинорезистентность увеличивались на 60% в течение 14 дней, несмотря на снижение потребления пищи. Микробиота, вероятно, способствует всасыванию моносахаридов из просвета кишечника и индуцирует липогенез печени de novo (Backhed и соавт., 2004).
Изменения времени прохождения через желудочно-кишечный тракт могут повлиять на состав микробиоты. Существует корреляция между бактериальной массой и средним временем прохождения (т.е. увеличение бактериальной массы после уменьшения времени прохождения и наоборот). Недавнее исследование показало, что увеличение времени прохождения через желудочно-кишечный тракт вызывает уменьшение биомассы и разнообразия бактериальных сообществ, что также влияет на метаболизм кишечной микробиоты (Tottey и соавт., 2017). Кроме того, микробиота кишечника может играть решающую роль в риске развития диабета 1-го типа у младенцев.
У пациентов с СД 1-го типа также может иметь место возможная связь между измененной кишечной микробиотой, нарушением высвобождения нейротрансмиттеров и гормонов и нарушением кишечного барьера. Недавние исследования показали, что измененный состав микробиоты (опосредованный конкретным генотипом хозяина) может способствовать развитию метаболического синдрома.
- Читать "Взаимосвязь желчных кислот и эндокринной системы"
Редактор: Искандер Милевски. Дата публикации: 18.1.2023
- Влияние сахарного диабета на пищевод
- Влияние сахарного диабета на желудок
- Влияние сахарного диабета на кишечник
- Влияние сахарного диабета на печень и желчный пузырь
- Влияние надпочечниковой недостаточности на желудочно-кишечный тракт
- Влияние акромегалии на желудочно-кишечный тракт
- Влияние болезней щитовидной железы на желудочно-кишечный тракт
- Влияние опухолей эндокринной системы на желудочно-кишечный тракт
- Взаимосвязь микробиоты кишечника и эндокринной системы
- Взаимосвязь желчных кислот и эндокринной системы
