Молекулярное строение ионных каналов кардиомиоцитов сердца
При проведении электрофизиологических исследований были детально изучены функциональные свойства токов Na+, Са2+ и К+ в КМЦ, а с помощью молекулярного клонирования было выявлено большое число формирующих поры субъединиц (а) и добавочных субъединиц (β, δ и γ), образующих ионные каналы на поверхности клеток.
В этих исследованиях было обнаружено, что отдельные молекулярные образования обусловливают различия ионных каналов и особенности миокардиального ПД. Также было показано, что мутации генов, кодирующих субъединицы и обеспечивающие функционирование ионных каналов КМЦ, ответственны за ряд наследственных нарушений ритма сердца.
Функциональные особенности ионных каналов миокарда изменяются и при некоторых заболеваниях, что также может стать причиной аритмий.
а) Потенциалзависимые натриевые каналы. Субъединицы, образующие поры потенциал-зависимых Na+(Nav)-каналов, имеют 4 гомологичных домена (с I по IV), каждый из которых содержит 6 промежуточных трансмембранных участков. Эти 4 домена соединяются, чтобы сформировать пору для прохождения Na+.
Среди множества Nav а-субъединиц, Nav1.5 (кодируемая геном SCN5A) является важнейшей Nav а-субъединицей, экспрессируемой в миокарде млекопитающих. Мутации в последовательности, связывающей домены III и IV в SCN5A. ассоциированы с возникновением синдрома LQT3, поскольку прерывание периода инактивации Nav-канала увеличивает входящий ток Na+ от фазы плато ПД до его пролонгации.
Случаи синдрома внезапной младенческой смерти (СВМС) среди афроамериканцев были связаны с полиморфизмом гена SCN5A, кодирующего различные Na+-каналы с измененной инактивацией в условиях сниженного внутриклеточного pH. Мутации гена SCN5A также связаны с синдромом Brugada. При синдроме Brugada происходит снижение амплитуды Nav-тока и нарушается первая фаза реполяризации.
а-Субъединицы Nav1.5, образующие поры, связываются с 1-2 добавочными Nav β-субъединицами и формируют функциональные Nav-каналы на клеточной поверхности КМЦ. Полагают, что Nav β-субъединицы играют важную роль в прикреплении белков ионных каналов на наружной клеточной мембране.

б) Потенциалзависимые кальциевые каналы. Подобно Nav-каналам, кардиальные потенциал-зависимые Са2+(Сау)-каналы состоят из 4 а-субъединиц, формирующих норы, и добавочных Cav β- и/или α-2-Д-субъединиц. Среди различных а-субъединиц выделяют субъединицы Cav1.2, кодируемые геном CACNA1C. Эти субъединицы экспрессируются миокардом млекопитающих.
Каналы Cav1.2 имеют различные временные и потенциал-зависимые особенности, а также фармакологическую чувствительность кардиальных Са2+-каналов L-типа. Дополнительные субъединицы модулируют функциональные возможности Cav-каналов.
а-Субъединицы Cav3.1/a1G образуют селективные Са2+-каналы, которые имеют те же зависимые от времени и потенциала характеристики и фармакологическую чувствительность, что и Са2+-каналы Т-типа, активируемые низким потенциалом. Повреждение гена CACNA1G, кодирующего a-субъединицу Cav3.1/alG, у мышей ассоциировалось со снижением скорости проведения импульса в СУ и АВ-проведении, что указывает на его связь с функционированием СУ и АВ-узлов.
в) Потенциалзависимые калиевые каналы. Потенциал-зависимые К+(Ку)-каналы состоят из 4 отдельных формирующих норы а-субъединиц, каждая из которых содержит 6 участков (S1-S6), состоящих из гидрофобных аминокислот, формирующих мембраносвязывающие домены. а-Субъединицы Kv, экспрессируемые в сердце человека, относятся к следующим подсемействам: Kv1, Kv4, hERG и KVLQT.
Кроме того, белки а-субъединицы Kv-канала взаимодействуют с дополнительными субъединицами Kv-канала, включая minK, KiChIP2 и MiRP1 для того, чтобы сформировать функциональные каналы клеточной поверхности с определенными зависимыми от времени и потенциала свойствами. Взаимосвязь а-субъединицы Kv4.3 с дополнительной субъединицей KChIP2 дает подъем кардиального кратковременного выходящего Kv-тока (Ito).
а-Субъединицы ERG1 совместно с дополнительными субъединицами MiRPl принимают участие в образовании функциональных кардиальных каналов IKR. Было показано, что мутации гена KCNH2, кодирующего ERG1, лежат в основе врожденного синдрома LQT2. Эти мутации приводят к снижению функциональной экспрессии канала IKR, а также альтерации процессинга или трафика канала.
а-Субъединицы KvLQT1 ассоциируются с дополнительными субъединицами minK и образуют функциональные каналы, которые подобны медленно активируемым и неактивируемым токам К+ (IKS) в миокарде человека. Мутации гена KCNE1, кодирующего minK, ассоциированы с СУ QT5. Мутации гена KCNQ1, кодирующего а-субъединицы KvLQTl, сцеплены с СУ QT1. Эти мутации имеют характер функциональных и приводят к снижению экспрессии функциональных каналов IKS на внешней мембране.
а-Субъединицы Kv1.5 взаимодействуют с селективными К+-каналами, обладающими время- и потенциалзависимыми характеристиками, что соответствует быстрой активации и медленной инактивации IKUR в предсердных КМЦ человека. Плотность IKUR значительно уменьшается в предсердиях пациентов, страдающих хронической фибрилляцией предсердий.
Са2+-чувствигельные К+-каналы с низкой проводимостью представляют собой четырехмерные соединения с а-субъединицами SK. Они обеспечивают Са2+-активируемые токи K+ (IК.Са) в КМЦ человека.
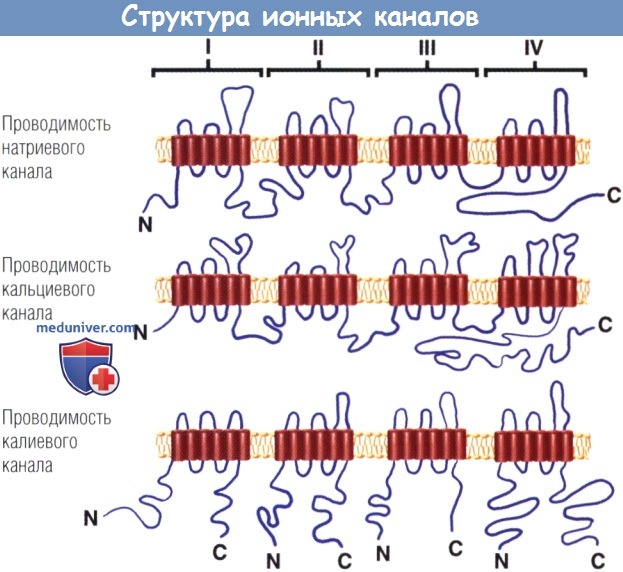
Потенциал-зависимые Na+- и Са2+-каналы образованы из одного тетрамера,
состоящего из четырех ковалентно связанных повторов шестикратно пересекающих мембрану последовательностей,
в то время как потенциал-зависимые К+-каналы состоят из отдельных субъединиц,
каждая из которых содержит только одну шестикратно пересекающую мембрану последовательность.
K+-каналы, выпрямляющие входящий ток, образованы из формирующих поры α-субъединиц.
В отличие от а-субъединиц потенциал-зависимых К+-каналов,
α-субъединицы Kir-каналов состоят всего из двух трансмембранных областей.
г) Калиевые каналы, выпрямляющий входящий ток. K+(Kir)-каналы КМЦ, как и других клеток, обеспечивают входящий ток ионов от отрицательно заряженной мембраны в направлении ЕK и слабый выходящий ток — от положительно заряженной мембраны в направлении ЕK. Активность Kir-каналов представляет собой функцию обоих МП и внутриклеточной концентрации [K+ ([K+]o).
По мере изменения [[K+]o канал проводит входящий ток от потенциал-отрицательного к новому ЕK, в то время как слабый выходящий ток в пределах существующей разницы потенциалов, положительный по отношению к новому ЕK, сохраняется. K+-каналы, выпрямляющие входящий ток, образуются а-субъединицами, формирующими поры этих K+-каналов. В отличие от а-субъединиц Kv, а-субъединицы Kir имеют только 2 (а не 6) трансмембранных домена. Молекулярные исследования выявили, что а-субъединицы подсемейства Kir2 (Kir2.1 и Kir2.2) кодируют только K+-каналы, выпрямляющие входящий ток (IK1) в КМЦ.
В КМЦ а-субъединицы Kir6.2 связываются с белками рецепторов сульфонилмочевины и формируют саркоплазматические селективные К+-каналы IK.ATP. Считают, что каналы IK.ATP играют ведущую роль в развитии ишемии миокарда и предшествующих ей состояний. Например, открытие сердечных саркоплазматических каналов IK.ATP лежит в основе электрокардиографического подъема сегмента ST на ЭКГ при острой ишемии миокарда. Такие препараты, как никорандил и диазоксид, открывают АТФ-чувствительные К+-каналы, тогда как производные сульфонилмочевины (глибенкламид) подавляют активность IK.ATP.
В основе молекулярной структуры К+-канала, активируемого ацетилхолином (IK.Ach), лежит гетеродимер, состоящий из двух субъединиц канала, выпрямляющего входящий ток, — Kir3.1 и Kir.3.4. Стимуляция IK.Ach ацетилхолином, секретируемым из окончаний блуждающего нерва, приводит к уменьшению спонтанной деполяризации в СУ и замедлению скорости проведения импульса в АВ-узле.
При связывании аденозина с активированным посредством G-белка пуринергическим рецептором типа 1 также повышается активность IK.Ach в предсердиях, СУ и клетках АВ-узла, что позволяет рассматривать это соединение как препарат выбора при лечении атриовентрикулярной реципрокной тахикардии (АВРТ).
д) Сердечный канал водителя ритма. Каналы, обеспечивающие пейсмекерный ток I, (funny-ток) в КМЦ СУ, кодируются семейством генов, активируемых при гиперполяризации и управляемых циклическими нуклеотидами воротных каналов (IICN). Из 4 известных а-субъединиц, формирующих поры HCN, HCN4 в наибольшей степени экспрессируется в миокарде млекопитающих. Мутации в гене HCN4 у человека связаны с наследственной синусовой брадикардией.
- Возврат в раздел сайта "кардиология"
Оглавление темы "Проводящая система сердца":- Функции и иннервация синусового узла
- Механизмы проведения возбуждения от синусового узла по предсердиям
- Топография, строение атриовентрикулярного узла (АВ-узла) и проведение по нему
- Топография, строение пучка Гиса и проведение по нему
- Топография, строение волокон Пуркинье и проведение по ним
- Клеточный состав АВ-узла и пучка Гиса
- Иннервация АВ-узла, пучка Гиса и желудочков сердца
- Вегетативная нервная система как причина аритмии и внезапной смерти
- Строение ионных каналов сердца и обмен ионов
- Молекулярное строение ионных каналов кардиомиоцитов сердца
