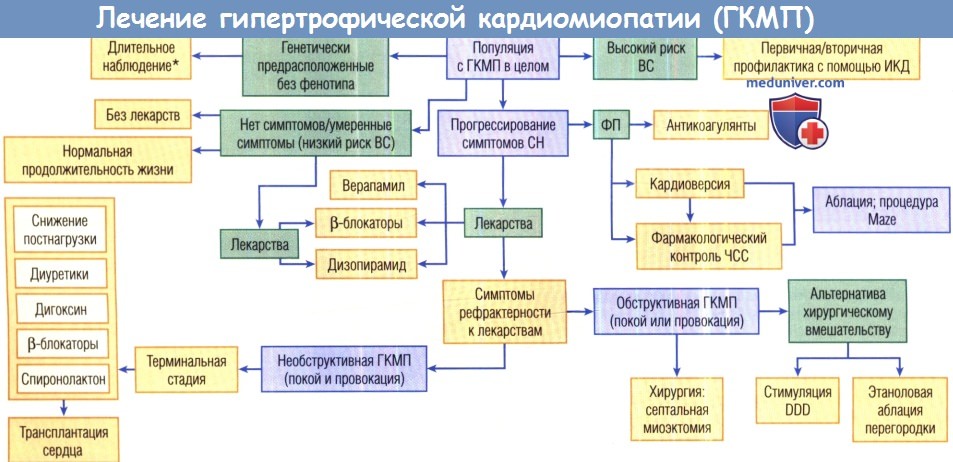
Методы лечения гипертрофической кардиомиопатии (ГКМП)
а) Профилактика внезапной смерти при гипертрофической кардиомиопатии (ГКМП). Искуственные кардиовертер-дефбрилляторы (ИКД) зарекомендовали себя эффективными и надежными устройствами для пациентов с ГКМП при купировании потенциально фатальных желудочковых тахиаритмий. ИКД применяют как для вторичной профилактики путем имплантации после остановки сердца (11% в год), так и для первичной профилактики при наличии одного или нескольких ФР (4% в год).
Для пациентов, которые относятся к группе высокого риска внезапной сердечной смерти (ВСС) на основании анализа традиционных ФР, следует рассмотреть возможность профилактики ВСС с помощью ИКД.
Профилактическое эмпирическое фармакологическое лечение амиодароном (или β-блокаторами либо верапамилом) бессимптомных пациентов высокого риска для снижения риска ВСС сейчас является устаревшим подходом, от которого в значительной мере отказываются из-за отсутствия доказательств эффективности, а также возможности установки ИКД в качестве эффективной профилактической терапии. Более того, антиаритмическая терапия амиодароном у молодых пациентов, вероятно, нецелесообразна, поскольку высок долгосрочный риск выраженных побочных эффектов.
В то же время количество факторов риска (ФР) у пациентов, нуждающихся в первичной профилактике, не связано с вероятностью того, что имплантация соответствующего устройства будет прерывать ЖТ или ФЖ. Значительная часть пациентов с ИКД, имплантированным профилактически в качестве жизнесберегающей терапии (35%), имеет только один маркер риска. Примечательно, что существует продолжительный период между решением об установке ИКД и моментом, когда прибор срабатывает и прерывает крайне непредсказуемую желудочковую тахиаритмию. При ГКМП, как считают, практически отсутствует риск смерти, связанной непосредственно с процедурой имплантации.
б) Лекарства при гипертрофической кардиомиопатии (ГКМП):
1. Лечение средечной недостаточности (СН). СН у пациентов с ГКМП манифестирует одним из двух клинических профилей симптомов, что обусловливает применение различных терапевтических стратегий. Чаще всего симптомы представлены одышкой при нагрузке и утомляемостью, что указывает на повышенное венозное давление в легких при нормальной или гипердинамической систолической функции. Эти симптомы могут быть связаны с диастолической дисфункцией, обструкцией выходного отдела, микрососудистой ишемией миокарда или их комбинацией. Ответ организма пациента на лекарственную терапию весьма вариабелен, поэтому конкретному пациенту ее часто подбирают эмпирическим путем.
Начиная с середины 1960-х гг. стали широко использовать различные блокаторы β-адренергических рецепторов для купирования и контроля симптомов СН у пациентов как с обструктивной, так и с необструктивной ГКМП. В настоящее время используют длительно действующие препараты - пропранолол, атенолол, метопролол или надолол. β-блокаторы улучшают симптоматику, замедляя сердечный ритм и уменьшая силу сокращения ЛЖ, тем самым улучшая наполнение и расслабление желудочков и снижая потребление кислорода миокардом. За счет ингибирования симпатической стимуляции сердца Р-блокаторы могут снижать градиент выходного отдела, возникающий в условиях физиологической нагрузки.
Верапамил улучшает симптоматику и повышает толерантность к нагрузке в основном у пациентов без выраженной обструкции ВОЛЖ, благотворно влияя на расслабление и наполнение желудочков, но у некоторых пациентов со значительным повышением легочного венозного давления и выраженной обструкцией прием верапамила может привести к отеку легких и внезапной смерти. В качестве третьего варианта терапии можно использовать дизопирамид (в комбинации с β-блокаторами), когда другими препаратами не удается достичь контроля, поскольку он не оказывает проаритмогенное действие при ГКМП. Для уменьшения застоя крови в легких, снижения давления наполнения АЖ и снятия субъективных симптомов можно назначать диуретики как отдельно, так и в комплексе с β-блокаторами или верапамилом.
При ГКМП лекарственную терапию обычно начинают с β-блокаторов или верапамила, причем неважно, что назначать первым. Доказательств преимущества комбинации этих лекарств нет; известно, что при совместном использовании они могут чрезмерно замедлить ЧСС и/или снизить АД.
Терапевтические стратегии в отношении пациентов в терминальной стадии систолической дисфункции ЛЖ такие же, как и для лечения ХСН при других болезнях сердца, и могут включать назначение β-блокаторов, ИАПФ или БРА и диуретиков, а также дигоксина, спи-ронолактона и варфарина. Терминальная стадия — ФР ВСС и потенциальное показание к установке ИКД в целях профилактики на время ожидания пересадки сердца].
Уровни МНУП в плазме независимо ассоциируются с выраженностью симптомов СН при ГКМП. Однако уровень МНУП при этом заболевании имеет ограниченное клиническое значение в качестве биомаркера СН вследствие значительного совпадения среди пациентов с различной выраженностью симптомов, а также наличия таких переменных, как повышенная толщина стенки ЛЖ и возраст.
2. Лечение фибрилляции предсердий при ГКМП. Наиболее частая стабильная аритмия при ГКМП — это ФП, при которой необходимы экстренная госпитализация и «агрессивные» терапевтические вмешательства, а также нередко наступает потеря трудоспособности. Эпизоды пароксизмов или хроническая ФП встречаются у 20% пациентов с ГКМП. С возрастом частота эпизодов растет, что связано с увеличением ЛП. ФП довольно хорошо переносят 30% пациентов, поэтому ФП не считают независимой детерминантой ВСС при ГКМП. Известно, что ФП сопровождается эмболическими инсультами (частота 1% в год, распространенность 6% в год), прогрессирующей СН, инвалидизацией и иногда летальным исходом, особенно если сочетается с обструкцией выходного отдела в покое или манифестацией аритмии в возрасте моложе 50 лет.
Пароксизмальная ФП может иногда быть причиной острой клинической декомпенсации, при которой понадобится экстренная электрическая или фармакологическая кардиоверсия. Самым эффективным в купировании рецидивов ФП считается амиодарон, хотя данных в отношении пациентов с ГКМП недостаточно. При хронической ФП сердечный ритм обычно контролируют (3-блокаторами и верапамилом, аблация АВ-узла и постоянная желудочковая стимуляция нужны редко. В связи с потенциально возможным тромбообразованием и эмболизацией пациентам с ФП показана антикоагулянтная терапия варфарином. Поскольку даже 1 или 2 пароксизма ФП при ГКМП уже ассоциируются с риском системной тромбоэмболии, порог начала антикоагулянтной терапии низкий.
Однако такое клиническое решение следует принимать индивидуально для каждого пациента с учетом обязательной модификации образа жизни, риска геморрагических осложнений и ожидаемой комплаентности. Некоторые успехи терапии рефрактерной ФП, осложняющей ГКМП, были показаны на небольшом количестве пациентов после хирургической процедуры Maze и катетерной аблации с изоляцией легочных вен.
в) Немедикаментозная терапия гипертрофической кардиомиопатии:
1. Хирургическое лечение. На основе успешного опыта нескольких центров по всему миру в течение свыше 45 лет хирургическую миоэктомию перегородки считают первичным методом лечения пациентов с тяжелой, рефрактерной к лекарственной терапии СН и выраженным ограничением физических возможностей (III и IV ФК NYHA), сочетающимися с обструкцией ВОЛЖ в условиях покоя или физиологической нагрузки (градиент > 50 мм рт. ст.). Пациенты с незначительной симптоматикой, у которых повышение градиента выходного отдела может провоцироваться (например, физиологической нагрузкой), также являются кандидатами на хирургическое лечение с таким же клиническим эффектом, как и у пациентов с обструкцией в покое.
Следует учитывать, что повышение выходного градиента нефизиологическими средствами, например инфузией инотропных средств и стимуляторов катехоламиновых рецепторов (в частности, добутамина и изопротеренола), не является оптимальным методом.
Трансаортальная септальная миоэктомия из полости желудочков (операция Morrow) заключается в резекции небольшого кусочка мышцы (обычно от 2 до 10 г) из базальной части МЖП. Некоторые хирурги выполняют более «агрессивную» миоэктомию, распространяющуюся дистальнее по перегородке примерно на 7 см. Интраоперационная летальность из года в год стабильно падает и составляет сейчас < 1%, а в центрах с большим опытом за последние 12 лет приблизилась практически к нулю.
Первичная цель хирургической миоэктомии перегородки — уменьшение симптомов СН и улучшение КЖ после устранения обструкции выходного отдела. Действительно, у 95% пациентов после миоэктомии наблюдается выраженное снижение исходного градиента в выходном отделе без изменения глобальной функции ЛЖ. Долгосрочные наблюдательные исследования зарегистрировали уменьшение симптомов у 85% пациентов в течение 25 лет и 10-летнюю послеоперационную выживаемость, достигающую 83%. Свидетельств того, что миоэктомия приводит к терминальной стадии СН с развитием систолической дисфункции и ремоделированием ЛЖ, нет. Длительный опыт применения септальной миоэктомии доказал, что обструктивная ГКМП представляет собой механическую и хирургически обратимую форму СН.
Помимо этого есть подтверждение, что миоэктомия влияет на клинические проявления ГКМП. Долгосрочная выживаемость пациентов после операции сопоставима с таковой в общей популяции и превосходит этот показатель у неоперированных пациентов с ГКМП с обструкцией выходного отдела в плане уменьшения риска внезапной сердечной смерти (ВСС). Хирургическая миоэктомия не рекомендуется бессимптомным пациентам или со слабо выраженными симптомами, также нет доказательств, что хирургическое устранение обструкции в профилактических целях улучшает КЖ в долгосрочной перспективе и повышает выживаемость. Однако на практике детям младшего возраста с симптомами обструктивной ГКМП обычно проводят септальную миоэктомию при функциональных ограничениях ниже III ФК NYHА.
Иногда у пациентов наблюдается обструкция выходного отдела по иному механизму, чем ПСД, когда есть аномальное прикрепление папиллярной мышцы прямо к передней митральной створке (без хорды), что приводит к мышечной обструкции на уровне середины желудочков. Миоэктомия с продлением в дистальном направлении является предпочтительной стратегией для устранения мышечной обструкции в результате врожденной аномалии митрального аппарата.
2. Двухкамерная кардиостимуляция. Постоянная двухкамерная кардиостимуляция была внедрена 15 лет назад в качестве альтернативы миоэктомии для пациентов с обструктивной ГКМП при наличии выраженных рефрактерных симптомов. Однако ряд рандомизированных исследований показал, что субъективно ощущаемое улучшение симптомов при кардиостимуляции не сопровождается объективным повышением переносимости физической нагрузки и, скорее, является эффектом плацебо. У некоторых пациентов на фоне кардиостимуляции может наблюдаться снижение субаортального градиента, но оно обычно умеренное и непостоянное, если сравнивать с результатами миоэктомии. У специально отобранных пациентов пожилого возраста (старше 65 лет) кардиостимуляция может быть эффективной, тем не менее роль этого метода лечения ГКМП очень ограниченна.
3. Этаноловая септальная аблация. Недавно внедренная чрескожная этаноловая септальная аблация быстро стала популярной. Во время этой процедуры в большую септальную КА вводят от 1 до 3 мл 96-98% спирта, чтобы вызвать некроз и стабильный ИМ в проксимальной части перегородки. Образование рубца в этой части ведет к прогрессирующему истончению и ограничению движения МЖП, расширению выходного отдела и в конечном счете уменьшению субаортальной обструкции и митральной регургитации, имитируя ремоделирование ЛЖ, которое происходит в результате хирургической миоэктомии.
Этаноловая аблация может существенно снизить градиент ВОЛЖ и симптомы СН у многих пациентов, но эффект имеет меньшую длительность (в среднем 2-3 года) по сравнению с миоэктомией (до 45 лет).
Сравнительный анализ нерандомизированных исследований показал сравнимое уменьшение градиента после этаноловой аблации, но несколько менее стойкое и не такое полное, как при миоэктомии. Около 20% пациентов могут понадобиться повторные этаноловые аблации из-за неудовлетворительных гемодинамических и клинических результатов после первой процедуры.
Поскольку чрескожная этаноловая септальная аблация была воспринята как менее инвазивное и легче выполнимое вмешательство, чем хирургическая миоэктомия, внедрение чрескожной этаноловой септальной аблации в кардиологическую практику было столь стремительным, что позволило снизить порог ее применения (относительно выраженности симптомов и обструкции). Экспертная согласительная группа ACC/ESC (American College of Cardiology/European Society of Cardiology) рекомендует хирургическую септальную миоэктомию в качестве первичного метода лечения пациентов с тяжелыми рефрактерными симптомами и выраженной обструкцией выходного отдела, а этаноловую аблацию рассматривает как альтернативную лечебную стратегию у отдельных пациентов: пожилого возраста, с наличием большого количества сопутствующих заболеваний и повышенным риском, при невозможности обращения в крупные хирургические центры или с риском неблагоприятных событий при хирургическом вмешательстве.
Однако многие долгосрочные проблемы этаноловой аблации остаются нерешенными. Например, одна из наиболее важных — клиническое значение трансмурального рубца, занимающего около 10% стенки ЛЖ, который представляет собой потенциально нестабильный аритмогенный субстрат, повышающий у некоторых пациентов риск ВСС. Уровень смертности при этаноловой аблации в центрах, имеющих подобный опыт (2%), несколько выше, чем при хирургическом лечении в учреждениях, специализирующихся на ГКМП, но, исходя из практических соображений, маловероятно, что для решения этих проблем будет проведено рандомизированное исследование для сравнения миоэктомии и аблации.
DDD — режим двухкамерной стимуляции; ВС — внезапная смерть; ИКД — имплантируемый кардиовертер-дефибриллятор;
СН — сердечная недостаточность; ФП — фибрилляция предсердий; ЧСС — частота сердечных сокращений.
* Специфическое или интервенционное лечение не показано, в исключительных случаях.
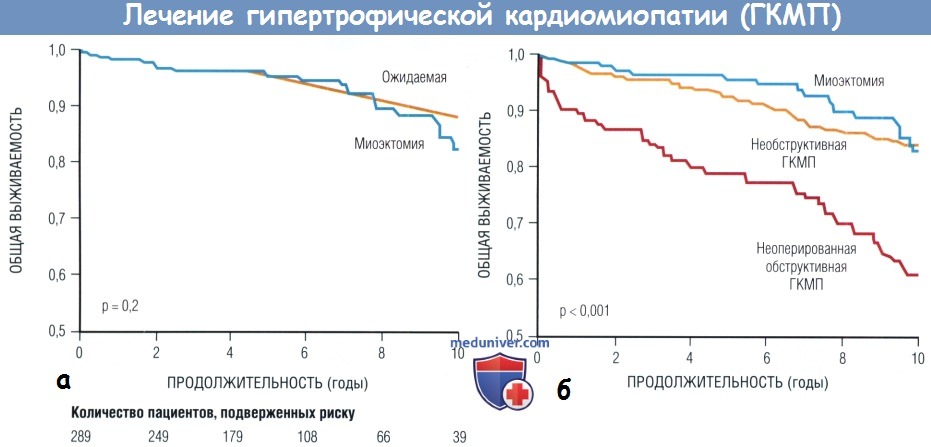
(А) Выживаемость, независимая от любых причин смерти, после миоэктомии при обструктивной ГКМП (n = 289) по сравнению с популяцией США, разделенной по полу и возрасту.
(Б) Выживаемость, независимая от любых причин смерти, в трех подгруппах пациентов с ГКМП — после хирургической септальной миоэктомии (n = 289), неоперированных с обструкцией n = 228) и без обструкции (n = 820).
Общий log rank критерий и миоэктомия по сравнению с неоперированной обструктивной ГКМП (р < 0,001).
ГКМП — гипертрофическая кардиомиопатия.
- Читать "Эндокардит и беременность при гипертрофической кардиомиопатии (ГКМП)"
Оглавление темы "Гипертрофическая кардиомиопатия (ГКМП).":- Гипертрофическая кардиомиопатия (ГКМП) - генетика, причины
- Морфология и гистология гипертрофической кардиомиопатии (ГКМП)
- Патофизиология гипертрофической кардиомиопатии (ГКМП)
- Клиника и диагностика гипертрофической кардиомиопатии (ГКМП)
- Течение и прогноз гипертрофической кардиомиопатии (ГКМП)
- Методы лечения гипертрофической кардиомиопатии (ГКМП)
- Эндокардит и беременность при гипертрофической кардиомиопатии (ГКМП)
