Механизмы образования пенистых клеток при атеросклерозе
Попав в интиму артериальной стенки, моноциты захватывают липиды и превращаются в пенистые клетки или нагруженные липидами макрофаги. На поверхности большинства клеток экспрессированы классические ЛНП-рецепторы, однако они не способны регулировать накопление липидов в пенистых клетках.
Доказательством этому служат клинические проявления атеросклероза, когда у пациентов, страдающих отсутствием функционально активных ЛНП-рецепторов (гомозиготы по семейной ГХС), образуются сухожильные ксантомы, заполненные превращающимися в пенистые клетки макрофагами. ЛНП-рецепторы не участвуют в образовании пенистых клеток, поскольку их собственная активность тонко регулируется внутриклеточным содержанием холестерина (ХС).
Действительно, как только в клетку за счет рецепторного захвата липопротеинов низкой плотности (ЛНП) поступит ХС в достаточном для ее метаболических потребностей количестве, тонко настроенный механизм транскрипционного контроля заблокирует экспрессию рецептора.
Помимо классических ЛНП-рецепторов существует ряд так называемых скавенджер-рецепторов, которые, как оказалось, осуществляют избыточный захват липидов, что является характерным механизмом образования пенистых клеток. Наиболее изученный скавенджер-рецептор принадлежит семейству А.
Эти поверхностные молекулы преимущественно связывают не нативные, а модифицированные липопротеины и, видимо, участвуют в их интернализации. На мышах, предрасположенных к атеросклерозу, но имеющих мутации, связанные с отсутствием функционирующих скавенджер-рецепторов А, было показано, что избыточное образование липидных отложений выражено в меньшей степени, чем у животных с функционально активным рецептором.
Из других рецепторов, способных связывать модифицированные липопротеины и участвовать в формировании пенистых клеток, следует назвать CD36 и макросиалин; для последнего характерно преимущественное специфическое связывание с окисленными формами ЛНП.
Оказавшись в интиме и превратившись в пенистые клетки, макрофаги начинают делиться. К факторам, запускающим деление макрофагов в АБ, вероятно, следует отнести макрофагальный колониестимулирующий фактор. Этот комитоген и фактор выживания для мононуклеарных фагоцитов обнаружен в АБ у человека и животных с экспериментальным атеросклерозом.
И вновь было показано замедленное формирование липидных отложений у мышей, предрасположенных к атеросклерозу, но с отсутствием функционально активного макрофагального колониестимулирующего фактора. Кандидатами на роль макрофагальных митогенов или комитогенов могут быть ИЛ-3 и гранулоцитарно-макрофагальный колониестимулирующий фактор. До этого момента вновь формируемая атерома состоит в основном из перегруженных липидами макрофагов.
Такие осложнения, как фиброз, тромбоз и кальцификация, нехарактерны для липидных полос — предшественников осложненной атеромы. Имеется ряд указаний, что такие липидные полосы могут иметь, по крайней мере частично, обратное развитие.
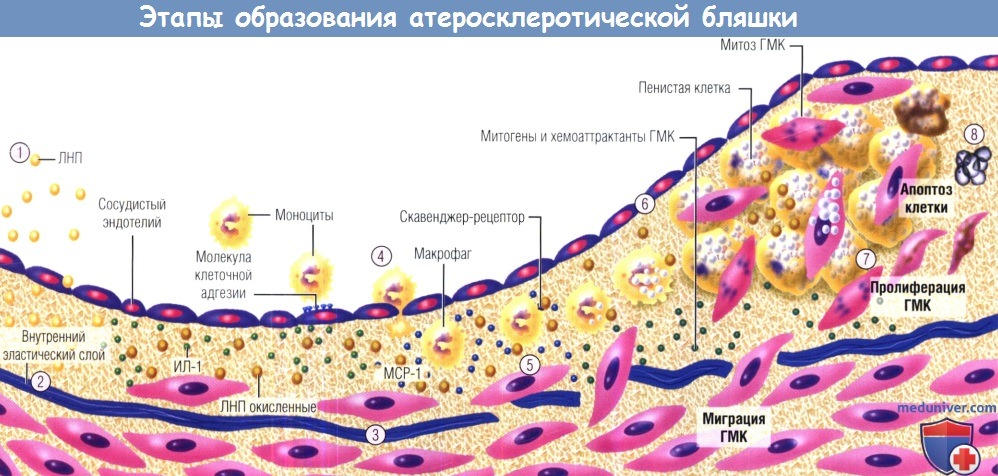
Этап 1: накопление части липопротеинов в интиме; модифицированные липопротеины показаны более темным цветом, модификация — окисление и гликозилирование.
Этап 2: соединения, вызывающие окислительный стресс, включая модифицированные липопротеины, индуцируют локальную продукцию цитокинов.
Этап 3: цитокины, в свою очередь, индуцируют повышенную экспрессию молекул адгезии лейкоцитов, посредством которых последние прикрепляются к эндотелию, и хемоаттрактантов, которые обеспечивают их миграцию в интиму.
Этап 4: моноциты крови, попадающие в артериальную стенку за счет взаимодействия с цитокинами-хемоаттрактантами (например, МСР-1),
получают стимулы (например, от макрофагального колониестимулирующего фактора), усиливающие экспрессию ими скавенджер-рецепторов.
Этап 5: скавенджер-рецепторы опосредуют захват модифицированных липопротеинов и ускоряют образование пенистых клеток.
Образовавшиеся из макрофагов пенистые клетки служат источником медиаторов, включая другие цитокины и эффекторные молекулы, такие как гипохлорная кислота, супероксид (O2-) и матриксные металлопротеиназы.
Этап 6: ГМК интимы делятся, другие ГМК мигрируют из медии в интиму.
Этап 7: ГМК делятся и продуцируют внеклеточный матрикс, способствуя тем самым его накоплению в растущей атеросклеротической бляшке. В такой ситуации липидная полоса превращается в фиброзно-жировое отложение.
Этап 8: на последних этапах происходит кальцификация (не показана) и продолжается фиброз, сопровождаемый иногда гибелью ГМК (в т.ч. путем апоптоза).
В результате формируется почти бесклеточная фиброзная покрышка, окружающая богатое липидами ядро, в котором также могут содержаться гибнущие или мертвые клетки и их детрит (продукт их распада).
МСР-1 — моноритарный хемоаттрактантный белок 1; ГМК — гладкомышечные клетки; ИЛ-1 — интерлейкин 1; ЛНП — липопротеины низкой плотности.
Видео механизм развития атеросклероза (патогенез)
- Возврат в раздел сайта "кардиология"
Оглавление темы "Атеросклероз":- Принципы лечения обмороков (синкопе, потери сознания)
- История изучения атеросклероза артерий
- Строение и функции эндотелиальных клеток артерий
- Строение и функции гладкомышечных клеток артерий
- Строение и функции интимы артерии
- Строение, функции медиа и адвентиции артерии
- Механизмы внеклеточного накопления липидов при атеросклерозе
- Механизмы захвата лейкоцитов при атеросклерозе
- Механизмы очагового накопления липидов при атеросклерозе
- Механизмы образования пенистых клеток при атеросклерозе
