Взаимодействия гормонов с иммунной системой
В настоящей и последующих статьях на сайте будут обобщены доказательства, показывающие, как нейроэндокринно-иммунная сеть объединяет функции человеческого организма как в здоровом состоянии, так и при болезни.
Фактически было продемонстрировано, что центральная и периферическая нервные системы имеют рецепторы для веществ иммунной системы, таких как провоспалительные цитокины и факторы роста. В то же время клетки иммунной системы и периферические ткани имеют рецепторы и способны продуцировать и катаболизировать нейротрансмиттеры и гормоны.
Следовательно, при основных иммуноопосредованных ревматических заболеваниях было описано несколько изменений взаимодействия между нервной, эндокринной и иммунной системами. В то же время лекарственные препараты, модифицирующие течение заболевание, и биологические препараты, по некоторым данным, показали способность восстанавливать гормональную активность и работу нервной системы, оказывая при этом свой основной иммуномодулирующий эффект.
Функции человеческого организма регулируются и интегрируются нервной и эндокринной системами как в норме, так и при патологии.
В этой и последующих статьях на сайте будут проиллюстрированы научные свидетельства того, что изменения в работе нервной и эндокринной систем имеют фундаментальное значение в патогенезе иммуноопосредованных ревматических заболеваний. Особое внимание будет уделено как исследованиям, положившим начало этому направлению исследований, так и появившимся в последнее время научным данным.
Нейрогормональное влияние на функции иммунной системы было впервые обнаружено в системе гипоталамус-гипофиз-надпочечники (система ГГН) (Gisler и Schenkel-Hulliger, 1971) (рис. 1). Открытие было подтверждено последующими исследованиями условий, при которых изменения активации системы ГГН приводят к воспалению, проведенными на животных моделях (Sternberg и соавт., 1989).
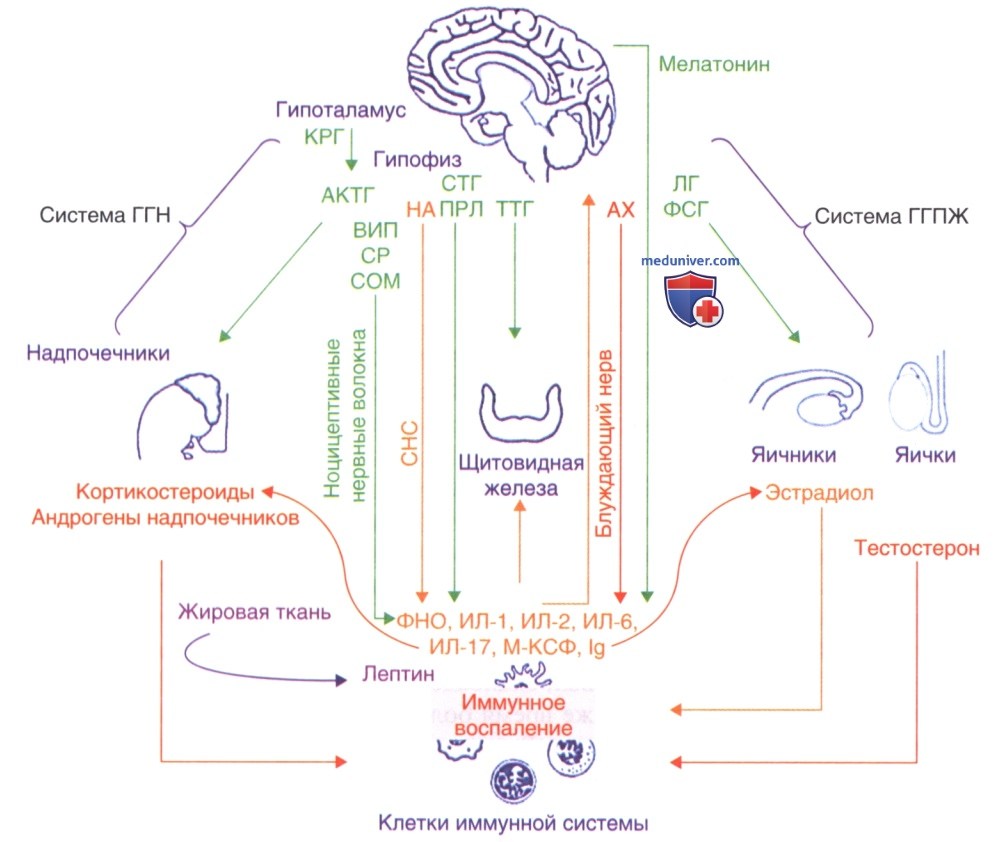
Многочисленные исследования, проведенные со второй половины прошлого века, продемонстрировали, что иммунные клетки способны воспринимать гормоны, нейромедиаторы и нейропептиды, присутствующие в их естественной среде, и реагировать на них. На нескольких клетках иммунной системы были обнаружены рецепторы нейроэндокринных факторов, таких как кортикостероиды, эстрадиол, тестостерон, инсулин, ПРЛ, СТГ, адренергические агенты, ацетилхолин, эндорфины, энкефалины, субстанция Р (СР) и соматостатин (рис. 1) (Werb и соавт., 1978; Gillette и Gillette, 1979; Abraham и Bug, 1976; Helderman и Strom, 1978а; Russell и соавт., 1984; Arrenbrecht, 1974; Hadden и соавт., 1970; Bourne и соавт., 1974; Landmann и соавт., 1981; Richman и Arnason, 1979; Hazum и соавт., 1979; Wybran и соавт., 1979).
В последнее время несколько авторов отметили, что количество и активность рецепторов также могут изменяться при различных состояниях клеточной активности. Например, большее количество рецепторов для инсулина и β-адренергических соединений наблюдалось в Т-лимфоцитах, переходящих из состояния покоя в активированное состояние (Helderman и Strom, 1978b; Dailey и соавт., 1988).
В свою очередь, рецепторы производных иммунной системы — фактор некроза опухоли а, ИЛ-1, ИЛ-2, ИЛ-6, колониестимулирующий фактор макрофагов, были обнаружены в здоровых эндокринных и нервных тканях, таких как гипофиз, надпочечники, щитовидная и поджелудочная железа, яички и яичники (рис. 9.1) (Kinouchi и соавт., 1991; De Souza и соавт., 1989; Smith и соавт., 1989; Ohmichi и соавт., 1992; Chang и соавт., 1994).
На здоровых людях было продемонстрировано, что цитокины, такие как ИЛ-6, вводимые подкожно, вызывали дозозависимое увеличение основного обмена и более высокую активность системы ГГН с более высоким уровнем кортизола или АКТГ в плазме крови, предполагая, что КРГ гипоталамуса опосредует влияние воспалительных молекул на функции организма. Более того, было показано, что ИЛ-6 также вызывает секрецию СТГ и ПРЛ и подавляет синтез ТТГ (Tsigos и соавт., 1997).
Таким образом, этим важным открытием была подтверждена роль системы ГГН в развитии нескольких хронических воспалительных заболеваний.
С другой стороны, наиболее значимые доказательства связи между процессами воспаления, секрецией цитокинов и работой эндокринных органов были получены в исследованиях второй системы, включающей гипоталамус, гипофиз и половые железы, в которых демонстрировалась роль ИЛ-1 а в угнетении репродуктивных функций при воздействии на центральную нервную систему и половые железы (рис. 1) (Rivier и Vale, 1989).
Взаимодействия гормонов с иммунной системой. Несоответствие концентраций половых гормонов, по-видимому, является основой гендерных различий при аутоиммунных расстройствах, но, несмотря на признанную противовоспалительную роль андрогенов, эстрогены, по-видимому, обладают как провоспалительной, так и противовоспалительной активностью (Hench, 1938; Straub, 2007).
На самом деле, эстрогены подавляют опосредованные Т-клетками заболевания органов, такие как очаговый сиалоаденит, почечный васкулит и околосуставное воспаление, но в то же время более высокие концентрации эстрогенов усугубляют опосредованные В-клетками и антителами явления, такие как иммуннокомплексный гломерулонефрит, в животных моделях (Carlsten и соавт., 1992). Подобные механизмы, по-видимому, возможны и у человека (Cutolo и соавт., 2003а).
Физиологические концентрации эстрогенов повышают иммунную и воспалительную активность, в то время как прогестерон и андрогены, такие как тестостерон и ДГЭА, обладают иммунодепрессивной активностью (рис. 9.1) (Cutolo и Wilder, 2000).
In vitro надпочечниковый андрогеноподобный гормон ДГЭА ингибирует секрецию ИЛ-6 в культивируемых мононуклеарных клетках человека (Straub и соавт., 1998а; Straub и соавт., 2000). Более того, ДГЭА может влиять на дифференцировку Т-хелперов лимфоцитов в сторону Тх1 или Тх2 (Chikanza и Grossman, 2000).
Любопытно отметить, что низкие сывороточные уровни противовоспалительных андрогенов при аутоиммунных/воспалительных заболеваниях у человека отмечаются не только из-за цитокин-индуцированного блока выработки андрогенов в надпочечниках и половых железах, но также вследствие повышенного превращения андрогенов в эстрогены в воспаленных тканях (Cutolo и соавт., 1999; Straub и соавт., 2013).
Кроме того, мелатонин, гормон, секретируемый в течение ночи шишковидной железой, по-видимому, активирует иммунную систему при нормальном или слегка повышенном уровне и усугубляет воспалительные заболевания, такие как РА (рис. 1) (Cutolo и Maestroni, 2005; Forrest и соавт., 2007).
Секреция мелатонина ассоциирована с чередованием дня и ночи и, следовательно, по-видимому, участвует в циркадных и сезонных ритмах патогенеза воспалительных аутоиммунных заболеваний (Cutolo и соавт., 2008; Srinivasan и соавт., 2008).
а) Жировая ткань и адипокины. Интересно, что до открытия лептина 20 лет назад жировая ткань рассматривалась как орган хранения жиров с ограниченной функцией в регуляции энергетического гомеостаза. Совсем недавно было выяснено, что адипокины с лептином, главным действующим веществом этого семейства, могут участвовать в нескольких биологических процессах (Conde и соавт., 2014).
На самом деле лептин — это гормон/цитокин, полученный из адипоцитов, который связывает нутритивный статус с нейроэндокринной и иммунной системами, а также с другими функциями организма.
В частности, лептин, первоначально описанный как гормон, препятствующий ожирению, как было показано впоследствии, оказывает важное влияние на иммунный гомеостаз и как цитокин может влиять как на врожденный, так и на приобретенный иммунитет. Лептин, вызывая провоспалительный ответ, играет роль в регуляции патогенеза аутоиммунных/воспалительных заболеваний (Procaccini и соавт., 2017).
Кроме того, увеличение выработки лептина, наблюдаемое при инфекционных и воспалительных процессах, еще больше подтверждает концепцию, что этот адипокин является частью сети цитокинов, которые участвуют в воспалительном/иммунном ответе, а также в механизмах защиты организма (Lago и соавт., 2008).
- Читать "Взаимодействия нервной и иммунной систем"
Редактор: Искандер Милевски. Дата публикации: 26.1.2023
- Взаимосвязь патологии надпочечников и аутоиммунных заболеваний
- Взаимосвязь акромегалии, гигантизма и аутоиммунных заболеваний
- Взаимосвязь гиперпролактинемии и аутоиммунных заболеваний
- Взаимосвязь патологии паращитовидных желез и аутоиммунных заболеваний
- Взаимодействия гормонов с иммунной системой
- Взаимодействия нервной и иммунной систем
- Изменения нейэроэндокринной системы при ревматоидном артрите
- Изменения нейэроэндокринной системы при ревматической полимиалгии, гигантоклеточном артериите
- Изменения нейэроэндокринной системы при системной красной волчанке (СКВ)
- Изменения нейэроэндокринной системы при синдроме Шегрена
