Бактериологическая диагностика кампилобактерий (Campylobacter, Arcobacter)
Основным, наиболее надежным и наилучшим образом разработанным методом лабораторной диагностики кампилобактериоза является бактериологическое исследование. Микроскопический метод, дающий вследствие низкой чувствительности значительное число ложноотрицательных результатов, является ориентировочным; серологический метод исследования в нашей стране еще не нашел широкого применения. Биологический метод исследования и кожно-аллергические пробы в диагностике кампилобактериоза не используются.
Чаще всего исследованию на кампилобактериоз подлежат: материалы от больных и здоровых людей, животных и птиц, вода (питьевая, открытых водоемов, сточная и т.д.), пищевые продукты и корма, почва, смывы с объектов окружающей среды, отходы и отбросы, трупный материал. При этом объектами исследования от человека и животных могут быть испражнения, моча, желчь, кровь, ликвор, сперма, влагалищное отделяемое, слюна, зубной налет, рвотные массы, синовиальная жидкость, биоптаты, отрезки кишечника, пробы органов от трупов, смывы с кожи и слизистых. Успех бактериологического исследования зависит от правильности взятия материала и своевременности исследования.
У больных ОКИ материалом для бактериологического исследования обычно служат образцы нативных фекалий или содержимое ампулы прямой кишки (ректальный мазок). Среди клинических симптомов «сигнальным» служит симптом гемоколита: наличие крови в кале является абсолютным показанием к исследованию на камиилобактериоз. Взятие материала следует производить в возможно ранние сроки заболевания, желательно до начала терапии антибиотиками. Далее обследование производится в течение всего периода болезни по показаниям к бактериологическому исследованию (появление крови в стуле, усиление или рецидив диареи).
Если условия работы лечебно-профилактического учреждения позволяют незамедлительно передавать отобранный материал в лабораторию для бактериологического исследования, то применение транспортных сред не является обязательным. При продолжительности транспортировки исследуемого материала более 1 ч с момента взятия, следует применять транспортные среды, такие как тиогликолиевая среда контроля стерильности, мясопептонный бульон, среда Эймиса, среда Кэри-Блэра, в которых микроорганизмы могут сохраняться свыше 10 дней при 4°С.
Материал для исследования транспортируется в пробирках (флаконах) с транспортной средой в соотношении 1:3-1:5. Ректальные тампоны доставляют только в транспортной среде.
Нативные фекалии перед посевом разводят в соотношении 1:10 стерильным физиологическим раствором или 0,1%-ной пептонной водой (ИВ) или другой из перечисленных транспортных сред и тщательно суспендируют. Аналогичным образом подготавливают к посеву и образцы, доставленные в иных транспортных средах.
Для выделения культур кампилобактерий используются сложные по композиции питательные среды, изготовленные из пищевого сырья и имеющие высокий индекс аминного азота, содержащие кровь барана (или лошади) и селективную добавку из антимикробных препаратов для подавления роста сопутствующей микрофлоры.
В последнее десятилетие создано большое количество различных прописей питательных сред, имеющих свои достоинства и недостатки. В нашей стране такими средами являются железо-эритритный кровяной агар (ЖЭКА), бактофок-МК, питательный агар КД, эритрит-агар, среда ВИЭВ, питательная среда для термофильных кампилобактерий, пластагаровые среды, мясопептонно-печеночный агар, сердечно-мозговой агар. Каждая из этих сред имеет несколько модификаций, различающихся в основном составом селективных добавок либо наличием крови или бактериологического активированного угля.
Для большинства плотных сред, обеспечивающих рост кампилобактерий, основой являются питательные агары: Мюллера-Хинтона, Колумбия, бруцеллезный, триптозный, основа для кровяного агара № 2. Однако было выявлено, что агары Колумбия и кровяной № 2 подавляют рост большинства штаммов кампилобактерий, а наилучшие результаты получены при использовании в качестве основы агара Мюллера-Хинтона.
Для культивирования кампилобактерий предложены также питательные среды жидкой и полужидкой консистенции с селективными добавками. Основами таких питательных сред являются питательный бульон, мясопептонно-печеночный бульон, а также среда для контроля стерильности с тиогликолятом натрия. Содержание агара в полужидких средах составляет 0,17-0,2%, повышение концентрации агара ведет к ухудшению роста кампилобактерий.
Выделение чистых культур кампилобактерий может осуществляться как путем прямого посева исследуемого материала на селективные питательные среды, так и методом мембранной селекции.
В первом случае 0,1 мл эмульсии фекалий (или другого исследуемого материала) наносят на поверхность селективной плотной питательной среды и рассевают по ее поверхности пентагональным штрихом либо равномерно растирают стеклянным шпателем.
Второй способ основан на способности кампилобактерий активно проникать на поверхность плотной питательной среды через фильтры различных систем с диаметром пор 0,45-0,65 мкм, при этом более крупные микроорганизмы остаются на поверхности фильтра. Методика мембранной селекции позволяет избежать использования селективных питательных сред. Вследствие простоты и экономичности использования методика рекомендуется для применения в небольших практических микробиологических лабораториях. Оптимально параллельное использование фильтров двух систем — мембранных и ядерных.
Методика включает два этапа: подготовку фильтров и посев. Мембранные фильтры, например отечественные мембраны «Владипор» МФА-МА (п/о «Тасма») №5 или №6, после трехкратного кипячения (отмывка и стерилизация) накладывают стерильным пинцетом на поверхность элективной плотной питательной среды (без селективной добавки), после чего чашки с фильтрами подсушивают. Полотно ядерных фильтров разрезают на квадраты 2x2 см, перекладывают бумагой и стерилизуют в автоклаве (1,1 атм при 121°С в течение 20 мин), либо в сухожаровом шкафу при температуре 170”С в течение 60 мин. После этого фильтры помещают на поверхность плотной элективной питательной среды.
В отличие от мембранных, ядерные фильтры могут быть использованы неоднократно: после обеззараживания кипячением, тщательного промывания водопроводной водой и стерилизации оставшиеся неповрежденными фильтры могут быть использованы повторно.
В ходе посева исследуемого материала на поверхность фильтра пастеровской пипеткой или стеклянной палочкой наносят 4-5 капель суспензии фекалий или другого материала, нриго-товленного с использованием физиологического раствора или фосфатно-солевого буфера (pH 7,0-7,2) в соотношении 1:5. После экспозиции в течение 1 ч фильтры удаляют пинцетом с поверхности среды; в дальнейшем они подлежат автоклавированию.
Все операции при работе с культурой кампилобактерий можно проводить в обычной атмосфере, однако следует избегать длительного контакта бактерий с кислородом воздуха.
Инкубация посевов осуществляется в микроаэрофильных условиях, которые создают с различной степенью эффективности несколькими способами. Наиболее доступным, но наименее эффективным способом является сжигание бытовой свечи, помещенной внутрь стеклянного эксикатора с плотно притертой крышкой (содержание кислорода в этом случае составляет не более 16%). Притертая вручную крышка эксикатора с нанесенным на нее слоем вазелина не может полностью предотвратить газообмен сквозь герметизирующий слой, поэтому концентрация кислорода в процессе инкубации непрерывно возрастает.
Более эффективный способ создания микроаэрофильных условий — сжигание бытовой свечи в емкости микроанаэростата с одновременным откачиванием воздуха вакуумным насосом любого типа до уровня, соответствующего отметке «— 0,8 атм» шкалы манометра.
Наилучшие результаты достигаются при использовании газовой смеси, содержащей 5% кислорода, 10% углекислого газа, 85% азота. Смесью такого состава заполняется емкость анаэростата (микроанаэростата), откуда предварительно откачан воздух до уровня, соответствующего отметкам «-0,9-1,0 атм» шкалы манометра. Процедура откачивания содержимого и заполнения пространства аппарата газовой смесью повторяется дважды, что позволяет достичь оптимальных условий для роста кампилобактерий.
Пригодная для культивирования газовая смесь получается путем смешивания углекислого газа и азота в соотношении 1:9 и однократного заполнения данной смесью пространства камеры анаэростата или микроанаэростата, откуда предварительно откачан воздух до уровня, соответствующего отметке «-0,6-0,7 атм» шкалы манометра.
Оптимальный способ создания микроаэрофильных условий — это использование газогенерирующих пакетов, производимых различными фирмами. Пакеты, создающие анаэробные условия культивирования (Anaerocult А и др.), для инкубации кампилобактерий не используются, так как кампилобактерии в анаэробных условиях не растут.
Более или менее надежные результаты могут быть получены при создании микроаэрофильных условий по методу Фортнера, когда культивируемые в замкнутой емкости совместно с исследуемым образцом бактерии родов Serratia, Acinetobacter, Providencia в результате собственного метаболизма поглощают кислород, снижая его содержание до приемлемого для кампилобактерий уровня. Методика простая и состоит в следующем: чашки с посевами исследуемых образцов вместе с чашками, засеянными газоном культуры любого из перечисленных выше микроорганизмов, помещают в полиэтиленовый пакет и после удаления из него избытка воздуха герметизируют посредством многократного перекручивания свободных краев пакета с последующей фиксацией специальным зажимом или аптечной резинкой.
а) Схема бактериологического исследования на кампилобактериоз.
Первый этап исследования:
1. Взятие материала и его транспортировка.
2. Подготовка исследуемого материала к работе.
3. Первичный высев штрихом или шпателем на поверхность селективных кровяных питательных сред, инкубация при 42°С в микроаэрофильных условиях. В качестве альтернативного может быть использован метод мембранной селекции, посев материала на неселективные кровяные питательные среды, инкубация при 37°С в микроаэрофильных условиях.
Второй этап исследования:
1. Просмотр чашек с посевами, макроскопическое изучение изолированных колоний.
2. Микроскопическое изучение выделенных колоний.
3. Пересев материала изолированных колоний на среду соответствующего состава (селективную кровяную или угольную) для дальнейшей идентификации. При этом длительность инкубации посевов может составлять до 72 ч при необходимом ежесуточном контроле роста культуры.
Третий этап исследования:
1. Проверка чистоты выделенной культуры.
2. Оценка подвижности выделенной культуры при фазово-контрастной микроскопии.
3. Постановка идентификационных тестов.
4. Учет результатов ряда идентификационных тестов (продукция оксидазы, каталазы, быстрый гидролиз гиппурата натрия).
5. Посев на чувствительность выделенной культуры к антибактериальным средствам.
6. Подготовка выделенной культуры для консервации.
Четвертый этап исследования:
1. Учет результатов тестов на способность к росту на среде Ресселя и при различных температурах (25°С; 30,5°С; 42 или 37НС).
2. Консервация выделенной культуры.
Пятый этап исследования:
1. Учет результатов теста на способность к росту в присутствии налидиксовой кислоты (резистентность к налидиксовой кислоте).
2. Учет результатов теста на чувствительность выделенной культуры к антибактериальным средствам.
3. Заключение: оформление результатов бактериологического исследования.
Примечание: лабораторная работа с культурами кампилобактерий должна проводиться согласно режимным моментам работы с патогенными культурами третьей группы.
Выделенные чистые культуры кампилобактерий подлежат немедленной идентификации с достаточным уровнем точности: для установления клинического диагноза определяется родовая принадлежность возбудителей. В то же время для исчерпывающего эпидемиологического анализа необходима их видовая и внутривидовая идентификация.
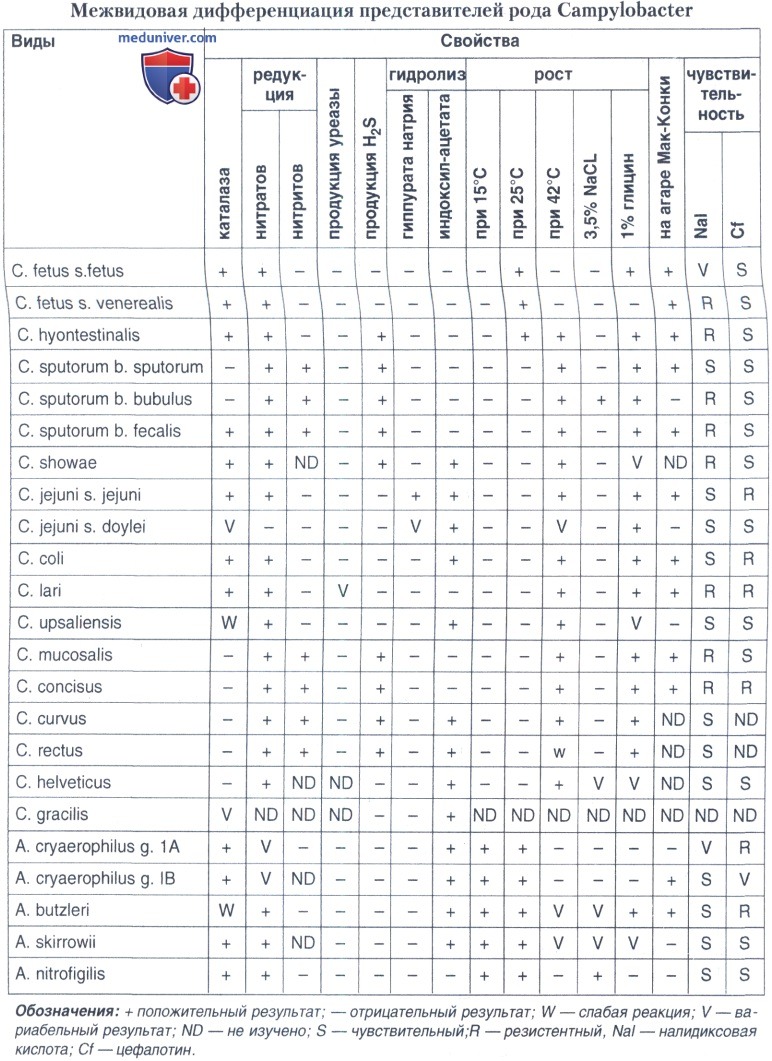
б) Идентификация кампилобактерий. Для проведения дифференциации на межвидовом уровне (еще на этапе инкубации посевов первичного материала) широко используется так называемый ростовой тест, позволяющий подразделить кампилобактерий на мезофильные (способные расти при 25-37°С) и термофильные (температурный оптимум роста 37-44°С).
Тест на продукцию каталазы позволяет дифференцировать две большие группы кампилобактерий: каталазопозитивные и каталазонегативные (или слабопродуцирующие). Среди каталазанегативных в последние годы выделяют термофильный вид — С. upsaliensis, характеризующийся чувствительностью к цефалотину, что предопределяет возможность выделения данного вида только на питательных средах, не содержащих цефалотин.
Совокупность таких признаков, как продукция каталазы, цитохромоксидазы, редукция нитратов и нитритов, потребность в водороде, способность продуцировать сероводород, способность к гидролизу индоксилацетата, отсутствие способности гидролизовать мочевину и утилизировать углеводы, позволяет подтвердить принадлежность выделенных культур к различным видам рода Campylobacter.
По некоторым из вышеперечисленных свойств штаммы кампилобактерий можно подразделить на различные варианты. Так, известны медленно растущие мезофильные варианты — штаммы С. jejuni; чувствительные к цефалотину штаммы термофильных кампилобактерий; нитратнегативные С. jejuni и С. coli; выявлены штаммы кампилобактерий, способные гидролизовать мочевину; обнаружены штаммы С. fetus, которые могут расти при 42°С. Но это еще не предел, необходим дальнейший поиск путей совершенствования видовой идентификации кампилобактерий.
Идентификация штаммов по культуральным и биохимическим свойствам упростилась в результате разработки микрометода для дифференциации кампилобактерий на основе 20 тестов (API Campy, фирма «bioMerieux», Франция). Однако более точными являются такие физико-химические методы идентификации, как хроматография и электрофорез. При помощи газо-жидкостной хроматографии проводят идентификацию кампилобактерий, основываясь на определении состава жирных кислот. Электрофорез в полиакриламидном геле позволяет проводить сопоставление профилей бактериальных белков и тем самым устанавливать таксономическое положение выделенных культур. Наиболее точным методом, позволяющим идентифицировать кампилобактерий до вида в чистой культуре или даже в смеси культур является ДНК-ДНК-гибридизация.
в) Определение чувствительности к антибиотикам. Постоянно расширяющееся использование антибактериальных препаратов в медицине и ветеринарии, а также с коммерческой целью в животноводстве, птицеводстве и пищевой промышленности приводит к тому, что с годами все больше появляется штаммов кампилобактерий, резистентных и полирезистентных к лекарственным препаратам. Как правило, число и доля штаммов, резистентных к антибактериальным средствам, зависят от видовой принадлежности культуры и, главное, от их происхождения (источника выделения).
Данные о лекарственной устойчивости возбудителей заболеваний, вызванных кампилобактериями, являются основой для выбора правильной тактики химиотерапии и подбора антибактериальных препаратов, применяемых в качестве селективных добавок к питательным средам для выделения возбудителей.
Определение чувствительности кампилобактерий к химиотерапевтическим препаратам проводится методом диффузии в агар с использованием импрегнированных бумажных дисков или методом серийных разведений в плотной питательной среде. Выбор метода зависит от цели исследования и возможностей лаборатории, выполняющей исследование.
Питательная среда, пригодная для этих целей — агар Мюллера-Хинтона с 5% крови лошади или барана.
Перед приготовлением суспензии испытуемого штамма кампилобактерий необходимо проведение ее фазово-контрастной микроскопии. Если культура содержит 25% и более кокковидных и гиперспирализованных форм или постороннюю микрофлору, она должна быть исключена из исследования.
Изучение чувствительности штаммов кампилобактерий к лекарственным препаратам предпочтительнее проводить методом серийных (двукратных) разведений препаратов в плотной питательной среде.
Испытуемые культуры в концентрации 107 КОЕ/мл наносят при помощи штампа-репликатора на поверхность плотной питательной среды, содержащей антибактериальный препарат в определенной концентрации.
После подсушивания чашки инкубируют в микроаэрофильных условиях при 37°С в течение 72 ч. Штамм считается резистентным при отсутствии видимой задержки роста в присутствии антибактериального препарата в среде в пороговой концентрации. Активность препаратов в отношении кампилобактерий оценивают по таким показателям, как МПК (минимальная подавляющая концентрация), МПК50 и МПК90 (концентрация препарата, подавляющая рост 50% и 90% штаммов соответственно). Контролем служит посев исследуемой культуры на питательную среду без антибактериальных препаратов.
Определение чувствительности к антибактериальным препаратам методом диффузии в агар с применением бумажных дисков следует расценивать как метод качественный. Благодаря простоте, скорости и легкости исполнения он является основным при определении чувствительности к химиотерапевтическим препаратам практическими лабораториями.
Для исследования могут быть использованы только стандартные импрегнированные диски заводского производства.
В стерильные чашки Петри диаметром 90-100 мм, расположенные на горизонтальной поверхности, наливают по 20 мл готовой остуженной питательной среды. Перед посевом поверхность среды должна быть просушена, чтобы посевной материал мог легко впитываться. В качестве посевного материала используется суспензия 48-72-часовой агаровой культуры густотой 109 по оптическому стандарту.
Бактериальная взвесь в количестве 1 мл наносится на поверхность агара и равномерно распределяется путем покачивания чашки с последующим отсасыванием избытка жидкости пипеткой. Чашки просушивают в течение 5-10 мин при комнатной температуре. На поверхность питательной среды в чашках Петри, засеянных штаммами кампилобактерий, укладывают бумажные диски, пропитанные антибактериальными средствами. В каждой чашке может быть испытано действие не более 4 антибиотиков. Диски накладывают на поверхность агара плотно, чтобы они тесно контактировали со средой, и следят за тем, чтобы не были положены сцепленные между собой диски. Размещают их на равном расстоянии друг от друга.
Чашки ставят в термостат перевернутыми кверху дном или вкладывают под крышку чашки кружок фильтровальной бумаги для впитывания конденсационной воды, которая может размыть газон, и инкубируют при 37°С в микроаэрофильных условиях при 95% влажности в течение 2-3 сут. в зависимости от появления роста в контрольной чашке.
При помощи линейки или измерителя и миллиметровой бумаги определяют диаметр зон задержки роста бактерий вокруг дисков, включая диаметр самого диска. В случае обнаружения внутри зоны задержки роста единичных колоний их относят к резистентным мутантам и всю исследуемую культуру считают резистентной.
- Читать далее "Методы экспресс-диагностики кампилобактерий (Campylobacter, Arcobacter)"
Редактор: Искандер Милевски. Дата публикации: 14.1.2020
- Кампилобактерии (Campylobacter, Arcobacter): морфологические, культуральные, биохимические свойства
- Устойчивость кампилобактерий (Campylobacter, Arcobacter) к факторам внешней среды, антибиотикам
- Антигены кампилобактерий (Campylobacter, Arcobacter)
- Клиника и проявления кампилобактериозов
- Эпидемиология кампилобактериозов
- Бактериологическая диагностика кампилобактерий (Campylobacter, Arcobacter)
- Методы экспресс-диагностики кампилобактерий (Campylobacter, Arcobacter)
- Серологическая диагностика кампилобактерий (Campylobacter, Arcobacter)
