Лабораторная диагностика возбудителя мелиоидоза (Burkholderia pseudomallei)
Основные методы исследования:
- микроскопический;
- бактериологический;
- биологический;
- иммунологические;
- аллергологический;
- генетические.
а) Микроскопический метод. Кроме мазков исследуемых культур микроскопически исследуют отпечатки гноя, слизи из абсцессов, крови, мокроты, пунктатов из лимфоузлов, язв. Окраска мазков проводится по Граму, Романовскому-Гимзе и метиленовым синим.
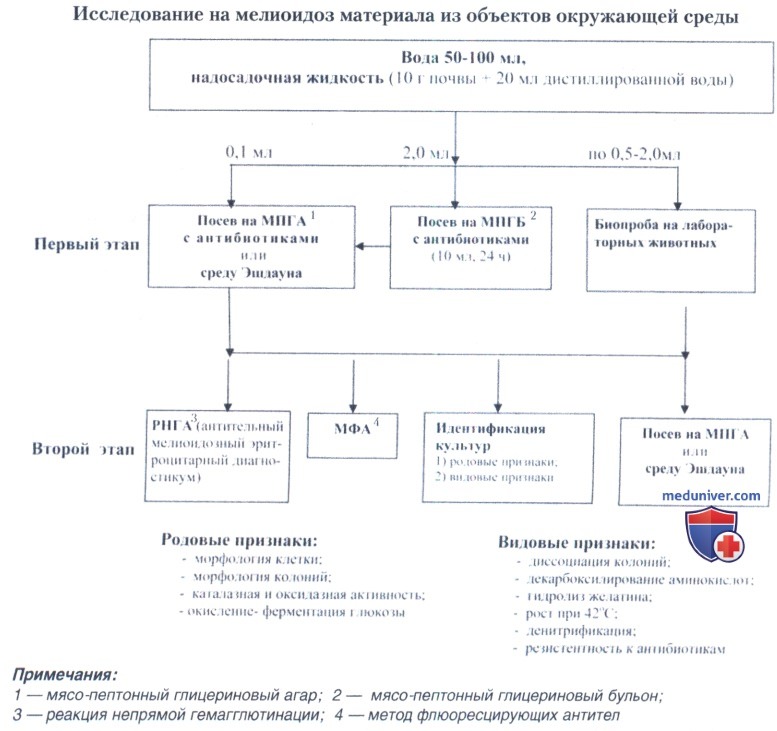
б) Бактериологический метод. Отбор и подготовка к исследованию материала от человека и животных. У больных животных и человека возбудитель мелиоидоза может быть выделен из содержимого абсцесса, мокроты, гнойного отделяемого язв, рвотных масс. При острой септической форме возбудитель обнаруживается в крови, моче, цереброспинальной жидкости и в полостных экссудатах.
С целью подавления роста посторонней микрофлоры в пробы, отобранные для бактериологического исследования, добавляют полимиксин (50 ЕД/мл) и гентамицин (4 мкг/мл). До начала исследования материал следует хранить при комнатной температуре, так как выдерживание проб в холодильнике может способствовать отмиранию в них возбудителя.
Асептически полученную кровь, цереброспинальную жидкость, экссудат засевают в мясопептонный бульон с 4% глицерина (МПГБ), одновременно делая посев на мясопептонный агар с 4% глицерина (МПГА), среду Эшдауна или другие селективные среды.
При исследовании внутренних органов умерших людей и павших животных, в зависимости от степени загрязнения посторонней микрофлорой, делают мазки-отпечатки на плотные среды: МИГА или среду Эшдауна. Кусочки органов (печень, селезенка, легкие и почки) объемом 1 см3 помешают в МПГБ или жидкую минимальную среду с антибиотиками и ведут анализ так же, как при обследовании объектов окружающей среды.
Отбор проб воды и почвы проводят в хорошо прогреваемых сырых местах, вблизи водопоев скота, навозохранилищ и жижесборников, на полях орошения.
Воду с поверхности луж, рисовых полей, мелких водоемов и искусственных емкостей отбирают в стерильные флаконы в объеме 50-100 мл. После доставки проб в лабораторию воду высевают по 0,1 мл на плотную среду с антибиотиками, содержащими неомицин (25 мкг/мл) и полимиксин (50-100 ЕД/мл) или среду Эшдауна. С целью обогащения 2 мл воды заливают в 10 мл жидкой минимальной среды с антибиотиками (ЖМАС). Пробирки со ЖМАС выдерживают при 37°С в течение суток, после чего петлей делают посев с поверхности среды на чашки с антибиотиками, содержащие неомицин (25 мкг/мл) и полимиксин (50-100 ЕД/мл) или на среду Эшдауна, которые инкубируют в течение суток.

Почву в количестве 5-10 г отбирают с глубины 10-30 см от поверхности (возбудитель быстро гибнет при высушивании и от ультрафиолетового облучения) в пробирки. В лаборатории готовят суспензии, добавляя по 1 г почвы в 10 мл стерильной дистиллированной воды, и встряхивают 10 мин. Суспензии дают отстояться в течение 10-30 мин. Надосадочную жидкость высевают по 0,1 мл на чашки с антибиотиками, а для обогащения по 1 мл переносят в пробирки со ЖМАС, которые инкубируют в течение 1 сут. при 37°С, после чего делают высев петлей на среду Эшдауна или другую плотную среду с антибиотиками. Чашки инкубируют при 37°С не менее 8 сут.
Отбор колоний. При посеве на МПГА возбудитель мелиоидоза через сутки формирует полупрозрачные колонии сероватого цвета с округлым ровным краем и гладкой поверхностью. Под малым увеличением часть колоний однородна, гомогенна, у других можно заметить начинающуюся складчатость. Через 48 ч наблюдается морфологическая диссоциация колоний — одни из них блестящие гладкие выпуклые с ровным краем (S-форма), другие имеют шероховатую или складчатую поверхность с неровным зубчатым краем (R-форма). При посеве на чашки с МПГА могут формироваться крупные слизистые М-колонии возбудителя мелиоидоза. Для исключения возможных ошибок следует сделать посев из подозрительных колоний на МПА без глицерина, на котором возбудитель мелиоидоза почти не формирует М-колоний.
При росте на среде Эшдауна мели-оидозные колонии приобретают темнокрасный цвет за счет сорбции нейтрального красного, вокруг колоний наблюдается просветление среды.
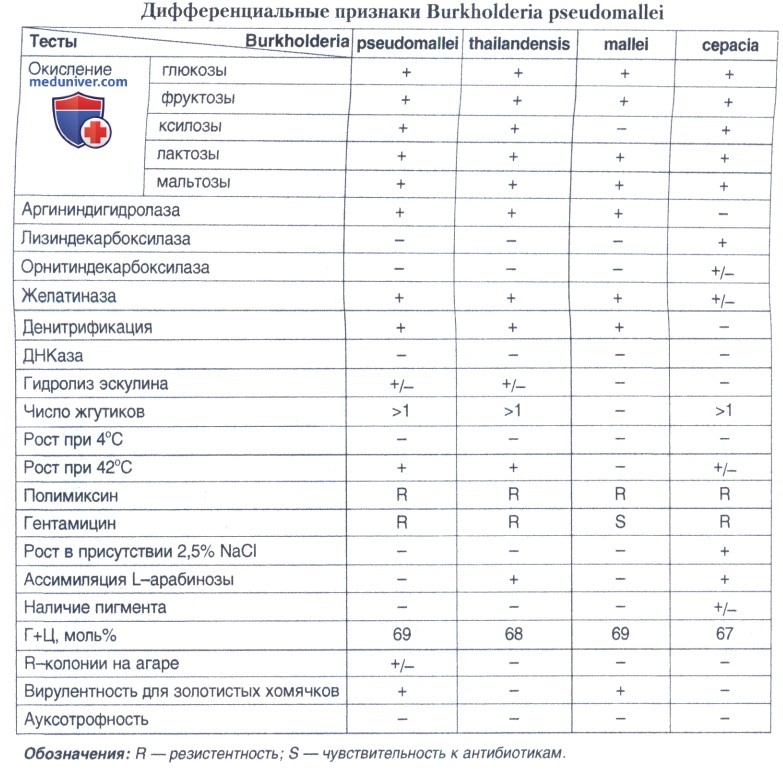
Идентификацию подозрительных колоний на принадлежность к виду В.pseudomallei проводят в два этапа: последовательно определяющих род и вид бактерий.
Культуры, подозрительные на принадлежность к роду Burkholderia, засевают на МПГА и изучают по основным дифференциальным (видовым) признакам.
в) Биологический метод — заражение золотистых хомячков, а при их отсутствии — белых мышей или морских свинок, лучше самцов. Кровь, цереброспинальную жидкость, экссудат из серозных полостей вводят в объеме 0,5-1,0 мл 2-5 золотистым хомячкам подкожно. Материал из абсцессов, отделяемого ран, рвотных масс, измельченные кусочки внутренних органов (печень, селезенка, почки, легкие) суспендируют в 2-3 мл 0,85%-ного раствора NaCl и после отстаивания надосадочную жидкость вводят двум животным подкожно по 0,5-1,0 мл.
Исследуемую воду вводят по 2,0 мл, а почву (надосадочную жидкость) — по 1,0 мл подкожно 5 золотистым хомячкам или морским свинкам и в объеме по 0,5 мл — белым мышам. Мелиоидоз у золотистых хомячков протекает в острой септицемической форме, заканчивающейся к 4-5-му дню летально. У самцов при внутрибрюшинном заражении возникают перитонит и орхит (скротальный феномен Штрауса), в перитонеальном экссудате обнаруживается возбудитель мелиоидоза. При посеве внутренних органов павших животных (легкие, печень, селезенка) на чашках с МПГА выделяют чистую культуру В.pseudomallei. За выжившими животными наблюдают не менее 20 сут., после чего их забивают, вскрывают и производят посев из паренхиматозных органов и крови на МИГА. Отбор подозрительных колоний осуществляют через 36-72 ч инкубации при 37"С. Для ускоренной идентификации культуры используют метод флуоресцирующих антител (МФА) и РНГА с мелиоидозным эритроцитарным антительным диагностикумом.
г) Иммунологические методы. Реакция агглютинации (РА), несмотря на общеизвестные недостатки, имеет наибольшее значение при идентификации в момент исследования колоний, выросших на плотных питательных средах. Реакция ставится по общепринятой методике и считается положительной при наличии четкой агглютинации в разведении 1:200 и выше.
Иммунофлуоресцентный анализ. Метод флуоресцирующих антител (МФА) является одним из наиболее чувствительных, специфичных и достоверных методов быстрого обнаружения возбудителя мелиоидоза в различных объектах исследования. Он позволяет получить предварительный ответ в течение 1-2 ч от момента начала исследования, идентифицировать возбудитель мелиоидоза на этапах ускоренного и классического лабораторного анализа биологически обогащенного материала.
РНГА с антительным мелиоидозным эритроцитарным диагностикумом применяется для обнаружения антигенов возбудителя мелиоидоза в бактериальных взвесях и суспензиях органов биопробных животных. Тщательно измельченные ножницами кусочки органов суспендируют в 0,85%-ного натрия хлорида в соотношении 1:5. Суспензию подвергают кипячению не менее 30 мин или обеззараживанию 4%-ным формалином в течение 1 ч и при необходимости осветляют фильтрацией через ватный тампон при помощи шприца.
Аллергическая внутрикожная проба ставится с использованием уитморина или маллеина. У человека она практически не применяется из-за возможного обострения процесса, особенно при хронической и подострой клинических формах, но очень широко используется в ветеринарной практике. Для выявления аллергической перестройки у больных людей рекомендуется проведение проб in vitro по оценке показателя повреждения нейтрофилов.
д) Генетические методы. ДНК-ДНК-гибридизация проводится на нитроцеллюлозных фильтрах, на которые наносят лизат или очищенную ДНК клеток исследуемой культуры. Введение радиоактивной метки в используемый ДНК-зонд проводят никтрансляцией с последующим хроматографическим разделением меченой ДНК и свободных нуклеотидов на сефадексе G-50. После добавления в систему зонда реакцию проводят в течение ночи при 42НС. Затем фильтры отмывают буферным раствором с додецилсульфатом натрия и визуализируют гибридизацию общепринятым методом радиоавтографии.
Генетическая трансформация является довольно специфическим тестом и позволяет дифференцировать штаммы возбудителей мелиоидоза и сапа от других видов буркхольдерий и псевдомонад. Для постановки реакции используют очищенную ДНК или хлороформенный лизат клеток изучаемой культуры. Этот материал смешивают в равном объеме с суспензией 1x109 микробных клеток/мл культуры реципиента (ауксотрофный мутант В. pseudomallei) и высевают на минимальную среду. На ту же среду в качестве контроля высевают отдельно взвесь реципиента и лизат. Наличие колоний прототрофов на «опытных» чашках и отрицательном контроле служит основанием для отнесения изучаемой культуры к В. pseudomallei (mallei).
Полимеразная цепная реакция (ПЦР). Постановка ПЦР в настоящее время нашла широкое применение при идентификации и типировании культур В. pseudomallei в эндемичных очагах. В России коммерческих систем для постановки реакции нет, однако в специлизированных по работе с возбудителями ООИ учреждениях имеются наборы праймеров для ПЦР-диагностики мелиоидоза. Для проведения реакции в режиме «горячего старта» первично готовят смесь №1, содержащую специфические олигонуклеотидные прямые и обратные праймеры для идентификации В. pseudomallei и В. mallei, дезоксирибонуклеозидтрифосфаты и деионизованную воду.
Для проведения ПЦР на поверхность смеси №1 наносят смесь №2, содержащую буферный раствор и Taq-полимеразу. Во все пробирки добавляют по 30 мкл вазелинового масла.
В микропробирки добавляют по 10 мкл растворов анализируемых проб. В отрицательный контроль вместо ДНК-пробы добавляют 10 мкл деионизированной воды. В положительный контроль — по 10 мкл раствора контрольного препарата ДНК. Микропробирки закрывают и помещают в ячейки рабочей камеры программируемого термостата в режиме «пауза».
Продукты ПЦР анализируют при помощи электрофореза в 1,5-2%-ном агарозном геле. Окрашенный бромистым этидием агарозный гель просматривают в ультрафиолетовом свете с длиной волны 305 нм. Результаты оценивают по наличию фрагментов ДНК, полосы которых располагаются на том же уровне в геле, что и полосы в положительном контроле.
е) Серологическая диагностика. Реакция агглютинации (РА). Следует отметить, что в сыворотках здоровых людей, никогда не выезжавших в эндемичные по мелиоидозу районы, могут присутствовать агглютинины в титрах 1:20-1:80; такие же титры реакции могут быть определены и при исследовании сывороток здоровых или больных другими инфекциями людей и животных. Нередко перекрестная РА с мелиоидозным диагностикумом регистрируется при заболевании сальмонеллезами. Кроме того, РА при мелиоидозе недостаточно чувствительна, невысокие ее титры (ниже диагностического уровня — 1:160) отмечаются не только при острой септической форме, но и при хронических, рецидивирующих формах заболевания. Значение РА несколько повышается при исследовании динамики титра антител в парных сыворотках.
Реакция непрямой гемагглютинации (РНГА) с антигенным мелиоидозным диагностикумом применяется для обнаружения специфических иммуноглобулинов в сыворотках людей и животных. Пробы сывороток перед исследованием инактивируются: человеческая — при 56"С 30 мин, бычья и свиная — при 58"С 30 мин; лошадиная — при 53°С 45 мин. Постановка РНГА и учет результатов проводятся по общепринятой схеме.
- Читать далее "Лечение и профилактика мелиоидоза"
Редактор: Искандер Милевски. Дата публикации: 3.2.2020
- Возбудитель мелиоидоза (Burkholderia pseudomallei): морфология, культуральные свойства
- Антигены и генетика возбудителя мелиоидоза (Burkholderia pseudomallei)
- Факторы патогенности возбудителя мелиоидоза (Burkholderia pseudomallei)
- Клиника и патогенез мелиоидоза
- Эпидемиология мелиоидоза
- Лабораторная диагностика возбудителя мелиоидоза (Burkholderia pseudomallei)
- Лечение и профилактика мелиоидоза
