Микробиологическая диагностика менингококка (N. menengitidis)
При проведении бактериологических исследований на менингококк следует помнить о его нестойкости, чувствительности к малейшим отклонениям от температуры 36-37°С. Термостат должен быть хорошо отрегулирован, питательные среды перед посевом — прогреты в термостате в течение 30-40 мин, агаровые среды — свежими (приготовленными не ранее, чем за одни сутки до использования). Среды с посевами могут находиться вне термостата не более 30 мин.
Материалом для исследования на менингококковую инфекцию служит спинномозговая жидкость, кровь, носоглоточная слизь, иногда серозные выпоты, отделяемое петехий, а также образцы трупного материала.
Наиболее ответственными являются исследования при подозрении на генерализованные формы — менингококцемию и менингит.
а) Исследование СМЖ при подозрении на менингит:
Первый день. При подозрении на менингит основным материалом для исследования является СМЖ. Ее берут (желательно, до применения антибиотиков) с соблюдением всех правил асептики стерильной иглой, соединенной со шприцем, и немедленно засевают в питательные среды, а также делают мазок на стекле.
Следует помнить, что возбудителями гнойного менингита, кроме менингококка, могут быть разнообразные виды бактерий — пневмококк, Haemophilus influenzae, листерии, стрептококк группы В, а также этиологические агенты оппортунистических инфекций — стафилококки, энтерококки, коринебактерии, эшерихии, сальмонеллы, псевдомонады, нейссерии, ацинетобактеры и др. Поэтому пробу СМЖ желательно посеять на 2-3 питательные среды для того, чтобы как можно быстрее уловить любой возможный возбудитель (см. 32.2.2.10). Обязательным является посев на «шоколадно»-кровяной агар — единственную среду, на которой способен расти и гемофил, и все упомянутые микроорганизмы. При отсутствии коммерческих ингредиентов и дрожжевого экстракта для посева СМЖ вполне приемлем «шоколадно»-кровяной агар, содержащий только 10% крови, прогретый при 80"С 10 мин.
Одновременный посев СМЖ на сывороточный агар и обычный мясопептонный агар значительно облегчают дифференциацию выросших микроорганизмов и ускоряют их идентификацию.
Если объем материала менее 0,5 мл, его засевают только на «шоколадно»-кровяной агар; оставшуюся часть СМЖ, независимо от ее количества, засевают в пробирку с 5 мл полужидкого агара для обогащения.
Посевы помещают в сосуд (желательно, чтобы в нем содержалось 5-7% CO2) и инкубируют в термостате при 36-37°С 20-22 ч.
Мазок СМЖ фиксируют спиртом, окрашивают 1%-ным раствором метиленового синего и микроскопируют. В препарате бывают видны диплококки и единичные кокки, расположенные вне и внутри полинуклеаров. У фагоцитированных кокков заметна капсула в виде бесцветного ободка на фоне окрашенной протоплазмы фагоцита.
На этом этапе окраска по Граму не рекомендуется, так как применяющиеся реактивы сильно деформируют фагоциты, находящиеся в СМЖ. На основании микроскопии мазка в случае обнаружения каких-либо микроорганизмов возможна выдача предварительного ответа.
Второй день. Через 20-22 ч просматривают чашки с выросшими колониями. Из СМЖ возбудитель вырастает в чистой культуре, так как в норме в ликворе нет никакой микрофлоры. Из выросших колоний делают препараты-мазки, окрашенные но Граму в модификации Г.П. Калины. В препаратах-мазках культур у менингококков меньше выражена тенденция к образованию пар, они могут быть расположены беспорядочно и поодиночке (см.рис.13.2.2, цв. вкл.). Отмечается неравномерность окрашивания клеток — от бледно-розовых до ярко-малиновых.
На «шоколадно»-кровяном агаре менингококк вырастает в виде бесцветных сероватых влажных колоний диаметром около 1 мм, не изменяя цвета крови. На агаре с сывороткой, как указывалось выше, колонии менингококка бесцветные, голубоватые в проходящем свете. На мясопепгонном агаре менингококк не растет. I (невмококк тоже растет на двух обогащенных средах в виде мелких суховатых бесцветных колоний, при этом кровяная среда вокруг них приобретает зеленовато-коричневый цвет. Н. influenzae вырастает только в чашке с «шоколадно»-кровяным агаром, не изменяя его цвета; колонии бесцветные влажные мелкие, но через 2-3 сут. увеличиваются и приобретают сероватый оттенок.
С учетом сказанного дальнейшее исследование выросшей культуры производят в соответствии с ее морфологическими, тинкториальными и культуральными свойствами. Если в мазках из колоний выявлены грамотрицательные кокки, то проводят их идентификацию как возможных представителей рода нейссерий, прежде всего менингококка. Ставят пробы на оксидазу и каталазу, делают отсев в пробирку с сывороточным агаром для получения чистой культуры. Если число выросших колоний позволяет, возможен отсев с чашки прямо на среду для определения чувствительности к антибиотикам.
В тот же день производят высев из среды обогащения в чашки со средами того же состава, что и при посеве нативной СМЖ.
Третий день. Изучают выросшую чистую культуру. Убеждаются в отсутствии у нее пигмента; если надо, повторяют реакции на оксидазу и каталазу. Для окончательной дифференциации менингококка и непигментных нейссерий и моракселлы (в редчайших случаях способных вызвать менингит) производят отсев на питательный агар без сыворотки и для контроля — на сывороточный агар. Осуществляют посев для определения чувствительности к антибиотикам (если это не было сделано накануне). Учитывая быструю утрату капсул менингококками, определяют серологическую группу, не дожидаясь окончательных результатов идентификации; для определения серогруппы ставят реакцию агглютинации (РА) на стекле и, если возникает необходимость, — развернутую РА.
Посевы на среды для определения сахаролитических свойств у культур, выделенных из СМЖ, необязательны. При отсутствии в ликворе сопутствующей микрофлоры и ничтожной вероятности выделения прочих нейссерий данным тестом можно пренебречь.
Просматривают посевы в чашках, сделанные накануне из среды обогащения, и исследуют их по схеме 2-го дня. Если роста на чашках не выявлено, то пробирку со средой обогащения выдерживают в термостате 7 дней, делая контрольные высевы через день по указанной схеме.
Четвертый день. Окончательно изучают посевы, сделанные накануне. Убеждаются в отсутствии пигментообразования у изучаемой культуры и в ее неспособности расти на агаре без сыворотки, учитывают антибиотикограмму, выдают ответ о результатах бактериологического исследования. В случае отсутствия роста при посеве нативной СМЖ и высеве из среды обогащения выдачу окончательного ответа задерживают до получения результата (положительного или отрицательного) при высеве из среды обогащения после 7 дней инкубации.
б) Исследование крови при генерализованных формах. Независимо от того, имеются или не имеются признаки бактериемии при менингите, а также при подозрении на менингококкемию необходимо сделать посев крови.
Кровь (не менее 5,0 мл) берут из вены и засевают во флакон с 50 мл полужидкого питательного агара. Посев инкубируют в термостате в течение 7 дней, произведя высев через 24 ч и в случае отсутствия роста повторяя высевы через день на те же среды, что и при посевах СМЖ. Выросшую культуру (гемокультуру) изучают так же, как и культуру из СМЖ.
При массивной бактериемии менингокки можно увидеть под микроскопом в окрашенном препарате крови. Каплю крови, оставшуюся в шприце после посева или взятую путем прокола кожи пальца, наносят на стекло и готовят препарат «толстой капли». Для этого каплю крови размазывают петлей до бляшки диаметром 1 см. Подсушенный на воздухе мазок окрашивают (не фиксируя!) 1%-ным водным раствором метиленового синего и, после высыхания, микроскопируют. С препаратом «толстой капли» следует обращаться как с подозрительным на содержание заразного материала.
При микроскопии можно увидеть пары и скопления кокков, лежащих между «тенями» эритроцитов, а иногда и внутри фагоцитов.
в) Исследование носоглоточной слизи. При генерализованной форме, у реконваллесцентов, назофарингите и подозрении на бактерионосительство у здоровых лиц (в окружении заболевших) исследуют слизь, взятую с задней стенки глотки.
Первый день. Материал берут натощак ватным тампоном, укрепленным на мягком проволочном стержне, изогнутом под углом 120°. Левой рукой берущий материал надавливает шпателем на корень языка, а правой — осторожно, не касаясь зубов и слизистой рта, заводит тампон за небную занавеску, прикладывает его к задней стенке глотки и выводит из ротовой полости, после чего удаляет шпатель. Материал немедленно засевают на питательную среду — 20%-ный сывороточный агар — в чашке Петри. Для подавления посторонней флоры (грамположительной) в среду рекомендуется вводить линкомицин. Наилучшие результаты можно получить при одновременном использовании двух сред — сывороточного агара с линко-мицином (его засевают первым) и сывороточного агара без антибиотика.
При невозможности немедленно посеять материал в связи с необходимостью транспортировки (более 3 ч) тампон с разогнутым стержнем погружают в транспортную среду — питательный бульон с линкомицином, из которой после доставки в лабораторию производят высев на сывороточный агар в чашку Петри. При транспортировке засеянных (агаровых или транспортных) сред не допускают их охлаждения.
Второй день. Через 22-24 ч инкубации посевов в термостате на поверхности среды вырастает большое количество разнообразных колоний — представителей нормальной микрофлоры. Колонии с признаками желтоватого пигмента, а также сухие и слизистые не исследуют. Для выделения чистой культуры отбирают колонии, подозрительные на менинго-кокковые. Их отсевают в пробирки или на сектора чашек с 20%-ным сывороточным агаром для менингококка.
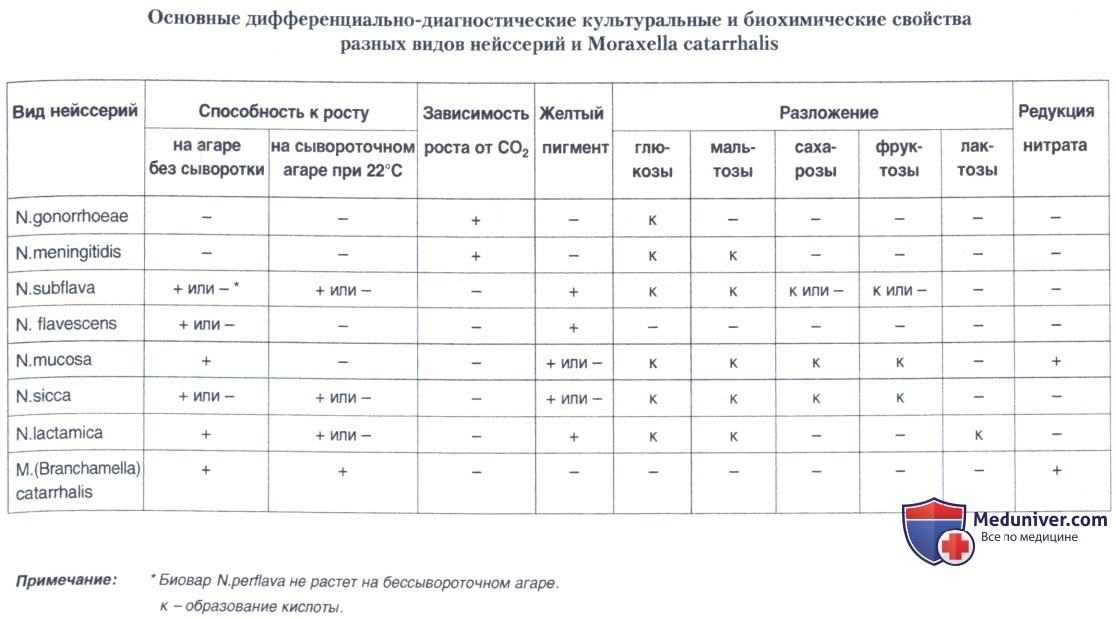
Третий день. Выделенные культуры дифференцируют с видами нейссерий — постоянными обитателями слизистых оболочек верхних дыхательных путей, но сходными по ряду признаков с менингококком. Они также обладают оксидазой и каталазой, но, кроме глюкозы и мальтозы, могут разлагать другие углеводы и восстанавливать нитраты. Многие нейссерии — комменсалы носоглотки способны расти на средах без добавления сыворотки, чем они отличаются от менингококка. Их рост не подавляется линкомицином.
Помимо этого менингококк необходимо дифференцировать со сходной морфологически и культурально моракселлой (бранхамеллой) — комменсалом ротоглотки Moraxella (Branchamella) catarrhalis, отличающейся положительной реакцией на восстановление нитратов.
Выделенные культуры снова просматривают на предмет пигментообразования. Наличие пигмента лучше выявлять при дневном свете. Для дальнейшего изучения оставляют лишь культуры, дающие нежный сливной рост непигментированных колоний. Из отобранных культур готовят препараты-мазки, окрашенные по Граму в модификации Калины. Культуры, содержащие грамотрицательные парные и беспорядочно расположенные неравномерно окрашенные кокки оставляют для дальнейшего изучения при помощи следующих тестов: на оксидазу, на каталазу, на ферментацию глюкозы, мальтозы, лактозы, фруктозы, сахарозы, способность расти на бессывороточном агаре (того же состава, что и сывороточный) при 37°С и на сывороточном агаре при 22°С, возможен посев на сывороточный агар с желчью. Последние два теста имеют значение только при положительном результате: рост при 22°С и на среде с желчью не позволяет отнести выделенную культуру к виду N.meningitidis. При необходимости ставят тест на восстановление нитратов для дифференциации с бранхамеллой.
Каждая изучаемая культура отсевается в пробирку с сывороточным агаром, чтобы на следующий день иметь суточную культуру.
Четвертый день. Изучают посевы, сделанные накануне. Суточные культуры, идентифицированные как менингококк, подлежат серологическому группированию в РА в этот же день.
По результатам исследований выдается окончательный ответ о выделении или отсутствии менингококка в носоглоточной слизи обследуемого лица.
д) Исследование материала из петехий. При наличии кожных высыпаний — петехий можно сделать попытку обнаружения в них менингококка. Кожу вокруг петехий осторожно обтирают тампоном, смоченным в 70%-ном спирте. При наличии некроза материал можно взять прокаленной и остуженной бактериологической петлей непосредственно из некротизированных участков. Если кожа не повреждена, то из петехий берут смыв. Для этого тонкой стерильной иглой, соединенной со шприцем, в котором содержится 0,1-0,2 мл изотонического раствора натрия хлорида, прокалывают кожу, вводят в толщу петехии жидкость и отсасывают ее обратно.
Взятый из петехии материал немедленно засевают в чашку Петри на сывороточный агар с линкомицином для подавления кожной микрофлоры и, распределив его петлей по среде, делают посев этой же петлей на сывороточный агар в чашке.
Из оставшегося в игле экссудата можно приготовить препарат-мазок, который подсушивают, фиксируют и окрашивают но Граму в модификации Калины.
Мазок из экссудата петехии можно сделать путем отпечатка. Для этого поверхность петехии слегка скарифицируют прокаленной и остуженной петлей, после чего к петехии прикладывают плашмя стерильное предметное стекло. Мазок-отпечаток обрабатывают так же, как и обычный бактериологический мазок.
При микроскопии иногда удается увидеть парные и единичные грамотрицательные кокки, на основании чего возможна выдача предварительного ответа.
Засеянные среды инкубируют при 37°С 24 ч в атмосфере CO2 (при отсутствии роста — 48 ч). Выросшие колонии, подозрительные на менингококковые, отсевают и изучают по схеме, описанной для культур, выделенных из носоглоточной слизи.
д) Исследование трупного материала. Трупный материал для бактериологического исследования желательно брать в наикратчайший срок после гибели больного.
Для исследования берется кровь из сердца, СМЖ, гной с поверхности головного мозга или кусочки головного мозга при менингите, в случаях менингококкемии — кусочки паренхиматозных органов.
Кровь в количестве 5-10 мл берут стерильной пипеткой, соединенной с грушей, из правого сердца после его вскрытия скальпелем. 3-7 мл крови засевают во флакон с 50 мл полужидкого агара. Оставшуюся кровь используют для серологического исследования.
СМЖ берут стерильной пипеткой из околооболочечного пространства в момент извлечения головного мозга из черепной полости и немедленно засевают в чашку Петри с «шоколадно»-кровяным агаром, а также с сывороточным агаром с линкомицином и в среду обогащения — полужидкий агар в пробирке. Из остатков СМЖ готовят препараты-мазки и окрашивают их 1%-ным водным раствором метиленового синего.
Гной с мозговых оболочек берут стерильным ватным тампоном и засевают на те же среды, что и СМЖ. Из гноя готовят мазки. Возможно приготовление отпечатков с поверхности мозговых оболочек.
Перед взятием материала из органов место разреза прижигают прокаленным шпателем. По участку прижигания делают разрез прокаленным и остуженным скальпелем, после чего из глубины разреза стерильным тампоном берут тканевую жидкость. Ее засевают на применяемые для выделения менингококка питательные среды. Отдельными тампонами берут материал для приготовления препаратов-мазков.
Культуру идентифицируют по той же схеме, что и при выделении менингококка из носоглоточной слизи.
е) Постановка реакции агглютинации (РА) для определения серогруппы менингококка. Для постановки РА на чистые сухие предметные стекла наносят по 1 капле (0,2 мл) иммунной сыворотки каждой серогруппы (разведенной, как указано в «Наставлении» к ней). Для контроля на одно из стекол наносят каплю изотонического раствора натрия хлорида. В каждую каплю вносят петлю (диаметром 1,5-2 мм) бактериальной массы 20-22-часовой культуры менингококка на сывороточном агаре. Бактериальную массу тщательно суспендируют в капле путем размешивания петлей до получения гомогенной опалесцирующей жидкости. После размешивания каждой капли петлю прожигают и остужают. Стекла осторожно покачивают в течение 2-3 мин, после чего просматривают каждую каплю (лучше над вогнутым зеркалом от микроскопа). Просмотр начинают с контрольной капли. Если в контроле жидкость остается равномерно мутной, без комочков и просветлений, то можно приступать к просмотру остальных капель. Если же в контрольной капле имеется агглютинация, то испытуемая культура для серогруппирования в реакции агглютинации непригодна, так как является спонтанно агглютинирующейся. Такие культуры обычно не имеют капсул и не могут быть отнесены к какой-либо серогруппе. Сыворотка, в капле которой отмечена агглютинация, определяет серогруппу изучаемой культуры.
Иногда культура дает реакцию агглютинации одновременно с двумя и более иммунными сыворотками (за счет общих антигенов бактериальной клетки). В таких случаях для точного выявления серогруппы ставят развернутую реакцию агглютинации в лунках полистироловых пластин, смешивая густые взвеси культуры с различными разведениями сыворотки (1:2; 1:4; 1:8 и т.д.). В каждую лунку вносят по капле одного из разведений сыворотки и по капле густой взвеси культуры; в контрольную лунку вместо сыворотки вносят каплю физиологического раствора. Пластины встряхивают в течение 1-2 мин, после чего в каждую лунку добавляют по 1 мл изотонического раствора натрия хлорида и учитывают результаты, начиная с контрольной лунки. Если в ней не отмечается спонтанной агглютинации, то серогруппу определяют в соответствии с той сывороткой, которая дала положительную реакцию при наивысшем разведении. Например, культура агглютинировалась сывороткой группы А при разведении 1:8, сыворотками групп В — 1:2 и С — 1:2. Следовательно, данная культура относится к серогруппе А.
При наличии типовых и субтиповых сывороток определяют антигены наружной мембраны путем ИФА.
ж) Сохранение и пересылка выделенных культур менингококка. Лучшим способом сохранения менингококковой культуры является лиофильное высушивание под вакуумом из замороженного состояния. При отсутствии такой возможности суточную культуру менингококка засевают в столбик полужидкого агара с добавлением 20% сыворотки и помещают в термостат. Через 22-24 ч инкубации появляется рост преимущественно в верхней части среды. На среду наслаивают 1,5-2 мл стерильного вазелинового масла и хранят культуру при комнатной температуре (не в холодильнике!). Из культуры можно производить неоднократные высевы. Ежемесячно ее обновляют.
Культуру в столбике можно транспортировать при условии предохранения от холода и от смачивания пробки. Сохраняющаяся на средах культура менингококка быстро утрачивает капсульный (группоспецифический) антиген, а также приобретает способность к росту на бессывороточных средах.
з) Определение чувствительности выделенных культур менингококка к антибиотикам. Для определения чувствительности менингококка к антибиотикам используют сухие стандартные агаровые основы — среду АГВ или агар Мюллера-Хинтона с добавлением 20% нормальной лошадиной сыворотки. Применяют метод серийных разведений или дискодиффузионный с использованием стандартных дисков. Определяют чувствительность менингококка к пенициллинам (начиная с оксациллинового диска, содержащего 1 мкг), левомицетину, цефалоспоринам 3-го поколения, фторхинолонам.
и) Экспресс-методы микробиологической диагностики менингококкового менингита. В СМЖ больного содержатся не только микроорганизмы, но их антигены и прочие компоненты клеток, особенно при массовой гибели менингококков под действием антибиотиков. В ликворе больного удается быстро обнаружить группоспецифический капсульный полисахарид при помощи гомологичных иммунных сывороток в реакциях преципитации, встречного иммуноэлектрофореза, а также с использованием коммерческих реагентов в реакциях коагглютинации (КоАг) и латекс-агглютинации (ДА) на стекле. Наиболее широкое применение получила реакция ЛА с набором фиксированных на частицах латекса антител к основным возбудителям гнойного менингита — менингококкам серогрупп А и С, H.influenzae, пневмококку, стрептококку группы В.
Реакция латекс-агглютинации, как и близкая к ней реакция КоАг, ставится на стекле в капле прогретой при 100°С СМЖ. Образование хлопьев на фоне просветления в капле ликвора с реагентом указывает на положительный результат. Время проведения реакции — 2-3 мин.
В соответствии с рекомендациями ВОЗ, выявление специфического антигена в СМЖ является таким же бесспорным подтверждением этиологии менингита, как и выделение из СМЖ бактериальной культуры.
Перспективным методом, не нашедшим пока еще применения в широкой практике, является обнаружение в жидкостях организма специфического генного материала при помощи ПЦР.
к) Серологическая диагностика менингококковой инфекции. Одним из методов подтверждения менингококковой природы генерализованной инфекции является обнаружение группоспецифических антител к капсульному полисахариду. Антитела появляются в конце первой недели болезни и сохраняются в течение всего заболевания. Образование антител к полисахаридам наблюдается при менингококовом назофарингите и бактерионосительстве, но их уровень ниже, чем при генерализованных формах. Для выявления антител к капсульным полисахаридам используют реакцию непрямой гемагглютинации (РИГА) или иммуноферментный анализ.
При менингококковой этиологии заболевания (менингит, септицемия) в парных сыворотках, из которых одна взята в первые дни болезни, а вторая — на 10-15-й день, отмечается нарастание в 4 раза и более титров антител к полисахариду менингококка той серогруппы, которая вызвала данное заболевание.
Массовые постановки РНГА на наличие антител к группоспецифическим полисахаридам используются эпидемиологами для выявления распространенности той или иной серогруппы среди населения (или в коллективе) в форме бактерионосительства.
РНГА ставят с коммерческими эритроцитарными диагностикумами, содержащими в качестве антигенов капсульные полисахариды менингококков серогрупп А, В и С. Для иммуноферментного анализа используют коммерческую тест-систему.
- Читать далее "Лечение и профилактика менингококковой инфекции"
Редактор: Искандер Милевски. Дата публикации: 27.12.2019
- Менингококк (Neisseria menengitidis): морфологические и культурально-биохимические свойства
- Антигены и генетика менингококка (N. menengitidis)
- Факторы патогенности менингококка (N. menengitidis)
- Патогенез и клиника менингококковой инфекции
- Иммунитет к менингококку (N. menengitidis)
- Эпидемиология менингококка (N. menengitidis)
- Микробиологическая диагностика менингококка (N. menengitidis)
- Лечение и профилактика менингококковой инфекции
