Микробиологическая диагностика туберкулеза
Для выявления М. tuberculosis и других МБ, в соответствии с Приказом МЗ РФ №109 от 21 марта 2003 г., используют световую и люминесцентную микроскопию, культуральные методы и автоматизированные системы. Достаточно активно разрабатываются молекулярно-генетические методы.
а) Виды диагностических материалов. Сбор и обработка. При туберкулезе легких наиболее ценным и доступным диагностическим материалом является мокрота. В случае затруднения отделения пациентом мокроты ее можно индуцировать раздражающей ингаляцией, а также исследовать другие диагностические материалы из верхних дыхательных путей. При внелегочной локализации туберкулеза наряду с материалом из очага поражения желательно параллельно исследовать мокроту. Наиболее сложно ценный диагностический материал получить от детей. Дети, как правило, не контролируют отделение мокроты, часто сглатывают ее. В связи с этим МБ можно обнаружить в промывных водах бронхов и желудка.
1. Мокрота. В условиях ЛПУ мокрота для анализа на туберкулез собирается в кабине для сбора мокроты под надзором медицинского работника. Рекомендуется собирать утреннюю мокроту. Качественным материалом можно считать мокроту, имеющую слизистый или слизисто-гнойный характер, а также содержащую плотные белесоватые включения. При фиброзно-кавернозном туберкулезе мокрота имеет жидкую консистенцию и напоминает водную взвесь мела. Желтоватый, серый или бурый цвет мокроты позволяет предположить диагностическую ценность материала. Достаточный объем исследуемой качественной порции мокроты составляет до 3 мл. Экскреция МБ происходит нерегулярно, поэтому практикуется 3-кратный сбор и анализ мокроты.
2. Индуцированная мокрота по внешнему виду и консистенции напоминает слюну. Для проведения ингаляции рекомендуется 15%-ный раствор хлорида натрия и 1%-ный раствор соды, приготовленный на стерильной дистиллированной воде. Рекомендуется в течение суток после ингаляции собрать мокроту для второго исследования.
3. Материал из бронхов. Любой материал из бронхов может содержать кровь, секрет, поэтому емкость для сбора должны содержать антикоагулянты. Для исследования берут следующие материалы: бронхоальвеолярную лаважную жидкость (БАЛ), аспират из трахеи и дренирующих бронхов, а также материалы прицельной катетер-и браш-биопсии.
4. Промывные воды желудка исследуют преимущественно у детей младшего возраста, которые плохо откашливают мокроту проглатывая ее. Промывные воды желудка берут натощак. Для нейтрализации желудочного содержимого пациенту дают выпить 100-150 мл раствора питьевой соды, приготовленного на стерильной дистиллированной воде. Материал немедленно доставляют в лабораторию. Особенно результативен метод получения промывных вод желудка в сочетании с предварительной аэрозольной ингаляцией. Промывные воды желудка следует забирать через 30 мин после аэрозольной ингаляции. Такая комбинация двух указанных методов более эффективна, чем каждый из них в отдельности.
5. Моча. Среднюю порцию мочи собирают в стерильную посуду после туалета наружных половых органов. Исследование мочи должно предусматривать обязательное троекратное исследование.
6. Тканевые жидкости и ткани: плевральная, синовиальная, спинномозговая, перикардиальная, асцитическая, кровь, гной, пунктаты, соскобы и т.д. следует собирать с добавлением эффективных антикоагулянтов.
7. Менструальная кровь. Наличие большого количества протеолитических, фибринолитических и других ферментов обусловливает необходимость незамедлительной доставки материала в лабораторию. Менструальную кровь следует собирать вакуумным отсосом или колпачком Кафки в пробирку с раствором антикоагулянта. Кровь отмывают дистиллированной водой путем центрифугирования.
8. Каловые массы собирают в стерильную посуду. Небольшое количество кала (1,0 г) гомогенизируют в 3-5 мл 3%-ного раствора цитрата натрия. Грубые фракции осаждают, а супернатант собирают, центрифугируют и исследуют полученный осадок.
9. Центрифугирование. Следует использовать центрифугу с антиаэрозольной защитой, охлаждением и силой центрифугирования 3000g. Мочу центрифугируют, используя метод накопления осадка. В дальнейшем исследуют осадок.
10. Гомогенизация. Плотный материал в условиях соблюдения стерильности измельчают и гомогенизируют в 0,5-1,0 мл изотонического раствора. Постепенно доводят объем изотонического раствора до 4—5 мл. Полученную массу отстаивают 1—2 мин. Затем надосадочную жидкость центрифугируют готовят мазок.
11. Хранение материала. Срок сохранения мокроты в холодильнике без добавления консервирующих средств не должен превышать 72 часов. Другие материалы должны доставляться в лабораторию в течение нескольких часов по мере их сбора. Следует избегать длительного хранение материала в условиях высокой температуры и воздействия прямого солнечного света или ультрафиолетового излучения.
12. Транспортировка. Транспортировка инфекционного материала проводится в соответствии с принятыми нормами и правилами, о чем должны быть инструктированы все задействованные лица. Во время транспортировки материал следует предохранять от воздействия прямых солнечных лучей и тепла. В условиях Крайнего Севера диагностический материал может быть однократно заморожен. Рекомендуется синхронизировать сбор диагностических материалов и их доставку.
б) Микроскопические методы. Основным методом выявления кислотоустойчивых микобактерий (КУМ) в клинико-диагностических лабораториях общей лечебной сети является микроскопия препаратов патологического материала, окрашенных по методу Циля-Нельсена. На основании микроскопического исследования возможно сделать заключение только о наличии или отсутствии в препарате КУМ. Это объясняется тем, что в природе существует большое разнообразие видов МБ, включая НТМБ, одинаково хорошо воспринимающих окраску раствором карболового фуксина.
1. Приготовление мазка для микроскопии. Для приготовления нативного мазка (прямая микроскопия) мокроты достаточен объем 100-200 мкл (чуть более объема спичечной головки). Из мокроты выбирают гнойные или белесые комочки и тщательно растирают на предметном стекле подходящим шпателем. Лучше всего использовать заточенные деревянные палочки. Мазок должен иметь оптимальную толщину. Если мазок слишком тонкий, можно получить ложноотрицательный результат. Если мазок слишком толстый, это затрудняет его фиксацию и качественную окраску. При оптимальной толщине мазка мокроты через него можно прочитать газетный шрифт, расположенный позади стекла на расстоянии до 10 см. Мазок должен располагаться ближе к центру предметного стекла, занимая площадь 1x2 см. Такая площадь мазка вполне достаточна для проведения эффективного микроскопического исследования.
Для приготовления мазка из осадка, последний ресуспендируют и наносят на стекло 1-2 капли, распределяя его тонким слоем.
Наличие кислых солей в моче может мешать проведению окраски МБ. Во избежание этого необходимо скорректировать pH материала в пределах 6,8-7,5.
2. Фиксация препаратов. Мазки сушат при комнатной температуре в шкафу биологической безопасности до полного высыхания, затем фиксируют. Если фиксируют над пламенем горелки, то общая продолжительность пребывания стекла в пламени не превышает 3-5 секунд при толщине стекла 1,2 мм. Можно фиксировать в сухожаровом шкафу при температуре 85°С в течение 75 мин. Мазки окрашивают сразу после фиксации, чтобы они не набирали влагу и не смывались в ходе окраски.
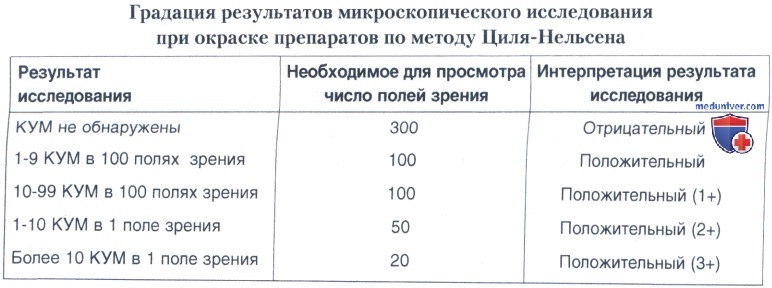
3. Микроскопия. Окрашенные препараты просматривают в световом микроскопе с иммерсионной системой. При микроскопическом исследовании препарата, окрашенного по методу Циля-Нельсена, следует просматривать не менее 100 полей зрения, что обычно вполне достаточно, чтобы обнаружить в препарате единичные КУМ. Если результат такого исследования оказывается отрицательным, для подтверждения необходимо просмотреть дополнительно 200 полей зрения. Результат исследования можно получить в течение 1 ч, но обычно он выдается через 24 ч.
Преимуществом бактериоскопического выявления КУМ в патологическом материале от больных туберкулезом является доступность метода, его экономическая привлекательность и быстрота получения результата. Однако он обладает сравнительно невысокой аналитической чувствительностью (необходимо, чтобы в 1 мл исследуемого материала содержалось более 5-10 тыс. микробных клеток), но тем не менее его диагностическая чувствительность приближается к 70%, а специфичность составляет более 95%, что позволяет не только верифицировать диагноз туберкулеза, но и выявить наиболее эпидемически опасных пациентов.
Другим методом выявления КУМ является люминесцентная микроскопия с окраской аурамином-родамином. Этот метод получил распространение в специализированных противотуберкулезных учреждениях. Он обладает большей разрешающей способностью ввиду большей контрастности изображения и использования меньшего увеличения, что вместе позволяет значительно сократить время исследования препаратов и улучшить комфортность работы (см. Приказ МЗСР от 21.03.2009 №109).
Количество КУМ, обнаруживаемых при микроскопическом исследовании, является очень важным информационным показателем, так как характеризует степень эпидемической опасности больного и тяжесть заболевания. Поэтому микроскопическое исследование должно быть не только качественным, но обязательно и количественным. В таблице ниже представлена градация результатов световой иммерсионной микроскопии препаратов, окрашенных по методу Циля-Нельсена, при использовании объектива 90х — 100х и окуляра 7х — 10х (общее увеличение — 630х-1000х).
в) Бактериологический (культуральный) метод выявления М. tuberculosis. Этот метод заключается в посеве предварительно обработанной мокроты и другого патологического материала на питательные среды. Для эффективного выделения культуры М. tuberculosis достаточно наличия нескольких десятков жизнеспособных бактериальных клеток (20-100 микробных клеток) в образце диагностического материала. Рост культуры продолжается 21-90 дней. Детально методы культуральной диагностики изложены в приложении 11 к Приказу №109 МЗРФ от 21.03.2003 г.
Эффективность культурального исследования зависит в значительной степени от технологии подготовки образцов мокроты. Подготовка материала является необходимой в случае исследования септических диагностических материалов, а также при отсутствии асептических условий при сборе асептических материалов. В силу длительности роста микобактерий неспецифическая микрофлора и грибы не позволяют выявить рост микобактерии туберкулеза. Результаты культивирования зависят от режима разжижения и деконтаминации, срока инкубации, кислотности питательной среды или инокулируемого материала, поскольку все это существенно влияет на жизнеспособность микобактерий. Оптимальным считается метод, разработанный Kent и Kubica. Для разжижения используют раствор, получаемый при смешивании равных объемов 3%-ного раствора трехзамещенного цитрата натрия и 4%-ного раствора гидроксида натрия (NaOH) с добавлением N-ацетил-L-цистеина (NALC) в концентрации 0,5%.
Разжиженные образцы инкубируют в течение 20 мин с последующим центрифугированием при 3000 g в течение 15 мин. Осадок используют для приготовления мазков для микроскопии и посева в пробирки с питательной средой. Для посева на плотные питательные среды объем инокулята составляет 0,2 мл на пробирку, при посеве на жидкие — 0,5 мл.
Питательные среды можно разделить на 3 основные группы: плотные на яичной основе; плотные или полужидкие на агаровой основе; жидкие синтетические и полусинтетические.
Рекомендуется производить посев обработанного и обогащенного (осадок после центрифугирования при силе центрифугирования не менее 3000 g) диагностического материала одновременно на 2-3 питательные среды разного состава. В России наиболее широкое распространение получили плотные питательные среды Левенштейна-Иенсена и Финн-Н. Эти среды отличаются по аминокислотному составу и общей кислотности. Они запускают разные механизмы синтеза белков, что увеличивает общую диагностическую чувствительность посева (до 80% при соблюдении кратности исследований и качества сбора материала). Некоторые лаборатории используют также питательные среды Мордовского (среда «Новая»), Аникина (А-6 и А-9), Попеску, Школьниковой, Нетраньяни, Гельберга, за рубежом распространение получила среда Огавы.
Среда Левенштейна-Иенсена применяется во всем мире в качестве стандартной среды для первичного выделения возбудителя туберкулеза и определения его лекарственной чувствительности. Для культивирования М. bovis среду Левенштейна-Иенсена обогащают пируватом натрия в конечной концентрации 0,5%, исключив из солевого раствора глицерин.
Среда Финн-II рекомендована в нашей стране как вторая стандартная среда для выделения МБ. Она отличается от среды Левенштейна-Иенсена тем, что вместо L-аспарагина в ней используется глутамат натрия, и подбор солей рассчитан таким образом, что конечная кислотность среды (pH 6,3-6,8) имеет более низкое значение и большую стабильность по сравнению со средой Левенштейна-Иенсена. Эти свойства обусловливают более высокую высеваемость при засеве материала, обработанного щелочными детергентами. Рост МБ на этой среде появляется на несколько дней раньше, чем на среде Левенштейна-Йенсена, а выделение культур на 6-8% чаще.
Вирулентные культуры М. tuberculosis обычно растут на плотных питательных средах в виде R-колоний (от англ, rough — грубый, шершавый) различной величины и вида, имеют желтоватый или слегка кремовый оттенок (цвет слоновой кости), шероховатую поверхность, напоминающую манную крупу или цветную капусту. Колонии, как правило, сухие, морщинистые, но в случае диссоциации могут встречаться и влажные, слегка пигментированные колонии, розовато-желтый пигмент которых резко отличается от оранжевого либо желтого пигмента сапрофитных или некоторых туберкулезных микобактерий. Последние обычно растут в виде S-формы.
При выделении культуры кислотоустойчивых микобактерий, отвечающих вышеперечисленным характеристикам (появление роста колоний на плотных питательных средах не ранее чем через 3-4 нед инкубации, наличие колоний характерной морфологии и окраски, микроскопическое подтверждение кислотоустойчивости выделенного микроорганизма при окраске по Цилю-Нельсену) следует произвести количественную оценку интенсивности роста.
Интенсивность роста в пробирках оценивают по трехбалльной системе:
(1+) — 1-20 КОЕ — скудное бактериовыделение;
(2+) — 21-100 КОЕ — умеренное бактериовыделение;
(3+) — >100 КОЕ — обильное бактериовыделение.
г) Идентификация М. tuberculosis на основании культуральных свойств. Первичная идентификация М. tuberculosis осуществляется по следующим культуральным характеристикам: медленный рост культур (более 3 недель); цвет слоновой кости в R- или S-формах; выраженная кислотоустойчивость при окрашивании.
Несмотря на то, что предварительное заключение о выделении М. tuberculosis может быть сделано на основании вышеперечисленных признаков, необходимо подтверждение принадлежности выделенной культуры к М. tuberculosis на основании дополнительных, специальных лабораторных тестов.
Многие тесты, основанные на культуральных исследованиях способности роста М. tuberculosis в присутствии определенных химических реагентов, проводятся одновременно с определением лекарственной чувствительности.
При наличии лекарственной устойчивости ко всем основным противотуберкулезным препаратам (ГТТП) необходимо убедиться, что исследуемая культура не принадлежит к НТМБ, для которых этот феномен является характерным. При этом следует иметь в виду, что видимый рост на среде с салициловокислым натрием появляется позже срока, установленного для учета лекарственной устойчивости.
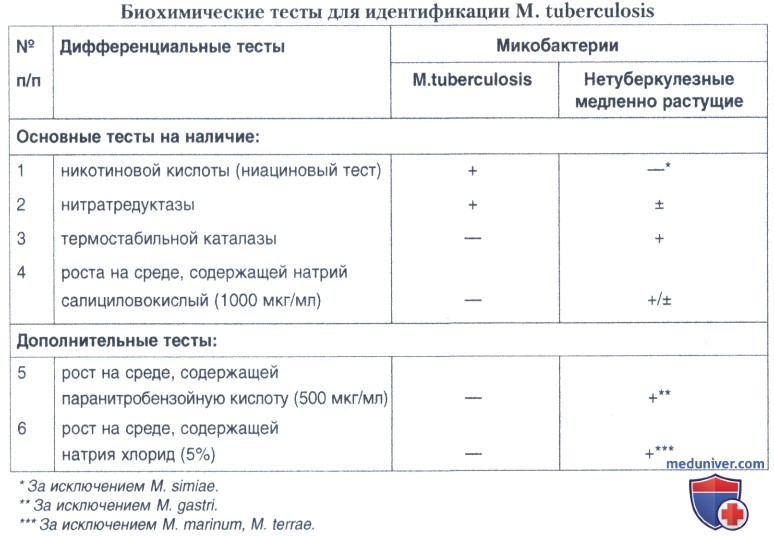
К сожалению, не существует какого-либо одного лабораторного метода, позволяющего достоверно отличать М. tuberculosis от других КУМ. Тем не менее сочетание вышеописанных признаков с результатами ряда приводимых ниже биохимических тестов позволяет провести идентификацию М. tuberculosis с точностью до 95%. Биохимические тесты для идентификации М. tuberculosis представлены в таблицах ниже.
Признаками, характерными для М. tuberculosis, являются:
- оптимальная температура роста 37"С;
- медленная скорость роста (3 и более нед.);
- отсутствие пигментообразования (цвет слоновой кости);
- выраженная кислотоустойчивая окраска;
- положительный ниациновый тест;
- положительный нитратредуктазный тест;
- отсутствие термостабильной каталазы (68"С);
- отсутствие роста на среде Левенштейиа-Йенсена, содержащей 1000 мкг/мл натрия салициловокислого, 500 мкг/мл паранитробензойной кислоты (ПНБК) и 5% хлорида натрия;
- рост в присутствии 1-5 мкг/мл ТСН (гидразид тиофен-2-карбоксиловой кислоты); М. bovis — не растет.
Постановку ниацинового теста (на продукцию никотиновой кислоты) осуществляют с помощью специальных ниациновых полосок (фирмы Difco) с культурой, выращенной на среде Левенштейна-Йенсена. Нитрат-редуктазу определяют по методу Грисса с культурой, выращенной на среде Левенштейна-Йенсена, содержащей нитрат калия KNO3 из расчета 100,0 мг на 100,0 мл среды, на 8-12-й день после посева.
Для выявления роста на средах, содержащих салицилово-кислый натрий, IIНИК и 5% NaCl, используют в качестве основы среду Левенштейна-Йенсена. Для контроля параллельно делается посев на эту же среду без указанных добавок.
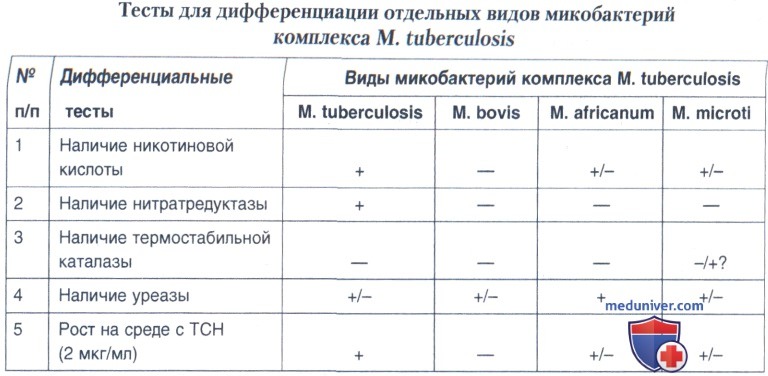
Рост на среде с ТСН определяют на среде Левенштейна-Иенсена, содержащей 1-5 мкг/мл ТСН и, для контроля — не содержащей ТСН.
Термостабильную каталазу выявляют с суспензией испытуемой микобактерии (со среды Левенштейна-Йенсена) в 0,5 мл фосфатного буфера pH — 7,0. Суспензию прогревают в водяной бане при 68°С — 20 мин. После охлаждения к суспензии добавляют 0,5 мл свежеприготовленного раствора перекиси водорода Н2O2 (0,2 мл пергидроля на 10,0 мл дистиллированной воды). При положительном результате из смеси выделяются пузырьки кислорода. Пробирки выдерживают 20 мин, прежде чем зарегистрировать отрицательный результат.
Способы приготовления дифференциальных сред приведены в отдельных статьях раздела общая медицинская микробиология на сайте.
Видео строение, микробиология возбудителя туберкулеза (M. tuberculosis)
- Читать далее "Механизмы лекарственной устойчивости возбудителя туберкулеза (Mycobacterium tuberculosis)"
Редактор: Искандер Милевски. Дата публикации: 6.12.2019
- Микробиологическая диагностика туберкулеза
- Механизмы лекарственной устойчивости возбудителя туберкулеза (Mycobacterium tuberculosis)
- Определение лекарственной чувствительности возбудителя туберкулеза (Mycobacterium tuberculosis)
- Молекулярно-генетическая диагностика микобактерий туберкулеза (Mycobacterium tuberculosis)
- Лечение туберкулеза (Mycobacterium tuberculosis)
- Профилактика туберкулеза (Mycobacterium tuberculosis)
