Определение лекарственной чувствительности возбудителя туберкулеза (Mycobacterium tuberculosis)
Кратность и сроки определения лекарственной чувствительности МБТ:
- до начала лечения однократно для определения стратегии и тактики лечения
- при выделении от больного нескольких культур из однородного материала (мокрота) за короткий промежуток времени исследуется ЛЧ одного из штаммов
- при выделении от больного культур из различного материала (мокрота, БАЛ, моча, экссудаты, ликвор и др.) исследуются все выделенные штаммы
- в конце интенсивной фазы лечения при отсутствии положительной клиникорентгенологической динамики
- при необходимости изменения схемы лечения, например, при ухудшении состояния больного, при плохой переносимости ПТП.
Хорошо известно, что из материала от больных туберкулезом выделяются неоднородные по лекарственной чувствительности пулы МБТ. Устойчивость микобактерий к ПТП может отличаться по спектру препаратов, степени, частоте и скорости появления устойчивости.
Определение лекарственной чувствительности МБТ проводится микробиологическими методами: методом абсолютных концентраций (метод разведений на плотной или жидкой питательных средах), методом пропорций и методом коэффициента резистентности. Обычно устойчивость проявляется в виде визуально наблюдаемого роста колоний МБТ, однако существуют методики, указывающие на рост в ранних стадиях развития культуры клеток микобактерий, в виде цветных реакций. Эти методы сокращают время проведения теста с 3-4 до 2 недель.
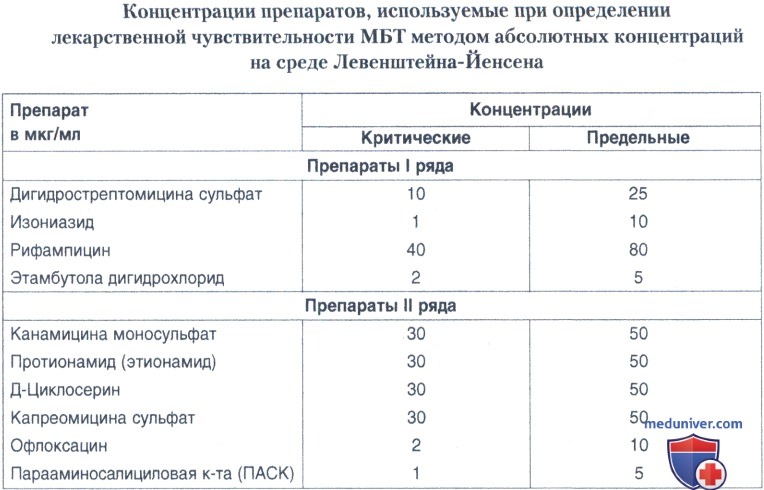
В качестве унифицированного в России получил распространение один из рекомендованных Комитетом по химиотерапии ВОЗ метод абсолютных концентраций, который с методической точки зрения является самым простым, однако требует высокой стандартизации и точности выполнения лабораторных процедур.
а) Метод абсолютных концентраций. Тест на лекарственную чувствительность состоит из набора пробирок с питательной средой, модифицированной противотуберкулезными препаратами, и контрольных пробирок. Набор состоит из 2 пробирок с разными концентрациями каждого из используемых в данной клинике препаратов, одной-двух контрольных пробирок, пробирок, содержащих 1000 мкг/мл салициловокислого натрия, 500 мкг/мл паранитробензойной кислоты для выявления роста нетуберкулезных микобактерий и 2 мкг/мл с ТСН для выявления М. bovis.
Для приготовления набора сред с препаратами используют модифицированную среду Левенштейна-Иенсена (без крахмала), которую разливают в колбы. В каждую из колб добавляют определенный объем соответствующего разведения противотуберкулезного препарата. Содержимое колб тщательно перемешивают, разливают в пробирки и свертывают в наклонном положении в течение 45 мин при температуре 82-85°С. При приготовлении растворов ПТП необходимо учитывать их активную основу, рассчитывая концентрацию с поправкой на молекулярную массу неспецифической части препарата. Для определения лекарственной чувствительности используют только химически чистые субстанции препаратов.
Принцип метода состоит в определении степени подавления роста МБТ (критерий роста) на пробирке с критической концентрацией ПТП. Вторая концентрация (превышающая критическую от 2 до 10 раз в зависимости от Г1ТП) служит для оценки достоверности проведенного теста при наличии пограничных значений роста, а также предположения о наличия перекрестной устойчивости с другими препаратами. Используется непрямой метод определения ЛЧ, то есть из культуры клеток МБТ, предварительно выделенной от больного на питательных средах.
Перед постановкой теста необходимо убедиться, что выделенная культура МБТ не имеет посторонней микрофлоры. Из культуры МВТ в изотоническом растворе NaCl готовят гомогенную взвесь, содержащую 500 млн. микробных тел в 1 мл (оптический стандарт мутности 5 единиц). Полученную взвесь разводят изотоническом раствором NaCl (1:10) и вносят по 0,2 мл взвеси в каждую пробирку из подготовленного набора на поверхность питательной среды. Засеянные пробирки помещают в термостат при 37"С и выдерживают в горизонтальном положении в течение 2-3 суток, чтобы скошенная поверхность питательной среды была равномерно инокулирована взвесью МВТ. Затем пробирки переводят в вертикальное положение и инкубируют в течение 3-4 недель. Учет результатов проводят через 4 недели.
Поскольку сроки выделения возбудителя из клинического материала на питательных средах составляют не менее 3 недель, результаты определения лекарственной чувствительности указанным методом можно получить не ранее, чем через 7-8 недель после посева материала. В этом заключается один из основных недостатков метода.
Интерпретируют результаты исследования лекарственной чувствительности микобактерий на основе критериев роста.
На плотных средах культура считается чувствительной к той концентрации препарата, которая содержится в среде, если число колоний микобактерий, выросших на данной пробирке с препаратом, не превышает 20 при обильном росте на контрольной пробирке без ПТП. Только при наличии более 20 колоний культура расценивается как устойчивая к данной концентрации. На практике при получении результатов роста в опытных пробирках, близких к 20 КОЕ, клиническое подразделение необходимо известить, что чувствительность или устойчивость в этом случае носит пограничный характер, так как иногда этим можно объяснить расхождение результатов теста ЛЧ и динамики клинических показателей в ходе лечения больного.
Для различных препаратов установлена определенная концентрация, при которой наблюдается размножение критической доли микобактериальной популяции. Эти концентрации носят название «критические». В качестве критерия устойчивости, используют величину роста популяции микобактерий на питательной среде с препаратом в критической концентрации.
В практике при определении лекарственной устойчивости не ограничиваются определением только критических концентраций. Это связано с тем, что расширенное определение уровня лекарственной устойчивости возбудителя позволяет клиницисту более правильно сформировать тактику химиотерапии, используя знания о потенцирующем действии комбинаций лекарственных препаратов, предвидеть перекрестную устойчивость, или рекомендовать более эффективные препараты используемой группы ПТП.
Метод абсолютных концентраций сравнительно прост, однако наиболее чувствителен к возможным процедурным ошибкам при его выполнении.
Более достоверным, особенно при определении чувствительности к препаратам 2-го ряда, и распространенным вне России является метод пропорций. В нем учтены недостатки метода абсолютных концентраций, однако в исполнении он более трудоемок.
б) Метод пропорций. Метод очень похож на метод абсолютных концентраций. Приготовление тестовых пробирок с лекарственными препаратами производится так же, как в методе абсолютных концентраций. Однако посевная доза суспензии МБТ снижена в 10 раз по сравнению с вышеописанным методом, нивелируя частоту спонтанной устойчивости некоторых штаммов микобактерий туберкулеза к таким препаратам, как этамбутол, протионамид, капреомицин. В качестве контрольных используют 2 или 3 пробирки с посевной дозой, равной в тестируемых пробирках и последовательно разведенных 10 и 100 раз. Критерием устойчивости служит доля визуально наблюдаемого роста МБТ. Для препаратов первого ряда критерием устойчивости служит превышение роста 1% от исходной популяции, для препаратов второго ряда критерием устойчивости служит рост 10% и более от исходной.
в) Метод коэффициента резистентности основан на определении соотношения минимальной ингибирующей концентрации (МИК), определяемой для штамма конкретного больного, к МИК лекарственно-чувствительного стандартного штамма М. tuberculosis H37Rv, испытываемых в одном и том же эксперименте. Культура является резистентной, если ее МИК превышает МИК референтного штамма в 4-8 раз. Результаты роста МБТ считаются положительными, если число КОЕ равно или более 20 единиц. Данный метод считается наиболее точным из вышеперечисленных, однако в связи с необходимостью использовать большое количество пробирок с питательной средой он является и наиболее дорогам. Последнее обстоятельство резко ограничивает его применение.
В 2001 г. рабочая группа ВОЗ/Международного Союза борьбы с туберкулезом и легочными заболеваниями внесла коррективы в критерии, используемые в методе пропорций, предложив считать устойчивыми микобактерии, вырастающие на плотной яичной среде Левенштейна-Йенсена при критических концентрациях (см. «Национальное руководство. Фтизиатрия» под ред. М.И. Перельмана, 2008 г.) в объеме, больше чем 1% исходной популяции.
Результаты роста оцениваются через 4 недели как предварительные и через 6 недель культивирования как окончательные.
Для контроля качества определения лекарственной чувствительности микобактерий каждую новую партию среды Левенштейна-Йенсена, предназначенную для этого, принято контролировать параллельным определением чувствительности стандартного музейного штамма H37Rv, который обладает чувствительностью ко всем ПТП.
В последнее время перспективным является метод определения лекарственной чувствительности с помощью полу- и автоматизированных систем. Наиболее совершенными в этой области являются разработки на основе MGIT ВАСТЕС 960 (Becton Dickinson & Company, США). В этом случае лекарственная чувствительность МВТ определяется на основе модифицированного метода пропорций. Для этого фирмой-разработчиком поставляются коммерческие наборы с подробным протоколом для определения лекарственной чувствительности МБТ ко всем ПТП первого ряда.
MGIT ВАСТЕС 960 существенно сокращает время проведения культуральных исследований, позволяя получить полные результаты о культуре МБТ (включая сведения о лекарственной чувствительности) уже через 3 недели с момента сбора материала, в то время как традиционным методом это удается получить лишь к третьему месяцу. Bo-время полученные корректные результаты, когда больной еще находится на интенсивной фазе лечения, компенсируют относительную дороговизну исследований. Очевидно, что подобные бактериологические т ехнологии востребованы в современной фтизиатрической практике, особенно в условиях широкого распространения лекарственной резистентности среди впервые выявленных больных туберкулезом.
Видео строение, микробиология возбудителя туберкулеза (M. tuberculosis)
- Читать далее "Молекулярно-генетическая диагностика микобактерий туберкулеза (Mycobacterium tuberculosis)"
Редактор: Искандер Милевски. Дата публикации: 6.12.2019
- Микробиологическая диагностика туберкулеза
- Механизмы лекарственной устойчивости возбудителя туберкулеза (Mycobacterium tuberculosis)
- Определение лекарственной чувствительности возбудителя туберкулеза (Mycobacterium tuberculosis)
- Молекулярно-генетическая диагностика микобактерий туберкулеза (Mycobacterium tuberculosis)
- Лечение туберкулеза (Mycobacterium tuberculosis)
- Профилактика туберкулеза (Mycobacterium tuberculosis)
